Η παλιά ιστοσελίδα μου στο Σχολικό Δίκτυο
http://users.sch.gr/kbakol/autosch/joomla15/
Εργασίες στη Βιολογία Ι
ISBN: 978-618-86274-1-3
Ολόκληρο το βιβλίο 577 σελίδες σε pdf
1. Προγραμματισμένος κυτταρικός θάνατος: Είδη, φυσιολογικός ρόλος και γονίδια που εμπλέκονται
Εισαγωγή
Η απόπτωση είναι μια από τις ευρύτερα χρησιμοποιούμενες λέξεις
στη σύγχρονη Ιατρική και Βιολογία, αφού μέχρι σήμερα έχουν εντοπιστεί περί τις
20.000 σχετικές αναφορές. Πρόκειται για αρχαία ελληνική λέξη, που στο παρελθόν
έχει χρησιμοποιηθεί σε Ιπποκρατικά και Γαληνικά συγγράμματα, καθώς και σε
συγγράμματα ρωμαίων ιατρών. Συνώνυμο της απόπτωσης είναι ο προγραμματισμένος
κυτταρικός θάνατος, που εκφράζει τη ρυθμιζόμενη ενεργοποίηση ενός προϋπάρχοντος
προγράμματος θανάτου κωδικοποιημένου στο γενετικό υλικό. Τον κυτταρικό θάνατο
κατά τη φυσιολογική ανάπτυξη περιέγραψε για πρώτη φορά ο Glucksmann το 1951. [1]
Το 1965. ο Kerr
μελέτησε το θάνατο των ηπατοκυττάρων, μετά από απολίνωση κλάδου της πυλαίας
φλέβας, όπου διέκρινε εστίες νέκρωσης, αλλά παρατήρησε και διάσπαρτα, μονήρη
ηπατοκύτταρα με συρρικνωμένους πυρήνες και πυρηνικές μάζες, χωρίς ένδειξη λύσης
των λυσοσωμάτων ή στοιχεία φλεγμονής. [2]
Το 1971, μετά από παρατηρήσεις στο ηλεκτρονικό μικροσκόπιο,
διαπίστωσε ότι οι πυρηνικές μάζες ήταν σωματίδια περιβαλλόμενα από μεμβράνη,
που περιείχαν τμήματα συμπυκνωμένης χρωματίνης και κύτταρο πλασματικά οργανίδια
και αποκάλεσε το φαινόμενο «νέκρωση εκ συρρικνώσεως». Το 1972. οι Kerr και Searle. εμπνεόμενοι από την Ιλιάδα.
θεώρησαν ότι η εκλεκτική και προγραμματισμένη απομάκρυνση των κυττάρων από τον
οργανισμό προσομοιάζει με «τα φύλλα που ο άνεμος χαμάδις χέει» και πρότειναν να
ονομαστεί το φαινόμενο «απόπτωση».[3]
Παρόλο που η απόπτωση έχει περιγραφεί εδώ και δεκαετίες ως
ξεχωριστό Βιολογικό φαινόμενο, μόνο πρόσφατα έγιναν σημαντικές πρόοδοι στην
κατανόηση των θεμελιωδών μηχανισμών που τη ρυθμίζουν. Οι περισσότερες γνώσεις
μας για τον αποπτωτικό μηχανισμό προέρχονται από τη μελέτη του νηματοειδούς
σκώληκα Caenorhabditis elegans,
ενώ η μεγαλύτερη πρόοδος συντελέστηκε από την ταυτοποίηση των «γονιδίων θανάτου»
πριν από μία δεκαετία.
Διακρίνονται δύο τύποι
φυσιολογικού κυτταρικού θανάτου:
Ο αποπτωτικός κυτταρικός θάνατος. Συμβαίνουν πρώιμες
αλλαγές στον πυρήνα. Διακρίνεται συμπύκνωση του πυρήνα και της χρωματίνης και
προσκόλληση της χρωματίνης στον πυρήνα. Παρατηρείται σε κύτταρα με μικρή
περιεκτικότητα κυτταροπλάσματος, όπως τα λεμφοκύτταρα και τα κύτταρα του
θυροειδούς αδένα. Η αποβολή γίνεται με φαγοκυττάρωση.
Ο λυσοσωμικός κυτταρικός θάνατος. Συμβαίνουν πρώιμες αλλαγές στο κυτταρόπλασμα. Παρατηρείται σε κύτταρα με διευρυσμένο κυτταρόπλασμα, όπως τα κύτταρα του μαστού και κύτταρα ασπόνδυλων. Η αποβολή γίνεται με σχηματισμό κενοτόπιων.[4]
Εικόνα 1 [4]
Είναι γνωστό ότι υπάρχουν δυο κύριοι τρόποι θανάτου των
ευκαρυωτικών κυττάρων: η νΈκρωση και η απόπτωση. Η νέκρωση είναι η μορφή κυτταρικού
θανάτου που προκαλείται από απότομες κυτταρικές βλάβες. όπως είναι η ισχαιμία,
η υπερθερμία. η υποθερμία, η υποξία. ο φυσικός ή χημικός τραυματισμός.
Χαρακτηρίζεται από ρήξη της κυτταρικής μεμβράνης, οίδημα του κυτταροπλάσματος
και των μιτοχονδρίων, διαρροή κυτταροπλασματικού περιεχομένου και πλήρη λύση
του κυττάρου. Η νέκρωση. σε αντίθεση με την απόπτωση, οδηγεί συχνά σε οξεία
φλεγμονώδη αντίδραση.[5]
Η απόπτωση ή προγραμματισμένος κυτταρικός θάνατος είναι φυσιολογική
μορφή «αυτοκτονίας» του κυττάρου.[6] που εμφανίζεται κατά την εμβρυϊκή ανάπτυξη
[7] και την εξέλιξη των οργάνων.[8, 9] Χαρακτηρίζεται από Βιοχημικές και
μορφολογικές αλλαγές, όπως την ταχεία δημιουργία μαλακής προσεκβολής της
πλασματικής μεμβράνης χωρίς απώλεια της ακεραιότητας της. τη διάλυση του
πυρηνίσκου και του κυτταροσκελετού, την εκτεταμένη καταστροφή στη χρωματίνη,
την κατάτμηση του DΝΑ
σε ολιγονουκλεοσώματα, τη συμπύκνωση του πυρήνα, την απώλεια μιτοχονδριακής
λειτουργίας και τη συρρίκνωση του κυττάρου. Η διάτρηση της κυτταρικής επιφάνειας
έχει ως αποτέλεσμα τη δημιουργία «αποπτωτικών σωματιδίων» διαφόρων μεγεθών και
σύστασης, τα οποία παραμένουν συνδεδεμένα με τη μεμβράνη, φαγοκυτταρώνονται από
γειτονικά κύτταρα και διασπώνται από λυσοσωματικά ένζυμα.
Παρόλα αυτά, έχουν εντοπιστεί και κύτταρα που, κατά το θάνατο
τους, εμφανίζουν μίγμα αποπτωτικών και νεκρωτικών μορφολογικών χαρακτηριστικών.
Η ενδιάμεση αυτή μορφή θανάτου φαίνεται ότι οφείλεται στη διαφορετική κάθε φορά
έκφραση αλληλοεπικαλυπτόμενων νεκρωτικών και αποπτωτικών διαδικασιών και την
κάλυψη της απόπτωσης από τη λεγόμενη «δευτεροπαθή νέκρωση» [10]. Αυτή η
κατάσταση μπορεί να ονομαστεί «νεκραπόπτωση».
Η μορφή του κυτταρικού θανάτου (νεκρωτική, αποπτωτική ή
νεκραποπτωτική) εξαρτάται από την ένταση και τη διάρκεια των τραυματικών
ερεθισμάτων και από τα ενεργειακά αποθέματα του κυττάρου. Σε αντίθεση με την
απόπτωση, η νέκρωση δεν απαιτεί ενέργεια. Έτσι, κύτταρα που έχουν εισέλθει στη
διαδικασία της απόπτωσης, μπορεί στη συνέχεια να υποστούν νέκρωση Λόγω
ελάττωσης των ενεργειακών επιπέδων, όπως υποστηρίζουν ορισμένοι ερευνητές. [11]
Αυτή η αλληλοεπικάλυψη νεκρωτικών και αποπτωτικών φαινομένων είχε ως αποτέλεσμα
τη λανθασμένη ερμηνεία μηχανισμών κυτταρικού θανάτου σε ιστούς που νοσούν και
κυρίως σε ιστούς που εμφανίζουν ισχαιμία. Πρέπει να αποδεχθούμε ότι ο όρος «νέκρωση»
είναι ανακριβής, αφού αναφέρεται σε πληθώρα μεταβολών που εμφανίζονται τόσο
στον «προγραμματισμένο» όσο και στον «τυχαίο» κυτταρικό θάνατο. Επομένως,
επειδή η απόπτωση είναι μια ισχυρά ρυθμιζόμενη και ενεργειακά εξαρτώμενη διαδικασία,
ο όρος «μη αποπτωτικός κυτταρικός θάνατος» είναι πιο κατάλληλος σε σύγκριση με
τον όρο «νέκρωση».
Η ομοιόσταση διατηρείται στους πολυκύτταρους οργανισμούς με την
ισορροπία μεταξύ του κυτταρικού πολλαπλασιασμού και του κυτταρικού θανάτου. Η
απόπτωση είναι η μορφή κυτταρικού θανάτου, χάρη στην οποία επιτυγχάνεται η
συνεχής ανανέωση των ιστών με κυτταρική διαίρεση, ενώ ταυτόχρονα διατηρείται το
επίπεδο σταθερότητας των διαφόρων ιστολογικών διαμερισμάτων. Ο αποπτωτικός
κυτταρικός θάνατος συναντάται σε πολλές φυσιολογικές καταστάσεις στο νευρικό σύστημα
[12] σε ενδοκρινοεξαρτώμενους ιστούς, σε πολλά στάδια επιλογής και διαφοροποίησης
των Β- και Τ-κυττάρων, καθώς και σε παθολογικές καταστάσεις, όπως η ογκογένεση.
τα αυτοάνοσα νοσήματα και οι νευροεκφυλιστικές παθήσεις.[13, 14]
Η κατανόηση των μοριακών μηχανισμών της ρύθμισης και της
ολοκλήρωσης του προγραμματισμένου κυτταρικού θανάτου θα επιτρέψει τη σημαντική
βελτίωση της ανάπτυξης των θεραπευτικών στρατηγικών για πολλές νόσους. Παρά τις
αξιόλογες προόδους των τελευταίων 10 χρόνων, η πλήρης κατανόηση του αποπτωτικού
μηχανισμού δυσχεραίνεται από την πολυπλοκότητα του και το πλήθος των σημάτων
που ελέγχουν την ενεργοποίηση του. Η πολυπλοκότητα του μηχανισμού αυτού
οφείλεται στο γεγονός ότι οι ίδιες οδοί χρησιμοποιούνται και για τη μετάδοση
σημάτων αύξησης και διαφοροποίησης, όπως τα εξωκυττάρια σήματα (τροφικοί παράγοντες
και ορμόνες) καθώς και τα σήματα από γειτονικά κύτταρα, που μπορούν τόσο να
ενεργοποιηθούν και να καταστείλουν τα προγράμματα θανάτου. Η απόπτωση όπως
προκύπτει από τις μελέτες που έγιναν μέχρι σήμερα επιτελείται σε τρία διαδοχικά
στάδια. Αυτά είναι (α) ο προγραμματισμός σε θάνατο από εξωκυττάρια ή
ενδοκυττάρια σήματα. (β) η ολοκλήρωση του κυτταρικού θανάτου μέσω της ενεργοποίησης
των κασπασών και (γ) η απομάκρυνση των διαλυμένων κυττάρων με φαγοκυττάρωση και
η διάσπαση τους από τα λυσοσωματικά ένζυμα των φαγοκυπάρων.[15]
Ένα συγκεκριμένο αποπτωτικό σήμα μπορεί να τροποποιηθεί, να
ενισχυθεί ή ακόμη και να ανασταλεί υπό την επίδραση διαφόρων παραγόντων. Πολλές
ορμόνες (όπως π.χ. οι κυτταροκίνες και οι παράγοντες ανάπτυξης) δρουν ως
γενικοί ή ειδικοί (για συγκεκριμένο ιστό) παράγοντες επιβίωσης, παρεμποδίζοντας
έτσι την έναρξη της απόπτωσης. Αντίθετα, άλλοι ορμονικοί παράγοντες επάγουν ή
ενισχύουν τις αποπτωτικές διαδικασίες, όπως για παράδειγμα τα γλυκό κορτικοειδή
και ο παράγοντας νέκρωσης των όγκων ΤΝF [16]
Ο μεγάλος αριθμός των γονιδίων που σχετίζονται με τη ρύθμιση της
απόπτωσης μπορούν να ταξινομηθούν σε τρεις μεγάλες κατηγορίες: (α) το
επαγωγικά, όπως η οικογένεια των γονιδίων ΙCΕ, που κωδικοποιούν το μετατρεπτικό ένζυμο ιντερλευκίνης-1β, [17]
τα γονίδια ced-3, ced-4, bax, bcl-xS, bid, bim, nip3, nix,
bad, bok, bik, fas,
fas ligand, (β) τα ανασταλτικά,
όπως τα crd-9, bcl-2, bcl-xL, bcl-w, mcl-1, crmA, nrl-3, και (γ) οι παράγοντες μεταγραφής p53, p21/waf, c-myc, c-fos, jun, cdc25.
Κεντρικό ρόλο στην απόπτωση παίζουν τα γονίδια fas και fas ligand, τα οποία κωδικοποιούν
τις πρωτείνες Fas και Fas ligand.[18] Μελέτες in vivo αλλά και in vitro έδειξαν συμμετοχή των
πρωτεϊνών Fas/Fas ligand στην κλωνική εξάλειψη
αυτοαντιδρώντων Τ-κυττάρων σε περιφερικά λεμφικά όργανα και στην εξάλειψη
ενεργοποιημένων Τ-κυττάρων μετά από την αντίδραση τους με ξένα αντιγόνα.[19]
Τελευταία, διαπιστώθηκε και η έκφραση των πρωτεϊνών Fas/Fas ligand και σε θυρεοειδικά κύτταρα και
πιθανολογείται η συμμετοχή της οδού Fas στην παθογένεια αυτοάνοσων θυρεοειδικών αλλά και άλλων
παθήσεων του ενδοκρινικού συστήματα ς. [20, 21, 22]
Από τους πιο σημαντικούς τελεστές (effectors) της απόπτωσης είναι και η
οικογένεια γονιδίων ΙCΕ.
Η πρωτείνη ΙCΕ εμφανίζει
ομολογία με την πρωτείνη CΕD3 του νηματοειδούς σκώληκα, Caenorhabditis elegans από τη μελέτη του οποίου προέκυψαν οι περισσότερες γνώσεις
μας πάνω στην απόπτωση. Όταν τα γονίδια ced3 ή ced4
του C. elegans απενεργοποιούνται,
τα κύτταρα, που φυσιολογικά πεθαίνουν κατά την ανάπτυξη, επιβιώνουν.
Η υπερέκφραση του γονιδίου ICE διαπιστώθηκε ότι προκαλεί απόπτωση ινοβλαστών και νευρικών
κυττάρων. Η αποπτωτική δράση του γονιδίου ICE αναστέλλεται από την έκφραση του bcl-2 και του γονιδίου crmA. Η πρωτεΐνη που
κωδικοποιείται από το γονίδιο crmA είναι ειδικός αναστολέας της πρωτεΐνης ICE. Επομένως, μπορούμε να υποθέσουμε
ότι, στην απόπτωση που παρατηρείται κατά την ανάπτυξη των σπονδυλωτών, η
πρωτείνη ICE παίζει παρόμοιο ρόλο με αυτόν της CED3 στην ανάπτυξη του C. elegans [23, 24, 25] Ένα δυνητικό
υπόστρωμα για τις πρωτεάσες ICE.
/CED3. κατά τη
διαδικασία της απόπτωσης, είναι η πολυ-ΑDΡ-ριβο-πολυμεράση ΡΑRΡ, ένζυμο που σχετίζεται με την επιδιόρθωση του DΝΑ και την προστασία της
ακεραιότητας του γονιδιώματος.[26] Η πρωτεόλυση του ενζύμου ΡΑRΡ από ένα ένζυμο της οικογένειας ICE έχει
ως αποτέλεσμα τη μη επιδιόρθωση του DΝΑ και την έναρξη της απόπτωσης [27].
Εκτός όμως από τα παραπάνω γονίδια, που η έκφραση τους προκαλεί
την ενεργοποίηση της απόπτωσης, ενδιαφέρον παρουσιάζουν και γονίδια των οποίων
η έκφραση αναστέλλει τον προγραμματισμένο κυτταρικό θάνατο, τα λεγόμενα
ανασταλτικά αποπτωτικά γονίδια.
Στην κατηγορία αυτή. σημαντική θέση κατέχουν τα γονίδια που
κωδικοποιούν μέλη της οικογένειας πρωτεϊνών Βcl-2.[28, 29]
Η οικογένεια των πρωτεϊνών Βcl-2 έχει κεντρικό ρόλο στη ρύθμιση της απόπτωσης και συσχετίζεται
με την παθογένεια πολλών παθήσεων.
Μελέτες του γονιδίου bcl-2 αποκάλυψαν ότι αλληλεπιδρά και με ένα άλλο γονίδιο, που ονομάζεται
bax και κωδικοποιεί την
πρωτεϊνη Bax. Η πρωτεϊνη
αυτή. η οποία ανήκει στην ίδια οικογένεια πρωτεϊνών, σχηματίζει ετεροδιμερή με
την Βcl-2 και η αναλογία
των Βcl-2/Βax καθορίζει την επιβίωση των
κυττάρων μετά από ένα αποπτωτικό ερέθισμα, όπως για παράδειγμα ύστερα από την
ελάττωση ενός παράγοντα ανάπτυξης. Συγκεκριμένα, σε αναστολή της έκφρασης του
γονιδίου bcl-2, η
διέγερση της απόπτωσης απαιτεί την έκφραση του γονιδίου Bax. Όταν όμως συνεκφράζονται τα γονίδια
bcl-2 και bax, η πρωτεϊνη Bax ενώνεται με την Βcl-2 και έτσι η δράση των
γονιδίων αυτών εξουδετερώνεται στην απόπτωση. Η αποτυχία σύνδεσης της πρωτείνης
Βax γύρω από την Βcl-2 προκαλεί την έναρξη της
απόπτωσης, καθώς επίσης και τη δημιουργία Βax ομοδιμερών.[30]
Το πρωτο-ογκογονίδιο c-myc και
το γονίδιο p53 παίζουν
σημαντικό ρόλο στην απόπτωση. Το c-myc πιθανότατα μπορεί να διεγείρει τόσο τον πολλαπλασιασμό όσο
και την απόπτωση. Όμως. η επιλογή ενός κυττάρου για την είσοδο σε μία από τις
δυο πορείες καθορίζεται από άλλα σήματα, όπως η παρουσία αυξητικών παραγόντων.
Η επαγωγή της απόπτωσης μέσω ενεργοποίησης του γονιδίου c-myc απαιτεί την παρουσία λειτουργικής
πρωτείνης p53. Η
συνεχής έκφραση του γονιδίου c-myc αυξάνει την ευαισθησία
των κυττάρων στην απόπτωση που επάγεται από τις πρωτεϊνες θερμικού shock την κυκλοεξιμίδη, καθώς
και από μια σειρά αντικαρκινικών παραγόντων.[31]
Το γονίδιο p53
χαρακτηρίζεται ως ογκοκατασταλτικό, γιατί η έκφραση του και η παραγόμενη
πρωτεΐνη P53 έχει την
ικανότητα να διακόπτει τον πολλαπλασιασμό και να κατευθύνει το κύτταρο στη
διαδικασία της διαφοροποίησης. Μεταλλάζεις του γονιδίου p53 είναι συχνές σε κάποιους τύπους
καρκίνου, όπως στον καρκίνο του μαστού. Ενώ ο φυσιολογικός τύπος της πρωτεϊνης
Ρ53 παρεμποδίζει την κυτταρική ανάπτυξη in vitro, είναι πιθανό ότι η Ρ53 δεν επηρεάζει άμεσα την επαγωγή της
απόπτωσης σε πολλά είδη κυττάρων.[31, 32] Μεταλλάζεις στο γονίδιο p53 μπορούν να προκαλέσουν
«αθανασία» των κυττάρων με παρεμπόδιση της απόπτωσης και τελικά τη δημιουργία
όγκων. Η πρωτεϊνη Ρ21\WAF
αποδείχθηκε σημαντικός καθοδικός τελεστής της Ρ53 και πιθανός αναστολέας των κυκλινοεξαρτώμενων
κινασών.[33]
Υπάρχουν δύο κύριες οδοί που οδηγούν σε απόπτωση: (α) η θετική επαγωγή
μέσω της σύνδεσης ενός υποκαταστάτη σε υποδοχέα της κυτταρικής μεμβράνης και (β)
η αρνητική επαγωγή με την απώλεια ενός κατασταλτικού σήματος.
Στην περίπτωση της αρνητικής επαγωγής της απόπτωσης, τα κύτταρα
προγραμματίζονται να πεθάνουν όταν σταματούν να λαμβάνουν σήματα επιβίωσης από το
περιβάλλον τους.[34] Το γεγονός αυτό είναι πολύ σημαντικό, αφού εμποδίζει την
ανάπτυξη κυττάρων εκτός της κατάλληλης γι’ αυτά περιοχής και εξαλείφει κύτταρα
με λειτουργίες που δεν συμβάλλουν στην επιβίωση του οργανισμού. Το φαινόμενο
αυτό παρατηρείται στους νευρώνες, οι οποίοι οδηγούνται αυτόματα σε απόπτωση
όταν σταματούν να λαμβάνουν ηλεκτρικά ερεθίσματα ή όταν στερηθούν τους
νευροτροφικούς παράγοντες.[35] Επίσης, εκτός από τα εξωκυττάρια σήματα, τα
κύτταρα έχουν την ικανότητα να λαμβάνουν και ενδοκυττάρια σήματα. Όταν συμβεί
μια εσωτερική βλάβη, η οποία δεν είναι δυνατό να διορθωθεί, το κύτταρο
οδηγείται σε απόπτωση. Παρόμοιος μηχανισμός παρατηρείται και όταν λαμβάνει
ταυτόχρονα αντιφατικά σήματα για κυτταρικό πολλαπλασιασμό ή διακοπή του κυτταρικού
κύκλου.[34]
Κατά τη θετική επαγωγή της απόπτωσης οι μηχανισμοί σημάτων
οδηγούν το κύτταρο άμεσα στο θάνατο. Αυτό παρατηρείται κατά την εξάλειψη των ενεργοποιημένων
περιφερικών Τ-κυττάρων στο τέλος μιας ανοσιακής αντίδρασης, με αποτέλεσμα τη διατήρηση
της ομοιόστασης των λεμφοκυττάρων στην περιφέρεια. [35]
Η αρνητική επαγωγή της απόπτωσης είναι μια πολύπλοκη διαδικασία
μετάδοσης σημάτων με πολλά στάδια, κατά τα οποία είναι απαραίτητη η σύνθεση
πρωτεϊνών. Αντίθετα η θετική επαγωγή απόπτωσης είναι άμεση και ενισχύεται με
αναστολείς της πρωτεϊνοσύνθεσης. Κεντρικό ρόλο παίζουν οι υποδοχείς της
κυτταρικής επιφάνειας, οι λεγόμενοι «υποδοχείς θανάτου».οι οποίοι μεταδίδουν
σήματα από ειδικούς υποκατάστατες και ενεργοποιούν τον αποπτωτικό μηχανισμό των
κασπασών.
Οι υποδοχείς θανάτου που γνωρίζουμε μέχρι σήμερα είναι μέλη της
υπεροικογένειας των γονιδίων που κωδικοποιούν τον υποδοχέα του παράγοντα
νέκρωσης των όγκων ΤΝF.
Τα μέλη της οικογένειας αυτής χαρακτηρίζονται από την παρουσία παρόμοιων
εξωκυττάριων περιοχών, που είναι πλούσιες σε κυστείνη. Επίσης, οι υποδοχείς
θανάτου αποτελούν και μια υποομάδα στην υπεροικογένεια υποδοχέων ΤΝFR, με μια ομόλογη
κυτταροπλασματική περιοχή 80 αμινοξέων, η οποία ονομάζεται «περιοχή θανάτου» DD [36] και συμμετέχει στην
απόπτωση. Οι περιοχές θανάτου επιτρέπουν στους υποδοχείς θανάτου να συνδεθούν
με τον αποπτωτικό μηχανισμό, ενώ σε κάποιες περιπτώσεις είναι διαμεσολαβητές και
σε λειτουργίες διαφορετικές από την απόπτωση, όπως στην ενεργοποίηση του
μεταγραφικού παράγοντα ΝF-κΒ.
Είναι ακόμη γνωστό ότι κάποια μόρια-προσαρμοστές περιέχουν και αυτά περιοχές
θανάτου, προκείμενου να μεταβιβάζουν σήματα από τους υποδοχείς θανάτου.
Κύριο συστατικό του αποπτωτικού μηχανισμού στα θηλαστικά είναι η
οικογένεια πρωτεασών που ονομάζονται κασπάσες. Τα ένζυμα αυτά συμμετέχουν σε
μια αλυσιδωτή αντίδραση, που πυροδοτείται από προαποπτωτικά σήματα και οδηγεί
στην κατάτμηση του DΝΑ
και στη διάλυση του κυττάρου. Το πρώτο μέλος της οικογένειας των κασπασών, το
οποίο ταυτοποιήθηκε, είναι η πρωτεΐνη ΙCΕ ή κασπάση-1. Μέχρι σήμερα έχουν ταυτοποιηθεί 15 κασπάσες
θηλαστικών με διαφορετικούς ρόλους στη φλεγμονή και στην απόπτωση [37]
Στην απόπτωση, οι
κασπάσες λειτουργούν είτε ως εναρκτές, είτε ως τελεστές της διαδικασίας
διάλυσης του κυττάρου ως απάντηση σε προαποπτωτικά σήματα. Όπως και οι άλλες
πρωτεάσες, οι κασπάσες συντίθενται ως ανενεργά προένζυμα και διαθέτουν 3
περιοχές: (α) ένα αμινοτελικό άκρο που ποικίλλει στο μήκος (από 23 έως 216
αμινοξέα) και την αλληλουχία των αμινοξέων του και το οποίο σχετίζεται με την
ενεργοποίηση των προενζύμων. (β) μια μεγάλη υποομάδα και (γ) μια μικρή υποομάδα
Η ενεργοποίηση των προ-ενζύμων οδηγεί σε συνένωση της μεγάλης και της μικρής
υποομάδας, οι οποίες σχηματίζουν μ' αυτόν τον τρόπο ένα ετεροδιμερές. Από τη
μελέτη των κασπασών -1 και -3 προκύπτει ότι δυο διμερή συνενώνονται και σχηματίζουν
ένα τετραμερές με δυο καταλυτικές περιοχές, οι οποίες φαίνονται να λειτουργούν
ανεξάρτητα μεταξύ τους.[38, 39]
Οι κασπάσες είναι από τις πιο ειδικές πρωτεάσες. Απαραίτητη
προϋπόθεση για επαρκή κατάλυση είναι η αναγνώριση τεσσάρων τουλάχιστον
αμινοξέων στο αμινοτελικό άκρο της περιοχής διάσπασης. Η τετραπεπτιδική
χωροδιάταξη. η οποία αναγνωρίζεται, είναι διαφορετική για τους διάφορους τύπους
κασπασών. Το γεγονός αυτό εξηγεί την ποικιλομορφία των Βιολογικών τους
λειτουργιών [40] Επιπλέον δεν διασπώνται όλες οι πρωτεΐνες με το συγκεκριμένο
τετραπεπτίδιο. γεγονός που υποδηλώνει ότι στοιχεία τεταρτοταγούς δομής επηρεάζουν
την αναγνώριση.
Η υψηλή ειδικότητα των κασπασών συμφωνεί με την παρατήρηση ότι
στην απόπτωση δεν επισυμβαίνει αδιάκριτη πέψη πρωτεϊνών. Αντίθετα, επιλεγμένη
ομάδα πρωτεϊνών διασπάται με συντονισμένο τρόπο, συνήθως σε μία μόνο περιοχή,
κι αυτό έχει ως αποτέλεσμα την απώλεια ή μεταβολή της λειτουργίας της
πρωτεΐνης. Με Βάση την ειδικότητα ενζύμου-υποστρώματος. οι κασπάσες διαχωρίζονται
σε τρεις κατηγορίες. Μέλη της πρώτης ομάδας (Ι) είναι οι κασπάσες -1, -4 και
-5, που έχουν προτίμηση σε υποστρώματα με την αλληλουχία αμινοξέων WEHD. Μέλη της δεύτερης
ομάδας (II) είναι οι κασπάσες -2, -3, -7 και CΕD-3, οι
οποίες προτιμούν την αλληλουχία DΕΧD, με απόλυτη απαίτηση την
παρουσία ενός ασπαρτικού (D)
αμινοξέος στη θέση Ρ4. Τα μέλη της τρίτης ομάδας (III) είναι οι κασπάσες -6,
-8, -9 και το ‘aspase’ granzyme B, που αναγνωρίζουν αλληλουχίες
(I/L/V) ΕΧD.
Σύμφωνα με τα ερευνητικά δεδομένα, φαίνεται ότι οι κασπάσες της ομάδας Ι
ενέχονται πρωταρχικά στη φλεγμονή, ενώ αυτές της ομάδας II και της ομάδας III
είναι σημαντικές για τη μετάδοση σημάτων και την επιτέλεση της απόπτωσης.[37]
Πολλά από τα γεγονότα-κλειδιά της απόπτωσης, όπως η απελευθέρωση
ενεργοποιητών των κασπασών (π.χ. κυτόχρωμα c), οι μεταβολές στη μεταφορά ηλεκτρονίων, η απώλεια του διαμεμβρανικού
δυναμικού των μιτοχονδρίων, η τροποποίηση της κυτταρικής οξειδοαναγωγής και η
συμμετοχή προ- και αντιαποπτωτικών Βcl-2 πρωτεϊνών, συμβαίνουν στα μιτοχόνδρια. Αν και η απόπτωση
είναι ανεξάρτητη της οξειδωτικής φωσφορυλίωσης (δεν απαιτεί την ύπαρξη
μιτοχονδριακού DΝΑ).
έχει αναγνωριστεί πλέον σε πολλά συστήματα ο κεντρικός ρόλος των μιτοχονδρίων
σ' αυτή τη διαδικασία [41]
Στην οικογένεια πρωτεϊνών Βcl-2 υπάρχουν αντιαποπτωτικά μέλη που συμβάλλουν στην επιβίωση
των κυττάρων, αλλά και προαποπτωπκά. όπως η πρωτεΐνη Βax. που μπορούν να προκαλέσουν μιτοχονδριακή
καταστροφή και κυτταρικό θάνατο, ακόμα κι όταν οι κασπάσες είναι απενεργοποιημένες
[42] Αυτές οι ερευνητικές παρατηρήσεις δημιουργούν το ερώτημα εάν υπάρχει ένας
μηχανισμός, ανεξάρτητος των κασπασών. που να συνδέεται με τον προγραμματισμένο
κυτταρικό θάνατο. Σ' αυτόν το μηχανισμό φαίνεται ότι εμπλέκονται τα
μιτοχόνδρια. Είναι γνωστοί τουλάχιστον τρεις γενικοί μηχανισμοί πυροδότησης
κυτταρικού θανάτου από τα μιτοχόνδρια, που πιθανόν σχετίζονται μεταξύ τους: (α)
η διακοπή της μεταφοράς ηλεκτρονίων, της οξειδωτικής φωσφορυλίωσης και της
παραγωγής ΑΤΡ. (β) η απελευθέρωση πρωτεϊνών που ενεργοποιούν τις κασπάσες και
(γ) η μετατροπή του κυτταρικού δυναμικού οξειδοαναγωγής.
Στα θηλαστικά, τα ανάλογα του ενζύμου CED-9 του C. elegans ανήκουν στην οικογένεια των πρωτεϊνών
Βcl-2 Σε αντίθεση με το
CED -9,
που έχει αποκλειστικά αντιαποπτωτική δράση, τα μέλη της οικογένειας Βcl-2 μπορούν να έχουν τόσο
προαποπτωτική όσο και αντιαποπτωτική δράση.[43] Τα αντιαποπτωτικά μέλη της
οικογένειας (όπως οι πρωτεΐνες Βcl-2
και Βcl -xL)
παρεμποδίζουν την ενεργοποίηση των κασπασών και κατ' επέκταση την απόπτωση
Όμως, οι πρωτείνες αυτές δεν δρουν μόνο με άμεση σύνδεση και απενεργοποίηση του
παράγοντα ΑΡΑF-1, αλλά
και με σταθεροποίηση των μιτοχονδριακών μεμβρανών και παρεμπόδιση της
απελευθέρωσης του κυτοχρώματος c.
Η πρωτεΐνη Βcl-2 αρχικά
ανακαλύφθηκε στα λεμφώματα Β-κυτταρικής σειράς, ως πρωτο-ογκογονίδιο και
χαρακτηρίζεται από τη χρωμοσωμική αναδιάταξη t (15, 32) Προκαλεί ογκογένεση με την καταστολή της απόπτωσης
κυρίως, παρά με την πρόκληση ταχείας κυτταρικής διαίρεσης. Η υπερέκφραση των
αντιαποπτωτικών μελών της οικογένειας Βcl-2 αναστέλλει την απόπτωση, που πυροδοτείται από μια σειρά
ερεθισμάτων, όπως η ελάττωση των παραγόντων ανάπτυξης, η θεραπεία με γλυκοκορτικοειδή
ή με χημειοθεραπευτικούς παράγοντες και η έλλειψη του παράγοντα ΝGF σε νευρώνες. Σε κάποιες
μόνο κυτταρικές σειρές η πρωτεΐνη Βcl-2 φάνηκε να προστατεύει το κύτταρο από την απόπτωση που
επάγεται μέσω των υποδοχέων ΤΝFR
ή Fas.
Τα γονίδια της οικογένειας Βcl-2 είτε αναστέλλουν την απόπτωση (όπως τα bcl-2, bcl-xL, bcl-w, mcl-1, nr-13, και A1/Bfl-1) είτε την επάγουν (όπως τα bax, bak, bok,
diva, bsl-Xs, bik, bim, hrk, nip3, nix,
bad, και bid) [43]. Μεταξύ των μελών της
οικογένειας Βcl-2
υπάρχει ομολογία στην αλληλουχία των αμινοξέων και παρουσιάζουν μέχρι και
τέσσερις περιοχές που διατηρούνται σταθερές και ονομάζονται ΒΗ: οι περιοχές
ΒΗ1, ΒH2, ΒΗ3 και ΒΗ4.
Στα προαποπτωτικά μέλη γίνεται φανερό ότι η ΒΗ3 περιοχή είναι απαραίτητη τόσο
για το σχηματισμό διμερών με άλλα μέλη, όσο και για την επαγωγή της απόπτωσης.[44]
[1] GLUCKSMANN
A. Cell death in normal vertebrate
ontogeny. Biol, Rev 1951, 26:59-86
[2] KERR JFR. A histochemical study of hypertrophy and ischaemic injury of rat liver with special reference to
changes in lysosomes.
J Pathol Bacteriol 1965, 90:419-435
[3].KERR JF, WYLLIE AH, CURRIE AR. Apoptosis: a basic
biological phenomenon with wide-ranging implications in tissue kinetics. Br
J Cancer 1972, 26:239-257
[4] http://panacea.med.uoa.gr/scientific/health/embryology/apoptose01.aspx
[5] AMEISEN JC. The origin of programmed cell death. Science 1996, 272:1278-1279
[6] THOMPSON CB. Apoptosis in the pathogenesis and treatment of disease. Science 1995, 267:1456-1462
[7] HAANEN C,
[8]
[9] ATWOOD CS, IKEDA M, VONNDERHAAR
BK, Involution of mouse mammary glands in
whole organ culture: a model for studying programmed cell death, Biochem
Biophys Res Commun 1995, 207:860-867
[10]
PAPASSOTIROPOULOS A, LUDWIG M, NAIB-MAJANI W, ROO GS. Induction of apoptosis and secondary necrosis in rat dorsal root
gan-glium cell cultures by oxidized low density lipoprotein. Neurosci Lettl 996, 209:33-36
[11] SAIKUMAR P, DONG
Z, WEINBERG IM, VENKATACHALAM MA. Mechanisms of cell death in hypoxia/reoxygenation
injury, Oncogene 1998, 17:3341-3349
[12] RUBIN LL, Neuronal cell death: when, why, and how.Br Med Bull 1997,53:617-631
[13] GENC YJ. Regulations of programmed cell death or apoptosis in atherosclerosis. Heart Vessels 1997, 12(Suppl}:76-80
[14] MILAS L, STEPHENS LC, MEYN RE. Relation of apoptosis to cancer therapy, in Vivo 1994, 8:665-673
[15] SEN S. Programmed cell death: concept, mechanism and control. Biological
Review of the
[16] KIESS W, GALLAHER B. Hormonal control of programmed cell death/apoptosis.
Eur J Endocr 1998, 138:482-491
[17] STELLER H.
Mechanisms and genes of cellular suicide.
Science 1995, 267:1445-1449
[18] NAGATA S. Fas ligand and immune evasion. Net Med
1996, 2: 1306-1307
[19] CRISPE IN.
Fatal interactions: fas-induced apoptosis
of mature T cells. Immunity 1994, 1:347-349
[20] WINQVIST
O, SODERBERGH A, KAMPE O. The autoimmune
basis of adrenocortical destruction in Addison's disease. Mol Med Today 1996,
2:282-289
[21] CHERVONSKY
AV, WANG Y, WONG FS, VISINTIN I, FlAVELL RA, JANEWAY CA JR ET AL. The role of
Fas in autoimmune diabetes. Cell 1997, 89:17-24
[22] MITSIADES
N, POULAKI V, KOTOULA V,MASTORAKOS G, TSELENI-BAL-AFOUTA S, KOUTRAS DA ET AL. Fas/Fas ligand up-regulation and Bcl-2 down-regulation
may be significant in the pathogenesis of Hashimoto's thyroiditis, J Clin Endocrinol Metab 1998, 83:2199-2203
[23] STROBEL T,
SWANSON L, KORSMEYER S, GANNISTRA SA. Bax enhances paclitaxel-induced
apoptosis through a p53-independent pathway. Proc Nati Acad Sci
[24] PRONK GL,
RAMER K, AMIRI P, WILLIAMS LT. Requirement
of an ICE-like protease for induction of apoptosis and ceramide generation by
REAPER. Science 1996, 271:808-810
[25] BOUDREAU
N, SYMPSON CJ, WERB Z, BISSEL MJ. Suppression
of ICE and apoptosis in mammary epithelial cells by extracelluar matrix.
Science 1995, 267:891-893
[26] LAZEBNIK
YA, KAUFMANN SH, DESNOYER S, PGIRIER GC, EARNSHAW WC. Cleavage of poly (ADP-ribose) polymerase by a proteinase with
properties like ICE.J Biol Chem 1994, 371:346-347
[27] TANAKA Y,
YOSHIHARA K, ITAYA A, KAMIYA T, KOIDE SS. Mechanism
of the inhibition of Ca2+, Mg2+-dependent endonuclease of bull seminal plasma
induced by ADP-ribosylation. J Biol Chem 1984, 259:6579-6585
[28] KUMAR S. The bcl-2 family of proteins and activation
of the ICE-CED-3 family of proteases: a balancing act in apoptosis? Cell Death
Differ 1997, 4:2-3
[29] PARRIZAS
M, LEROITH D. IGF-I inhibition of
apoptosis is associated with increased expression of the bcl-xL gene product.
Endocrinology 1997, 138:1355-1358
[30] OLTVAI ZN,
MILLIMAN CL, KORSMEYER SJ. Bcl-2
heterodimerizes in vivo with a conserved homolog, Bax, that acce erates
programmed cell death. Cell 1993, 74:609-619
[31] HERMEKING
H, EICK D. Mediation of c-Myc induced
apoptosis by p53. Science 1994, 265:2091-2093
[32] HARRINGTON
EA, BENNETT MR, FANIDI A, EVAN GE. c-Myc
induced apoptosis in fibroblasts is inhibited by specific cytokines. EMBO
71994, 13:3286-3295
[33] SHEIKH MS, ROCHEFORT H, GARCIA M. Overexpression
of p21 WAF1/CIP1 induces growth arrest, giant cell formation and apoptosis in
human breast carcinoma cell lines. Oncogene 1995, 11: 1899-1905
[34] JACQBSQN
MD, WEIL M, RAFF MC. Programmed cell death
in animal development. Cell 1997, 88:347-354
[35] MARSTERS SA,
PITTI RM, SHERIDAN JP, ASHKENAZI A. Control
of apoptosis signaing by Apo2 igand. Rec Prog Horm Res 1999, 54: 225-234
[36] TARTAGLIA
LA, AYRES TM, WONG GH, GOEDDEL DV. A nove
domain within the 55 kd TNF receptor signals cell death. Cell 1993, 74:
845-853
[37] SAIKUMAR
P, DONG Z, M1KHA1LOV V,
[38] WILSON KP,
BiACK JA, THOMSON JA, KIM EE, GRIFFITH JP, NAVIA MA ET AL. Structure and mechanism of interleukin-1 beta converting enzyme.
Nature 1994, 370:270-275
[39] ROTONDA J,
AICHOLSON DW, FAZIL KM, GALLANT M, GAREAU Y, LABEL-LA ET AL. The three - dimensiona structure of apopain
/CPP32, a key model of apoptosis. Nat Struct Biol 1996, 3:619-625
[40] THORNBERRY
NA, RANO TA, PETERSON EP, RASPER DM, TIMKEY T, CAR-CIA-CALVO M ET AL, Acombinatoria approach defines specificities
of members of caspase family and granzyme B. Functional re ationships
established for key mediators of apoptosis. J Biol Chem 1997,
272:17907-17911
[41] JACOBSGN
MD, BURNC JR, KING MP MIYASHITA T, REED JC, RAFF MC. Bcl-2 blocks apoptosis in cells acking mitochondrial DNA. Nature 1993, 361:365-369
[42] XIANG J,
CHAO DT, KORSMEYER SJ. Bax-induced cell
death may not require interleukin 1 beta-converting enzyme. Proc Natl Acad
Sci
[43] REED JC. Bc-2 family proteins. Oncogen 1998,
17:3225 - 3236
[44] KELEKAR A,
THOMPSON CB. Bcl-2-family proteins: the role of the BH3 domain in apoptosis.
Trends Cell Biol 1998, 8:324-330
Η αναπτυξιακή πορεία όλων των πολυκύτταρων οργανισμών
περιλαμβάνει διάφορα αναπτυξιακά στάδια, τα οποία χαρακτηρίζονται από μη
αντιστρεπτές μεταβολές, στην ανατομία, στη φυσιολογία, αλλά και στην
προσαρμοστικότητα αυτών. Οι μεταβολές αυτές, οι οποίες μπορεί να είναι απότομες
ή βαθμιαίες, αυξάνουν την πιθανότητα θανάτου. Το φαινόμενο της αλληλοδιαδοχής
των διαφόρων αναπτυξιακών σταδίων, με τελικό αποτέλεσμα τον θάνατο, καλείται
γήρανση. Η ακριβής χρονική στιγμή του θανάτου δεν είναι ακόμη γνωστό πώς
καθορίζεται βιολογικά. Η γήρανση δεν αποτελεί ένα είδος διαδεδομένης ασθένειας,
αλλά μία φυσιολογική, μη αναστρέψιμη διαδικασία, ένα καθολικό φαινόμενο, που
εμφανίζεται σε όλους τους ανθρώπους και το οποίο συνοδεύεται από ανατομικές και
λειτουργικές μεταβολές σε όλο το σώμα. Έχει προταθεί πως οι μηχανισμοί της κυτταρικής
γήρανσης στους πολυκύτταρους οργανισμούς εξελίχθηκαν ως ένα είδος προστασίας
έναντι της καρκινογένεσης. Οι κυριότερες θεωρίες που προσπαθούν να εξηγήσουν το
φαινόμενο της γήρανσης είναι πρώτη, αυτή, σύμφωνα με την οποία, η γήρανση
στηρίζεται σε γενετικά αίτια και κατ' αυτή, το φαινόμενο είναι αποτέλεσμα
ενεργοποίησης κάποιων γονιδίων που αποκαλούνται γεροντογονίδια και τα οποία
ενεργοποιούν τα διαδοχικά στάδια της γήρανσης και η δεύτερη, θεωρία της
κατάρρευσης της ομοιοστασίας κατά τη γήρανση. Η ομοιοστασία, είναι μια
κατάσταση σταθερότητας ή ισορροπίας μέσα σε ένα βιολογικό σύστημα, η οποία
επιτυγχάνεται μέσω μίας ποικιλίας κυτταρικών μηχανισμών, οι οποίοι εξισορροπούν
τις εσωτερικές και τις εξωτερικές μεταβολές, με σκοπό τη διατήρηση της
φυσιολογικής κατάστασης του οργανισμού. Σύμφωνα με αυτή τη θεωρία, το κύτταρο
σε προχωρημένη ηλικία δεν μπορεί να διατηρηθεί και να λειτουργήσει σωστά όπως
ένα νεαρό κύτταρο, γιατί έχουν υποβαθμιστεί και υπολειτουργούν όλοι οι
μηχανισμοί του. Κοινό χαρακτηριστικό και των δύο θεωριών είναι πως και οι δύο
αποδέχονται την επίδραση διαφόρων εξωγενών παραγόντων, που αυξάνουν την
ποικιλότητα του φαινομένου της γήρανσης και κατά αυτόν τον τρόπο και τη
δυσκολία μελέτης και διαλεύκανσης αυτού. Κατά καιρούς, διάφορα γονίδια και ποικίλοι
κυτταρικοί μηχανισμοί έχουν συσχετισθεί με το φαινόμενο της γήρανσης.
Χαρακτηριστικά παραδείγματα, το γονίδιο της τελομεράσης και ο πρωτεολυτικός
μηχανισμός του πρωτεοσώματος. Οσον αφορά το γονίδιο της τελομεράσης, που κωδικοποιεί
για μία πρωτεΐνη η οποία είναι υπεύθυνη για την αποκατάσταση των άκρων των
χρωμοσωμάτων που υφίστανται βλάβες κατά τον διπλασιασμό του DNA, έχει προταθεί πως η απώλεια
λειτουργίας αυτής της πρωτεΐνης, που έχει αποτέλεσμα τη διαρκή μείωση του μήκους
των τελομερών (των άκρων των χρωμοσωμάτων), σχετίζεται με το φαινόμενο της
γήρανσης. Όσον αφορά το πρωτεόσωμα, το οποίο είναι ένα μεγάλο ενζυμικό
κυτταρικό σύμπλοκο, που ευθύνεται για την αποικοδόμηση τόσο φυσιολογικών
κυτταρικών πρωτεϊνών όσο και αποδιατεταγμένων ή οξειδωμένων κυτταρικών
πρωτεϊνών (ομάδα πρωτεϊνών που συσσωρεύονται καθώς αυξάνεται η ηλικία), έχει
προταθεί πως η υπολειτουργία αυτού του συμπλόκου, με την αύξηση της ηλικίας,
πιθανώς ευθύνεται κατά ένα μεγάλο μέρος για την εξέλιξη του φαινομένου της
γήρανσης.[1]
Κεντρικός στόχος είναι η μελέτη των μορφολογικών και
λειτουργικών χαρακτηριστικών του γηρασμένου κυττάρου και του ρόλου του στην
εμφάνιση ηλικιο-σχετιζόμενων ασθενειών, συμπεριλαμβανομένου του καρκίνου. Η
κυτταρική γήρανση μπορεί να είναι αποτέλεσμα της μείωσης του μήκους των
τελομερών (αναπαραγωγική γήρανση) ή εξωγενών στρες, όπως η υπερέκφραση ογκογονιδίων
και κατά συνέπεια θεωρείται ένας βασικός αντικαρκινικός μηχανισμός. Απεδείχθη,
τόσο με τη χρήση κυτταρικών συστημάτων όσο και με ανάλυση ανθρώπινων
προκαρκινικών ιστών, ότι η πρόκληση γήρανσης μετά από υπερέκφραση ογκογονιδίων
πραγματοποιείται μέσω της ενεργοποίησης των σημείων ελέγχου μετά από βλάβη του DNA (DNA damage checkpoints), υποδεικνύοντας
ότι ο μηχανισμός αυτός μαζί με την απόπτωση παρέχουν ένα φραγμό στην καρκινική ανάπτυξη
[2]
Εικόνα 1 [3]
Είναι πλέον αποδεκτός ο σημαντικός ρόλος του στρώματος στην
ανάπτυξη του όγκου. Επαναλαμβανόμενες θεραπευτικές δόσεις ιονίζουσας
ακτινοβολίας προκαλούν πρόωρη κυτταρική γήρανση σε στρωματικούς ινοβλάστες και
τα γηρασμένα κύτταρα προωθούν την ανάπτυξη των παρακείμενων καρκινικών κυττάρων
τόσο in vitro
όσο και σε ανοσοκατασταλμένους ποντικούς in vivo. Ενας από τους ιστούς που κατεξοχήν επηρεάζεται από την
ηλικίωση είναι ο μεσοσπονδύλιος δίσκος. Το ποσοστό γηρασμένων κυττάρων είναι
αυξημένο στις εκφυλισμένες περιοχές του δίσκου, γεγονός που συνάδει με τον
προ-φλεγμονώδη φαινότυπο του γηρασμένου κυττάρου. Επίσης μελετήσαμε τον
πολλαπλασιασμό των κυττάρων του δίσκου. Ο πολλαπλασιασμός αναστέλλεται υπό
φυσιολογικές συνθήκες (λόγω δυσμενών διατροφικών συνθηκών) και διεγείρεται κατά
τον εκφυλισμό με σκοπό την ιστική επούλωση, τα στρες που δέχονται τα κύτταρα
του δίσκου (όπως το υπερωσμωτικό στρες) προκαλούν βλάβες στο DNA και ενεργοποίηση πρωτεϊνών του στρες
(όπως η p38 MAPK) με αποτέλεσμα την
αναστολή του κυτταρικού κύκλου και ο πολλαπλασιασμός των κυττάρων του δίσκου
από αυτοκρινείς παράγοντες διαμεσολαβείται μέσω των σηματοδοτικών μονοπάτιων ERK και Akt. [2]
Διάφορες γραμμές στοιχείων υποστηρίζουν την ιδέα της κυτταρικής
γήρανσης να καταστέλλει την καρκινογένεση και να ρυθμίζεται από το p53. Πρίν συζητήσουμε αυτά τα στοιχεία, εν συντομία θα επισκοπήσουμε
αυτό που είναι γνωστό για τις αιτίες και τις συνέπειες της κυτταρικής
γήρανσης. Αυτή η
ανασκόπηση θα βοηθήσει στο να τοποθετήσει την ρύθμιση και το ρόλο του p53 στην κυτταρική γήρανση στα πλαίσια της εξέλιξης στους
σύνθετους πολυκύτταρους οργανισμούς, και την κυτταρική και οργανισμική φυσιολογία.
Αναπαραγωγική γήρανση και περιορισμός των τελομερών
Η πρώτη
καλά τεκμηριωμένη επίπτωση της κυτταρικής γήρανσης ήταν αυτή της replicative
γήρανσης: η προοδευτική πτώση στην πολλαπλασιαστική ικανότητα όπου στα
περισσότερα κανονικά ανθρώπινα κύτταρα συμβαίνει συνεπεία της επαναλαμβανόμενης
κυτταροδιαίρεσης. Η αναπαραγωγική γήρανση περιγράφηκε αρχικά για
καλλιεργημένους ανθρώπινους ινοβλάστες [4].
Στη
συνέχεια, πολλοί τύποι μιτωτικώς ικανών κυττάρων από ποικίλα σπονδυλωτά είδη παρουσιάστηκαν
να υπόκεινται σε αναπαραγωγική γήρανση [5].
Η
πλειοψηφία αυτών των μελετών διεξήχθη χρησιμοποιώντας τα κύτταρα που καλλιεργήθηκαν
ex vivo, αλλά ένας περιορισμένος αριθμός μελετών υποστηρίζει την ιδέα κατά την
οποία τα κύτταρα υπόκεινται επίσης σε γήρανση in vivo [6].
Τα πρόσφατα
στοιχεία δείχνουν ότι η replicative γήρανση των κυττάρων του
άνθρωπο οφείλονται στον περιορισμό των τελομερών. Από καιρό έχει εκτιμηθεί ότι τα
τελομερή, το επαναλαμβανόμενο DNA που καλύπτει τις άκρες των γραμμικών
χρωμοσωμάτων, είναι ουσιαστικές δομές που αποτρέπουν την σύντηξη των
χρωμοσωμάτων και την γενωμική αστάθεια [7].
Ελλείψει
του ενζυμικού τελομεράση, που μπορεί να προσθέσει τις τελομερικές επαναλήψεις άμεσα
στα τελομερή, κάθε κύκλος της αντιγραφής του DNA αφήνει αναντίγραφες 50–200 bp από 3' τελομερικό
DNA. Αυτό το χαρακτηριστικό γνώρισμα της σύνθεσης DNA, και
η έλλειψη τελομεράσης στα περισσότερα σωματικά κύτταρα, οδηγούν στην υπόθεση ότι
τα κύτταρα υπόκεινται σε replicative γήρανση όταν αποκτούν ένα ή
περισσότερα κοντά τελομερή [8,9].
Πράγματι,
ανθρώπινες ινοβλάστεις [10] και άλλοι τύποι κυττάρων χάνουν τελομερικό DNA με τον
πολλαπλασιασμό σε καλλιέργεια και in vivo [11].
Επιπλέον,
περιορισμός των τελομερών και αναπαραγωγική γήρανση από μερικά ανθρώπινα
κύτταρα μπορεί να καταργηθεί με την εκτοπική έκφραση της τελομεράσης [12,13].
Κατά συνέπεια, φαίνεται τώρα σαφές ότι τουλάχιστον μερικά κύτταρα με έναν γηρασμένο φαινότυπο σταματούν τη διαίρεση εξ αιτίας του περιορισμού των τελομερών.
Εικόνα 2 Από το p53-
εξαρτώμενη και ανεξάρτητη αναπαραγωγική γήρανση
Ανεξάρτητη από τα τελομερή
κυτταρική γήρανση
Η αναπαραγωγική γήρανση είναι πολύ πιθανώς ένα συγκεκριμένο παράδειγμα από μια γενικότερη διαδικασία, κυτταρικής γήρανσης. Κυτταρική γήρανση συνεπάγεται την απάντηση σε ποικίλα ερεθίσματα και την απόκτηση του χαρακτηριστικού (γηρασμένου) φαινότυπου σε σχέση με τα κανονικά κύτταρα, πολλά εκ των οποίων είναι ενδεχομένως ογκογόνα και στα οποία τα σύντομα τελομερή είναι μόνο ένα.
Εικόνα 3 Χαρακτηριστικά και
επαγωγείς του φαινότυπου της γήρανσης
DNA βλάβη,
μαζί με οξειδωτική βλάβη στις βάσεις και σπασίματα της διπλής έλικας, οδηγούν
τα κανονικά κύτταρα σε διακόπή της ανάπτυξη με έναν φαινότυπο πολύ παρόμοιο με
αυτόν που προκλείται από κοντά απότομα τελομερή [14-15].
Σε
μερικές περιπτώσεις, οι βλάβες δείχνουν επιταχυνόμενο περιορισμό των τελομερών
[16], αν και δεν είναι σαφές ότι αυτό συμβαίνει πάντα σε κάθε περίπτωση. Επιπλέον,
ανασταλτικοί παράγοντες αποακετυλίωσης της ιστόνης, οι όποιοι αποσυμπιέζουν την
κατασιγασμένη χρωματίνη, προκαλούν έναν γηρασμένο φαινότυπο σε κανονικούς
ανθρώπινους ινοβλάστες μέσα σε μερικούς κυτταρικούς κύκλους [17].
Τα
κανονικά κύτταρα υποβάλλονται επίσης ανεξάρτητη από τα τελομερή κυτταρική γήρανση
σε απάντηση στα ογκογονίδια, όπως στα ενεργοποιημένα RAS ή RAF [18,19], ή
υπερφυσιολογικά μιτογενετικά σήματα, όπως υπερεκφρασμένες MAPK [20] ή E2F1 παράγοντες
μεταγραφής [21].
Ένα
κοινό χαρακτηριστικό γνώρισμα αυτών των μη τελομερικών επαγωγέων της κυτταρικής
γήρανσης είναι η δυνατότητά τους να προκαλούν ή να διευκολύνουν ογκογενετικό
μετασχηματισμό. Δεν είναι εκπληκτικό, κατόπιν, ότι η υπερέκφραση από ορισμένα
γονίδια καταστέλλει τους όγκους επίσης σε κανονικά κύτταρα εξ αιτίας του ότι
υποβάλλονται σε γρήγορη κυτταρική γήρανση. Καταστολείς όγκων που προκαλούν
έντονα κυτταρική γήρανση περιλαμβάνουν τον p16 από κυκλίνη- εξαρτώμενο κινάσης καταστολέα
(CDKI) [22], τον p14/ARF ρυθμιστής του MDM2 [21], και PML (πρωτεϊνη
προμυελοκυτταρικής λευχαιμίας) [23,24], μια πρωτεϊνη που καθορίζει μια υποπηρηνική
περιοχή (το PML πυρηνικό σώμα) και παίζουν έναν μέχρι τώρα ανεπαρκώς κατανοητό
ρόλο στον έλεγχο του πολλαπλασιασμού των κυττάρων και της απόπτωσης [25-26].
Ο
p14/ARF είναι ένας κεντρικός ρυθμιστής του p53 και κρίσιμος συνεισφέρων στη
λειτουργία της καταστολής όγκων του p53 [27].
Ο PML παρουσιάστηκε
πρόσφατα για να ρυθμίσει την μετα - μεταφραστικός τροποποίηση του p53 με την
ακετυλίωση [24], επιπλέον γήρανση προκαλείται και από το RAS [23,24].
Ο φαινότυπος της γήρανσης
Ο φαινότυπος της γήρανσης συνεπάγεται πολύ περισσότερο από μια διακοπή του πολλαπλασιασμού
του κυττάρου. Η σφραγίδα της κυτταρικής γήρανσης είναι, φυσικά, ουσιαστικά αμετάκλητη
διακοπή της κυτταροδιαίρεσης. Η κυτταρική γήρανση διακόπτει την αύξηση με ένα G1 DNA περιεχόμενο,
και δεν μπορεί να υποκινηθεί για να επαναλάβει τον πολλαπλασιασμό από φυσιολογικά
μιτογόνα. Συνδεμένοι με αυτήν την διακοπή της αύξησης είναι δύο πρόσθετοι
φαινότυποι. Πρώτα, μερικά γηρασμένα κύτταρα (παραδείγματος χάριν, ανθρώπινες
ινοβλάστες και λεμφοκύτταρα, αλλά όχι ενδοθηλιακά κύτταρα) γίνονται ανθεκτικά
στον αποπτωτικό θάνατο. Δεύτερο, όλα τα γηρασμένα κύτταρα παρουσιάζουν επιλεγμένες
αλλαγές στη μορφολογία και τον μεταβολισμό, και τις διακυμάνσεις στις
διαφοροποιημένες λειτουργίες. Μερικές με την γήρανση- συνδεμένες αλλαγές που
είναι κοινές σε πολλούς διαφορετικούς τύπους κυττάρων περιλαμβάνουν την κυτταρική
διεύρυνση, αυξανόμενη βιογένεση στα λυσοσώματα, και έκφραση της β- γαλακτοζιδάσης
έχοντας βέλτιστο pH 6 (με την γήρανση- συνδεμένη
β- γαλακτοζιδάση, η SA-Bgal) [28].
Ο φαινότυπος της γήρανσης επίσης συνεπάγεται αλλαγές συγκεκριμένου τύπου κυττάρου. Η γήρανση
στους ινοβλάστες, για παράδειγμα, έχει αναπτύξει έναν συστατικό υποβάθμισης
μήτρας φαινότυπο, έκκριση μεγάλα ποσά από τη μήτρα μεταλλοπρωτεϊνάσες τέτοιες
όπως οι καλλαγενάσες και η στρομελυσίνη. Αυτά τα κύτταρα επίσης εκκρίνουν εμπρηστικές
κυτοκίνες όπως η ιντερλευκίνη-1 και αυξητικοί παράγοντες όπως η χερεγκουλίνη
[29,30].
Δεν είναι
γνωστό πώς το συγκρότημα φαινοτύπου της γήρανσης (διακοπή αύξησης, απόπτωση αντίσταση
και αλλαγμένη λειτουργία κυττάρων) προκαλείται από τα κομμένα τελομερή, DNA βλάβη ή
άλλους παράγοντες που προκαλούν κυτταρική γήρανση. Φυσικά, το p53, όντας
ένας μεταγραφικός παράγοντας και κρίσιμος μεσολαβητής της απάντησης στη γήρανση,
είναι καλός υποψήφιος για την εκτέλεση του πολύπλευρου φαινοτύπου γήρανσης. Εντούτοις,
microarray αναλύσεις του p53- και γονιδίων που προκλούν
την γήρανση έχουν αποκαλύψει ως εδώ λίγη επικάλυψη στα mRNAs που είναι ρυθμισμένα από το p53 και
την αναπαραγωγική γήρανση [29-31].
Επιπλέον,
για μερικά γονίδια (π.χ.. διάμεσος κολλαγενάση), p53 και γήρανση αλλάζουν την
έκφραση σε αντίθετες κατευθύνσεις.
Κυτταρική γήρανση σαν
μηχανισμός καταστολής όγκων
Η κυτταρική γήρανση είναι πιθανά ένας σημαντικός
μηχανισμός για την καταστολή της ανάπτυξης των κακοήθων όγκων in vivo [32,33,34].
Τέσσερις
είναι οι γενικές γραμμές της υποστήριξης στοιχείων αυτής της ιδέας. Πρώτο, οι περισσότεροι
κακοήθεις όγκοι περιέχουν κύτταρα που έχουν υπερνικίσει τα όρια στον πολλαπλασιασμό
που επιβάλλεται από την κυτταρική γήρανση. Δεύτερο, μερικοί προερχόμενοι από ιό
και κυτταρικά ογκογονίδια δρούν πρώτιστα με τη διευκόλυνση των κυττάρων υπερνικόντας
τη γήρανση. Τρίτο, βλαστικές γραμμές αδρανοποιούνται από ορισμένα γονίδια ποντικιών,
συμπερίλαμβανομένου του p53 [35], με αποτελέσματα στα κύτταρα που αντιστέκονται
στη γήρανση προκληθείσα από τον πολλαπλασιασμό και τα ογκογονίδια, και ζώα που
πεθαίνουν πρόωρα λόγω του καρκίνου. Τελικά, τα p53 και pRB, οι συνηθέστερα
χαμένες λειτουργίες καταστολής όγκων στον ανθρώπινο καρκίνο, είναι ουσιαστικά
για την εφαρμογή και διατήρηση της γήρανσης και της διακοπής της αύξησης.
Κυτταρική γήρανση και
ανταγωνιστική πλειοτροπία
Η κυτταρική
γήρανση θεωρείται επίσης ότι συμβάλει στη γήρανση, αν και τα στοιχεία για αυτό είναι
λιγότερο συγκλονιστικά. Κατά συνέπεια, η κυτταρική γήρανση μπορεί να είναι ένα ανταγωνιστικό
πλειοτροπικό γνώρισμα [36,37], π.χ., ένα γνώρισμα που ωφελεί τους νέους οργανισμούς
αλλά είναι βλαβερό στους παλαιούς οργανισμούς. Η αμετάκλητη σύλληψη αύξησης που
συνδέεται με την γήρανση μπορεί να είναι ο επιλεγμένος φαινότυπος αυτός που ωφελεί
το νέο οργανισμό επειδή αποτρέπει τον πολλαπλασιασμό από τα πιθανά κύτταρα
όγκων. Οι λειτουργικές αλλαγές χαρακτηριστικές της γήρανσης των κυττάρων μπορεί
να είναι ένας μη επιλεγμένος φαινότυπος που συμβιβάζει τους παλαιούς οργανισμούς
επειδή η συσσώρευση από δυσλειτουργικά γηρασμένα κύτταρα μπορεί να εξασθενίσει
τη λειτουργία του ιστού και την ακεραιότητά του, και να προωθήσει ακόμη και την
αργή ανάπτυξη - καρκίνου [37].
Η ιδέα ότι
μια ενιαία διαδικασία, ή ακόμα και ένα ενιαίο μοριο, μπορεί να έχουν και τα
δύο, δηλ. και ευεργετικά και επιβλαβή αποτελέσματα στους οργανισμούς είναι
κορεσμένη στη βιολογία, και μπορεί επίσης να ισχύει για το p53. Στην
πράξη η ζημία του ιστού που προκύπτει από τη χημειοθεραπεία μπορέστε να
αποτραπεί με προσωρινή παρεμπόδιση της λειτουργίας του p53 [38], προτείνοντας ότι, κάτω
από μερικές περιστάσεις, ακόμα και το p53 μπορέστε να είναι
επιβλαβές για τον οργανισμό.
[1] http://www.hri.org/E/2000/00-07-17.dir/keimena/greece/greece6.htm
[2] http://bio.demokritos.gr/annual2006/annual06gr.htm
[3] Bartkova et
al., Nature 2006 444, 633-7
[4] Hayflick,
L. & Moorhead, P.S. (1961) The serial
cultivation of human diploid cell strains. Exp. Cell Res. 25,
585–621.
[5] Stanulis-Praeger,
B. (1987) Cellular senescence revisited:
a review. Mech. Aging Dev. 38, 1–48.
[6] Campisi,
J., Dimri, G.P. & Hara, E. (1996) Control
of replicative senescence. In Handbook
of the Biology of Aging ( Schneider, E. & Rowe, J., eds), pp.
121–149. Academic Press,
[7] McClintock,
B. (1941) The stability of broken ends of
chromosomes in Zea mays. Genetics
26, 234–282.
[8] Olovnikov,
A.M. (1973) A theory of marginotomy. J.
Theor. Biol. 41, 181–190.
[9] Levy, M.Z.,
Allsopp, R.C., Futcher, A.B., Greider, C.W. & Harley, C.B. (1992) Telomere end-replication problem and cell
aging. J. Mol. Biol. 225, 951–960.
[10] Harley,
C.B., Futcher, A.B. & Greider, C.W. (1990) Telomeres shorten during aging of human fibroblasts. Nature 345,
458–460.
[11] Harley,
C.B. (1997) Human ageing and telomeres.
Ciba Found. Symp. 211, 129–139.
[12] Bodnar,
A.G., Ouellette, M., Frolkis, M., Holt, S.E., Chiu, C.P., Morin, G.B., Harley,
C.B., Shay, J.W., Lichtsteiner, S. & Wright, W.E. (1998) Extension of life span by introduction of
telomerase into normal human cells. Science
279, 349–352.
[13] Vaziri, H.
& Benchimol, S. (1998) Reconstitution
of telomerase activity in normal human cells leads to elongation of telomeres
and extended replicative life span. Curr. Biol. 8, 279–282.
[14] DiLeonardo,
A., Linke, S.P., Clarkin, K. & Wahl, G.M. (1994) DNA damage triggers a prolonged p53-dependent G1 arrest and long-term
induction of Cip1 in normal human fibroblasts. Genes Dev. 8,
2540–2551.
[15] Robles,
S.J. & Adami, G.R. (1998) Agents that
cause DNA double strand breaks lead to p16INK4a enrichment and the premature
senescence of normal fibroblasts. Oncogene 16, 1113–1123.
[16] von
Zglinicki, T., Saretzki, G.D., Döcke, W. & Lotze, C. (1995) Mild hyperoxia shortens telomeres and
inhibits proliferation of fibroblasts: a model for senescence? Exp. Cell Res. 220,
186–193.
[17] Ogryzko,
V.V., Hirai, T.H., Russanova, V.R., Barbie, D.A. & Howard, B.H. (1996) Human fibroblast commitment to a
senescence-like state in response to histone deacetylase inhibitors is cell
cycle dependent. Mol. Cell. Biol. 16, 5210–5218.
[18] Serrano,
M., Lin, A.W.,
[19] Zhu, J.,
Woods, D., McMahon, M. & Bishop, J.M. (1998) Senescence of human fibroblasts induced by oncogenic raf. Genes
Dev. 12, 2997–3007.
[20] Lin, A.W.,
Barradas, M., Stone, J.C., van Aelst, L., Serrano, M. & Lowe, S.W. (1998) Premature senescence involving p53 and p16
is activated in response to constitutive MEK/MAPK mitogenic signaling. Genes
Dev. 12, 3008–3019.
[21] Dimri,
G.P., Itahana, K., Acosta, M. & Campisi, J. (2000) Regulation of a senescence checkpoint response by the E2F1
transcription factor and p14/ARF tumor suppressor. Mol. Cell. Biol. 20,
273–285.
[22] McConnell,
B.B., Starborg, M., Brookes, S. & Peters, G. (1998) Inhibitors of cyclin- dependent kinases induce features of replicative
senescence in early passage human diploid fibroblasts. Curr. Biol. 8, 351–354.
[23] Ferbeyre,
G., de Stanchina, E., Querido, E., Baptiste, N., Prives, C. & Lowe, S.W.
(2000) PML is induced by oncogenic ras
and promotes premature senescence. Genes Dev. 14, 2015–2027.
[24] Pearson,
M., Carbone, R., Sebastiani, C., Cioce, M., Fagioli, M., Saito, S.,
Higashimoto, Y., Appella, E., Minucci, S., Pandolfi, P.P. & Pelicci, P.G.
(2000) PML regulates p53 acetylation and
premature senescence induced by oncogenic RAS. Nature 406, 207–210.
[25] Liu, J.H.,
Mu, Z.M. & Chang, K.S. (1995) PML
suppresses oncogenic transformation of NIH/3T3 cells by activated neu. J.
Exp. Med. 181, 1965–1973.
[26] Wang, Z., Ruggero,
D., Ronchetti, S., Zhong, M., Gaboli, M., Rivi, R. & Pandolfi, P. (1998) PML is essential for multiple apoptotic pathways.
Nat. Genet. 20, 266–272.
[27] Sherr, C.J.
(1998) Tumor surveillance via the ARF-p53
pathway. Genes Dev. 12, 2984–2891.
[28] Dimri,
G.P., Lee, X., Basile, G., Acosta, M., Scott, G., Roskelley,C., Medrano, E.E.,
Linskens, M., Rubelj,
[29]
[30] Linskens,
M.H.K., Feng, J., Andrews, W.H., Enlow, B.E., Saati, S.M., Tonkin, L.A., Funk,
W.D. & Villeponteau, B. (1995) Cataloging
altered gene expression in young and senescent cells using enhanced
differential display. Nucleic Acids Res. 23, 3244–3251.
[31] Komarova,
E.A., Diatchenko, L., Rokhlin, O.W., Hill, J.E., Wang, Z.J., Krivokrysenko,
V.I., Feinstein, E. & Gudkov, A.V. (1998) Stress-induced secretion of growth inhibitors: a novel tumor suppressor
function of p53. Oncogene 17, 1089–1096.
[32] Campisi,
J. (1999) Replicative senescence and
immortalization. In The Molecular
Basis of Cell Cycle and Growth Control ( Stein, G., Baserga, R.,
Giordano, A. & Denhardt, D., eds), pp. 348–373.
[33] Sager, R.
(1991) Senescence as a mode of tumor
suppression. Environ. Health Persp. 93, 59–62.
[34] Yeager,
T.R., DeVries, S., Jarrard, D.F., Kao, C., Nakada, S.Y., Moon, T.D.,
Bruskewitz, R., Stadler, W.M., Meisner, L.F., Golchrist, K.W., Newton, M.A.,
Waldman, F.M. & Reznikoff, C. (1998) Overcoming
cellular senescence in human cancer pathogenesis. Genes Dev. 12,
163–174.
[35] Donehower,
L.A., Harvey, M., Slagke, B.L., McArthur, M.J., Montgomery, C.A., Butel, J.S.
& Bradley, A. (1992) Mice deficient
for p53 are developmentally normal but susceptible to spontaneous tumors. Nature
356, 215–221.
[36] Campisi,
J. (1996) Replicative senescence: an old
lives tale? Cell 84, 497–500.
[37] Campisi,
J. (1997) Aging and cancer: the
double-edged sword of replicative senescence. J. Am. Geriatr. Soc. 45,
1–6.
[38] Komarov,
P.G., Komarova, E.A., Kondratov, R.V., Christov-Tselkov, K., Coon, J.S.,
Chernov, M.V. & Gudkov, A.V.A. (1999) Chemical
inhibitor of p53 that protects mice from the side effects of cancer therapy.
Science 285, 1733–1737.
Σε αντίθεση με τους μονοκύτταρους οργανισμούς, οι οποίοι
ανταγωνίζονται για την επιβίωσή τους, τα κύτταρα ενός πολυκύτταρου οργανισμού
πρέπει να συνεργάζονται αρμονικά το ένα με το άλλο. Κάθε μετάλλαξη που προκαλεί
την εγωιστική συμπεριφορά ενός κυττάρου μπορεί να προκαλέσει την καταστροφή
ολόκληρου του πληθυσμού. Η μετάλλαξη, ο συναγωνισμός και η φυσική επιλογή που
λειτουργούν στους πληθυσμούς των σωματικών κυττάρων, είναι τα βασικά συστατικά
του καρκίνου. Καρκίνος είναι η ασθένεια κατά την οποίαν τα μεταλλαγμένα κύτταρα
αρχίζουν να “καλοπερνούν” σε βάρος των γειτόνων τους, αλλά στο τέλος
καταστρέφουν ολόκληρη την κυτταρική κοινωνία και πεθαίνουν μαζί της.[1]
Πολύ συχνά, οι έλεγχοι που ρυθμίζουν τις κυτταρικές διαιρέσεις
καταστρέφονται και έτσι ένα κύτταρο αρχίζει να αυξάνεται και να διαιρείται, ενώ
ο ιστός δεν έχει ανάγκη για περισσότερα κύτταρα του συγκεκριμένου αυτού τύπου. Όταν
οι απόγονοι του κυττάρου αυτού κληρονομήσουν την τάση να μην υπακούουν στις
εντολές ρύθμισης της κυτταρικής διαίρεσης, τότε τα κύτταρα πολλαπλασιάζονται
συνεχώς. Η μάζα των ανεπιθύμητων αυτών κυττάρων ονομάζεται όγκος.
Στις τεχνικά προηγμένες χώρες, το 15-20% των θανάτων οφείλεται
στον καρκίνο. Τα καταστροφικά αποτελέσματα που παρατηρούνται από την αύξηση των
όγκων προέρχονται:
α. από την παρεμπόδιση της λειτουργίας άλλων κυττάρων, ιστών,
οργάνων, ή/και
β. από την απώλεια βασικών κυτταρικών ιδιοτήτων λόγω μετατροπής
των κυττάρων.
Οι στερεοί όγκοι καταστρέφουν τους περιβάλλοντες ιστούς και
παρεμποδίζουν την κανονική ροή του αίματος και τη λειτουργία των νευρικών
κυττάρων. Κατά τη μετάσταση, λόγω της διαταραχής της συνέχειας των ιστών,
μπορούν να προκαλέσουν αιμορραγία και μολύνσεις. Σε προχωρημένες καρκινικές
καταστάσεις ο πόνος μπορεί να είναι πολύ έντονος. Όταν η συνολική μάζα του
καρκινικού ιστού αυξηθεί αρκετά, οι απαιτήσεις των αυξανόμενων και διαιρούμενων
καρκινικών κυττάρων σε θρεπτικά συστατικά είναι πολύ μεγάλες και έτσι στερούν
από τα κανονικά κύτταρα βασικά λειτουργικά στοιχεία, προκαλώντας μυϊκή
αδυναμία, κόπωση, απώλεια βάρους και γενική παρεμπόδιση των σωματικών
λειτουργιών.[1]
Στα καρκινικά κύτταρα, η ρύθμιση του κυτταρικού πολλαπλασιασμού
είναι ελαττωματική, και τα κύτταρα αυτά πολλαπλασιάζονται in vivo (Εικόνα 1) σε λανθασμένο χρόνο και σε
λανθασμένη θέση. Τα καρκινικά κύτταρα συνεχίζουν να διαιρούνται κάτω από
συνθήκες στις οποίες τα κανονικά κύτταρα δεν θα μπορούσαν να διαιρεθούν. Έτσι,
πρώτο και κυριότερο χαρακτηριστικό γνώρισμα των καρκινικών κυττάρων είναι οι μη
ελεγχόμενες κυτταρικές διαιρέσεις. Ο κυτταρικός κύκλος των καρκινικών κυττάρων
είναι πολύ πιο γρήγορος απ’ ότι στα αντίστοιχα κανονικά κύτταρα. Τα καρκινικά
κύτταρα δεν διαφοροποιούνται πλήρως και δεν αναπτύσσουν διακυτταρικούς
συνδέσμους με τα γειτονικά τους κύτταρα. Στα καρκινικά κύτταρα παρατηρούνται
επίσης διαταραχές του κυτταρικού σκελετού, υψηλός μεταβολικός ρυθμός, μεγάλες
συγκεντρώσεις Na+, K+ και Ca2+, καθώς επίσης και υψηλό pH. Συχνά
παρατηρούνται χρωμοσωμικές ανωμαλίες ενώ ο πυρήνας παρουσιάζει διαφορετικό
μέγεθος και σχήμα σε σχέση με τα κανονικά κύτταρα.[2]
Ως νεόπλασμα χαρακτηρίζεται μια συνεχώς αυξανόμενη μάζα ανώμαλων κυττάρων. Για όσο χρονικό διάστημα τα νεοπλασματικά κύτταρα παραμένουν συγκεντρωμένα ως μια απλή μάζα, τότε ο όγκος χαρακτηρίζεται ως καλοήθης όγκος. Ένας όγκος θεωρείται ως καρκίνος, μόνον όταν είναι κακοήθης όγκος, δηλ. όταν τα κύτταρά του έχουν την ικανότητα να κάνουν μετάσταση σε άλλους ιστούς. Οι διάφοροι τύποι καρκίνου ταξινομούνται ανάλογα με τον ιστό και τον κυτταρικό τύπο από τον οποίον προέρχονται. Ο καρκίνος που προέρχεται από τα επιθηλιακά κύτταρα ονομάζεται καρκίνωμα, ενώ αυτός που προέρχεται από το συνδετικό ιστό ή τα μυϊκά κύτταρα χαρακτηρίζεται ως σάρκωμα. Ο καρκίνος που προκύπτει από τα αιμοποιητικά κύτταρα ονομάζεται λευχαιμία. Κάθε καρκίνος έχει χαρακτηριστικά γνωρίσματα που αντανακλούν την προέλευσή του. Καρκίνοι που προέρχονται από διαφορετικούς κυτταρικούς τύπους είναι συνήθως διαφορετικές ασθένειες. Όλοι οι κυτταρικοί τύποι μπορούν να μετατραπούν σε καρκινικά κύτταρα. Τα καρκινικά κύτταρα έχουν συνήθως τις ιδιότητες των μη ώριμων κυτταρικών τύπων από τους οποίους προέρχονται.[2]
Εικόνα
1 [2]
|
1. Δομή |
|
|
Κανονικά
κύτταρα |
Κύτταρα
του καρκίνου |
|
Το DNA
στα γονίδια και τα χρωμοσώματα πηγαίνουν για την δουλειά τους με έναν
κανονικό τρόπο. |
Τα κύτταρα
του καρκίνου αναπτύσσουν μία διαφορετική δομή DNA ή γονιδίου ή αποκτούν μη φυσιολογικό αριθμό
χρωμοσωμάτων. |
|
Τα
κύτταρα διαιρούνται με έναν τακτικό τρόπο για να παραχθούν περισσότερα
κύτταρα μόνο όταν τα χρειάζεται το σώμα. |
Τα
κύτταρα συνεχίζουν να δημιουργούνται χωρίς έλεγχο ή διαταγή. Ενώ δεν
απαιτείται, μια μάζα του ιστού διαμορφώνεται, η οποία καλείται όγκος |
|
2. Ενέργεια |
|
|
Κανονικά
κύτταρα |
Κύτταρα
του καρκίνου |
|
Τα κύτταρα
παράγουν 70%
από την ενέργειά
τους από ένα σύστημα αποκαλούμενος κύκλος Krebs. |
Τα
κύτταρα έχουν έναν ελαττωματικό "κύκλο Krebs" και αντλούν ελάχιστη
ή καθόλου ενέργεια από αυτόν |
|
Τα
κύτταρα αντλούν μόνο 20% της ενέργειάς τους από ένα σύστημα αποκαλούμενο
"γλυκόλυση." |
Τα
κύτταρα του καρκίνου αντλούν σχεδόν όλη την ενέργειά τους από τη γλυκόλυση. |
|
Τα
κύτταρα παράγουν το μεγαλύτερο μέρος της ενέργειάς τους με τη χρήση του
οξυγόνου. |
Τα
κύτταρα παράγουν την μεγαλύτερη μέρος της ενέργειάς τους ελλείψει του
οξυγόνου. |
|
3. Αγγεία αίματος |
|
|
Κανονικά
κύτταρα |
Κύτταρα
του καρκίνου |
|
Τα
κύτταρα έχουν ένα ενσωματωμένο σύστημα αγγείων αίματος. |
Τα
κύτταρα δεν έχουν ένα ενσωματωμένο σύστημα αγγείων αίματος. Απαιτούν περισσότερα από ορισμένα
αμινοξέα για να χτίσουν ένα. |
|
4. Αυξητικοί
παράγοντες |
|
|
Κανονικά
κύτταρα |
Κύτταρα
του καρκίνου |
|
Ενώ είναι
παρόμοιοι με τα κύτταρα του καρκίνου, το ποσό τους είναι περισσότερο σε ισορροπία σε προϊόντα με
ένα κανονικότερο επίπεδο δραστηριότητας. |
Αυτά τα
κύτταρα έχουν over produced,
απαιτούν περισσότερες χημικές ουσίες (τρόφιμα) και είναι over active |
|
5. Λειτουργίες |
|
|
Κανονικά
κύτταρα |
Κύτταρα
του καρκίνου |
|
Τα
ένζυμα και οι ορμόνες πηγαίνουν για την δουλειά τους κατά ισορροπημένο τρόπο
κανονικό. |
Τα
ένζυμα και οι ορμόνες είναι το καθένα over active
ή under
active. |
|
Οι όγκοι είναι διαφορετικοί |
|
|
Καλοήθης Οι
καλοήθεις όγκοι δεν είναι καρκινώδεις. Δεν εισβάλλουν στους κοντινούς ιστούς ούτε δεν διαδίδονται
σε άλλα μέρη του σώματος.
Μπορούν να αφαιρεθούν
και δεν είναι μια απειλή για τη ζωή. |
Κακοήθης Οι
κακοήθεις όγκοι είναι καρκινώδεις. Μπορούν να εισβάλουν και να βλάψουν στους κοντινούς ιστούς
και τα όργανα, και μπορούν να φτάσουν μακριά και να εισέλθουν στην κυκλοφορία
του αίματος για να διαμορφώσουν νέους όγκους σε άλλα μέρη του σώματος. Η διάδοση του καρκίνου καλείται
μετάσταση. |
[3]
Τα χαρακτηριστικά των κανονικών
κυττάρων
Τα κανονικά σωματικά κύτταρα έχουν διάφορα σημαντικά
χαρακτηριστικά. Μπορούν να:
·
Αναπαράγονται ακριβώς
·
Σταματούν να αναπαράγονται στο σωστό χρόνο
·
Μένουν μαζί στη σωστή θέση
·
Να αυτοαναδομούνται όταν
παθαίνουν βλάβες
·
Γίνονται εξειδικευμένα ή "ώριμα" [4]
Πώς τα καρκινικά κύτταρα
είναι διαφορετικά
Τα καρκινικά κύτταρα είναι διαφορετικά από τα κανονικά κύτταρα
κατά διάφορους τρόπους. Αυτά είναι μερικά χαρακτηριστικά γνωρίσματα των
καρκινικών κυττάρων
·
Οδηγούνται σε αναπαραγωγή
·
Δεν υπακούνε στα σήματα από άλλα γειτονικά κύτταρα
·
Δεν μένουν ενωμένα μαζί
·
Δεν γίνονται εξειδικευμένα, αλλά μένουν ανώριμα
·
Δεν πεθαίνουν εάν κινούνται σε ένα άλλο μέρος
του σώματος [4]
Τα καρκινικά κύτταρα δεν
σταματούν να αναπαράγονται
Αντίθετα από τα κανονικά κύτταρα, τα καρκινικά κύτταρα δεν σταματούν να
αναπαράγονται αφότου έχουν διπλασιαστεί 50 ή 60 φορές. Αυτό σημαίνει ότι ένα καρκινικό
κύτταρο θα συνεχίσει τον διπλασιασμό. Έτσι ένα κύτταρο γίνεται 2, μετά 4, μετά 8, μετά 16…..
Εικόνα 2 [4]
Τα καρκινικά
κύτταρα είναι σε θέση να σταματηθούν από μόνα τους την αυτοαναδόμηση. Ή μπορούν μόνο να αυτοαναδομούνται πιό αργά κατά την
αναπαραγωγή, έτσι
ώστε αριθμοί τους συνέχεια να αυξάνονται. Τελικά ένας όγκος που διαμορφώνεται αποτελείται από
δισεκατομμύρια από τα αντίγραφα του αρχικού καρκινώδους κυττάρου. Οι επιστήμονες περιγράφουν
τα κύτταρα του καρκίνου σαν πραγματικά 'αθάνατα'.[4]
Τα κύτταρα του καρκίνου δεν υπακούνε στα σήματα από άλλα γειτονικά
κύτταρα
Κάτι
στα κύτταρα του καρκίνου αγνοεί το φυσιολογικό σηματοδοτικό σύστημα. Αυτό μπορεί να συμβαίνει επειδή
τα γονίδια που λένε στο κύτταρο να αναπαραχθεί μένουν ανοικτά και σε λειτουργία.
Ή επειδή τα γονίδια
που λένε κανονικά στα κύτταρα να σταματήσουν να αναπαράγονται έχουν
καταστραφεί ή χαθεί. Έτσι
το κύτταρο του καρκίνου μένει σε διπλασιασμό, άσχετα από τη βλαβη των άλλων κυττάρων στο μέρος του σώματος όπου ο
καρκίνος έχει αναπτυχθεί. [4]
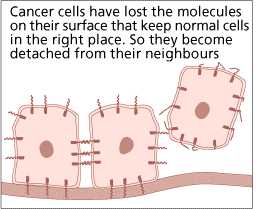
Τα κύτταρα του καρκίνου δεν κολλούν μαζί
Τα
κύτταρα του καρκίνου μπορούν να χάσουν τα μόρια στην επιφάνειά τους που κρατούν
τα κανονικά κύτταρα στη σωστή θέση. Έτσι μπορούν να μένουν αποσυνδεμένα από
τους γείτονές τους.
Εικόνα 3 [4]
Αυτό
εξηγεί εν μέρει πώς τα κύτταρα του καρκίνου διαδίδονται σε άλλα μέρη του
σώματος. [4]
Τα
δεσμοσώματα πολύ συχνά εξαφανίζονται κατά τη μετατροπή των κανονικών κυττάρων
σε καρκινικά. Αυτή η αλλαγή συμβάλλει στη μετάσταση των καρκινικών κυττάρων,
αφού τα κύτταρα δεν συγκρατούνται σταθερά στον ιστό. [5]
Τα κύτταρα του καρκίνου δεν εξειδικεύονται
Αντίθετα
από τα κανονικά κύτταρα, τα κύτταρα του καρκίνου δεν οδηγούνται σε ωρίμανση αμέσως μόλις
σχηματιστούν. Στην
πραγματικότητα, τα κύτταρα σε έναν καρκίνο μπορούν να γίνουν ωριμότερα με το
πέρασμα του χρόνου. Με όλη την αναπαραγωγή, δεν είναι εκπληκτικό ότι περισσότερες των γενετικών
πληροφοριών στο κύτταρο μπορούν να χαθούν. Έτσι τα κύτταρα γίνονται όλο και περισσότερο πρωτόγονα και τείνουν να
αναπαραγάγονται γρηγορότερα και ακόμα πιό τυχαία. [4]
Διαφοροποίηση
Μπορείτε
να ακούσετε τη συζήτηση των γιατρών σας σχετικά με την διαφοροποίηση από τον καρκίνο σας.
Αυτό σημαίνει πόσο
καλά αναπτύσσεται ή ωριμάζει το κύτταρο κοιτάζοντας κάτω από ένα μικροσκόπιο.
Το περισσότερα κύτταρα
του καρκίνου μοιάζουν με ένα κανονικό κύτταρο, τα περισσότερα θα
συμπεριφερθούν όπως σε μια από τις παρακάτω περιπτώσεις:
Ο κανονικότερος
ένα κύτταρο καρκίνου μοιάζει, στο χαμηλότερή του διαφοροποίηση
Ο πιό ανώμαλος
ή λιγότερο καλά αναπτυγμένος ένα κύτταρο καρκίνου είναι, στην υψηλότερή του διαφοροποίηση.
Ο γιατρός σας μπορεί να επικαλεστεί αυτήν την
"διαφοροποίηση". Τα κύτταρα μπορούν να είναι καλά διαφοροποιημένα, συγκρατημένα
διαφοροποιημένα, ή κακώς διαφοροποιημένα. Αυτό είναι το ίδιο με χαμηλό, μέσο ή
υψηλό grade. Άλλοι
γιατροί μπορούν να μιλήσουν για διαφοροποιήσεις 1, 2, ή 3, όπου διαφοροποίηση 1
είναι χαμηλή διαφοροποίηση. Αν και υπάρχουν πολλοί διαφορετικοί τρόποι να
μηλήσουμε για αυτό, όλοι περιγράφουν το ίδιο πράγμα. Ένας χαμηλής διαφοροποίησης
καρκίνος είναι πιθανό να έχει λιγότερο επιθετική συμπεριφορά από έναν με υψηλή διαφοροποίηση.
Οι γιατροί δεν μπορούν να είναι σίγουροι πώς τα κύτταρα θα συμπεριφερθούν. Αλλά
η διαφοροποίηση είναι ένας χρήσιμος δείκτης. Διαφοροποίηση είναι ένας από τους παράγοντες
που οι γιατροί χρησιμοποιούν για να αποφασίσουν την επεξεργασία σε μερικούς
τύπους καρκίνων. [4]
Συνοψίζοντας :α. Τα φυσιολογικά κύτταρα ξεκινούν και
ολοκληρώνουν τη διαδικασία πολλαπλασιασμού τους, σύμφωνα με τα σήματα που
λαμβάνουν από το γενετικό τους υλικό. Στα καρκινικά κύτταρα, λόγω διαταραχών
στο γενετικό υλικό, είτε τα σήματα αυτά δεν υπάρχουν, είτε το κύτταρο δεν υπακούει
σε αυτά, με αποτέλεσμα να πολλαπλασιάζονται συνεχώς.
β. Τα καρκινικά κύτταρα δεν έχουν στην επιφάνεια τους τα μόρια
που είναι υπεύθυνα να τα συγκρατούν σε ομάδες. Έτσι, τα κύτταρα ξεφεύγουν και
εξαπλώνονται σε παρακείμενες, αλλά και σε πιο απομακρυσμένες περιοχές
γ. Τα καρκινικά κύτταρα δεν ωριμάζουν. Όσο γρηγορότερα
αναπαράγονται, τόσο λιγότερο ωριμάζουν και όσο πιο πρωτόγονα είναι, τόσο
ταχύτερα αναπαράγονται.
Ανάλογα με το πόσο
μοιάζουν ή διαφέρουν τα καρκινικά κύτταρα από τα φυσιολογικά (υψηλή, μέση ή
χαμηλή διαφοροποίηση-grade), καθορίζεται και η επιθετικότητα του καρκίνου. [6]
Πολλαπλασιάζονται με ταχύτατους ρυθμούς, χωρίς να ελέγχονται από
τους ρυθμιστικούς μηχανισμούς του οργανισμού και γίνονται ουσιαστικά αθάνατα,
αφού δεν υπακούν στις αυστηρά καθορισμένες βιολογικές διαδικασίες, που οδηγούν
κάθε κύτταρο σε φυσιολογικό θάνατο. Οι περισσότεροι τύποι καρκίνου παίρνουν το
όνομα τους από το είδος του ιστού ή του οργάνου στο οποίο αρχικά εντοπίζονται.
Η περιοχή αρχικής εμφάνισης του όγκου, ιστός ή όργανο, ονομάζεται πρωτοπαθής
εστία και ο εντοπισμός της διαδραματίζει καθοριστικό ρόλο στο σχεδιασμό της
θεραπείας και την αποτελεσματικότερη αντιμετώπιση της νόσου. Τα καρκινικά
κύτταρα συχνά έχουν τη δυνατότητα να διεισδύουν και να βλάπτουν γειτονικούς
ιστούς και όργανα, όπου και ονομάζεται διηθητικός καρκίνος. Επίσης μπορούν να
μετακινηθούν από το σημείο που εντοπίζεται ο κακοήθης όγκος και να εισχωρήσουν
στην κυκλοφορία του αίματος ή το λεμφικό σύστημα. Με αυτόν τον τρόπο ενδεχόμενα
ο καρκίνος μετακινείται και επεκτείνεται σε διάφορα σημεία του σώματος. Ο νέος
όγκος έχει τον ίδιο τύπο ανώμαλων κυττάρων και το ίδιο όνομα με τον αρχικό
καρκίνο (π.χ. εάν κύτταρα καρκίνου του πνεύμονα επεκτείνονται με μεταστάσεις
στα οστά, τα κύτταρα που ανευρίσκονται στα οστά είναι καρκινικά κύτταρα
πνεύμονα. Ο συγκεκριμένος τύπος, ονομάζεται μεταστατικός καρκίνος πνεύμονα και
όχι καρκίνος των οστών). Επίσης, μερικοί όγκοι παίρνουν το όνομα του επιστήμονα
που τους ανακάλυψε (π.χ. Hodgkin, Brenner). Οι όγκοι των οστών, των πνευμόνων
και του εγκεφάλου, καθώς και οι περισσότερες μορφές καρκίνου, σχηματίζουν συμπαγείς
και ευδιάκριτους όγκους, γεγονός που δεν παρατηρείται στις λευχαιμίες, τα
λεμφώματα και το πολλαπλό μυέλωμα. Στις τελευταίες κατηγορίες, τα κύτταρα
διαχέονται στην κυκλοφορία του αίματος ή το λεμφικό σύστημα. Τα κύτταρα των
μη-συμπαγών όγκων, όμως, δεν θα πρέπει να συγχέονται με τυχόν μεταστατικά
κύτταρα που κυκλοφορούν στο αίμα, τα οποία προέρχονται από συμπαγείς όγκους και
μεταφέρονται μέσω του αίματος σε απομακρυσμένα σημεία του σώματος. Ακόμη η
παρουσία περισσότερων από μία μορφών καρκίνου στο ίδιο όργανο ή ιστό δεν είναι
σπάνιο φαινόμενο και επίσης, μερικοί καρκίνοι αναπτύσσονται πολύ αργά και δεν
προκαλούν προβλήματα στην υγεία του ασθενή για μεγάλο χρονικό διάστημα, ενώ
άλλοι αναπτύσσονται ταχύτατα. Ο οργανισμός δεν μπορεί να αντιμετωπίσει εύκολα
τα καρκινικά κύτταρα, επειδή μοιάζουν με τα φυσιολογικά, δεν ενεργοποιούν το
ανοσοποιητικό σύστημα και έτσι συνεχίζεται ανεμπόδιστα η εισβολή και η εξάπλωση
τους. Αν ένας κακοήθης όγκος δεν εντοπιστεί και δεν αντιμετωπιστεί έγκαιρα,
τελικά μπορεί να επηρεάσει τις φυσιολογικές λειτουργίες του σώματος (π.χ.
αναπνοή, πέψη, καρδιακή/εγκεφαλική λειτουργία) και να οδηγήσει σε ανεπανόρθωτες
βλάβες στην υγεία. [7]
Ας ξεκινήσουμε περιγράφοντας εν συντομία τα δύο κύρια χαρακτηριστικά στα οποία βασίζεται η ιστολογική διάγνωση του καρκίνου. Αυτά είναι η κυτταρική ατυπία και η διαταραχή της αρχιτεκτονικής δομής του ιστού. Η τελευταία οφείλεται στον ανεξέλεγκτο άναρχο πολλαπλασιασμό των καρκινικών κυττάρων και στην ασύμμετρη ανάπτυξη ινώδους συνδετικού ιστού, ο οποίος πιέζει και παραμορφώνει τις αθροίσεις των νεοπλασματικών κυττάρων.[8]
Εικόνα 4 [8]
Η εικόνα 4 δείχνει αριστερά ένα φυσιολογικό κύτταρο και δεξιά ένα καρκινικό. Τα δύο κύτταρα διαφέρουν σημαντικά, κυρίως ως προς τον πυρήνα τους. Στο καρκινικό κύτταρο ο πυρήνας είναι μεγαλύτερος με ανώμαλο περίγραμμα, παχειά πυρηνική μεμβράνη, αδρά βωλία χρωματίνης και έντονο πυρήνιο.[8]
Εικόνα 5 [8]
Η εικόνα 5 δείχνει αριστερά ένα φυσιολογικό αδένιο και δεξιά μία αδενοειδή άθροιση καρκινικών κυττάρων. Το φυσιολογικό αδένιο είναι ολοστρόγγυλο, συμμετρικό με ένα στοίχο ομοιόμορφων αδενικών κυττάρων. Στην εξωτερική πλευρά του αδενίου, σε επαφή με τη βασική μεμβράνη, διακρίνονται τα μυοεπιθηλιακά κύτταρα. Δεξιά ο αδενικός σχηματισμός είναι παραμορφωμένος και επενδύεται από ανομοιόμορφα κύτταρα που διατίθενται σε έναν ή περισσότερους στοίχους. Σημαντικό είναι ότι στον καρκινικό σχηματισμό δεν διακρίνονται μυοεπιθηλιακά κύτταρα ούτε βασική μεμβράνη. Με βάση τις δύο αυτές εικόνες ο καθένας θα μπορούσε να πει ότι η διαφορά του καρκίνου από το φυσιολογικό είναι "οφθαλμοφανής". Oμως, δυστυχώς ή ευτυχώς, η κατάσταση είναι πολύ πιο πολύπλοκη. Υπάρχουν καλοήθεις καταστάσεις που έχουν μεγάλα άτυπα κύτταρα ή προκαλούν μεγάλη παραμόρφωση της ιστολογικής υφής που ο άπειρος παθολογοανατόμος θα τις ονόμαζε καρκινικές χωρίς δισταγμό. Από την άλλη πλευρά, υπάρχουν γνήσιοι καρκίνοι με πολύ μικρή ατυπία που δύσκολα αναγνωρίζονται. Κανένα λοιπόν από τα δύο κύρια ιστολογικά κριτήρια του καρκίνου δεν είναι απόλυτο, ούτε η κυτταρική ατυπία, ούτε η διαταραγμένη αρχιτεκτονική δομή. Η κατάσταση περιπλέκεται από την ύπαρξη πολλών ενδιάμεσων μορφών οι οποίες ονομάζονται υπερπλαστικές, προκαρκινωματώδεις ή γκρίζες ζώνες. Ανάμεσα δηλαδή στην τυπική εικόνα ενός καρκινικού και ενός φυσιολογικού κυττάρου υπάρχουν πάρα πολλές ενδιάμεσες μορφές.
Εικόνα 6 [8]
Οι
ενδιάμεσες μορφές προς τα αριστερά μοιάζουν πολύ περισσότερο με το φυσιολογικό
κύτταρο παρά με το καρκινικό (εικόνα 6 ). Οι ενδιάμεσες μορφές προς τα δεξιά
μοιάζουν πολύ περισσότερο με το καρκινικό κύτταρο. Τι γίνεται όμως με τις
ενδιάμεσες μορφές που είναι ακριβώς στη μέση και μοιάζουν εξ' ίσου με το φυσιολογικό
και το καρκινικό κύτταρο;
Τα ίδια
ακριβώς μπορούν να λεχθούν για τη διαταραχή της αρχιτεκτονικής δομής η οποία
μπορεί να είναι από μηδαμινή μέχρι έντονη.Πολλά έχουν γίνει μέχρι σήμερα για τη
διαλεύκανση των γκρίζων ζωνών. Πολλοί προσπάθησαν να οριοθετήσουν τη μη
νεοπλασματική ή αντιρροπιστική υπερπλασία, από την άτυπη υπερπλασία που μπορεί
να αποτελεί αντίδραση σε φλεγμονώδη π.χ. παράγοντα, ή νεοπλασματική και τέλος
από την σαφώς νεοπλασματική ατυπία. Παρά τις φιλότιμες προσπάθειες στην πράξη
αποδείχθηκε ότι οι οριακές γραμμές ανάμεσα στην υπερπλασία, την άτυπη
υπερπλασία και τον καρκίνο είναι αυθαίρετες και σε τελική ανάλυση
υποκειμενικές. Μια βλάβη που ένας παθολογοανατόμος τη θεωρεί καρκίνο, άλλος
μπορεί χωρίς δισταγμό να τη θεωρήσει απλή υπερπλασία. Τι κάνει συνήθως ένας παθολογοανατόμος
όταν βρίσκεται αντιμέτωπος με μια γκρίζα ζώνη και πιέζεται από τον κλινικό να
δώσει μία οριστική απάντηση, αν πρόκειται δηλαδή για καρκίνο ή όχι; Το πρώτο
που έχει να κάνει είναι να αναζητήσει άλλα στοιχεία που να συνηγορούν ή όχι
προς την κατεύθυνση του καρκίνου. Αυτά είναι η ηλικία του αρρώστου, η εντόπιση,
η συχνότητα της πιθανολογούμενης νεοπλασίας, τα απεικονιστικά και τα λοιπά εργαστηριακά
ευρήματα. Η ανοσοϊστοχημεία η οποία προσφέρει αποφασιστική βοήθεια στη
διαφορική διάγνωση μιας μορφής νεοπλασίας από την άλλη, (π.χ. μεταξύ καρκίνου,
μελανώματος, λεμφώματος, λειομυοσαρκώματος), στον τομέα της διάκρισης της
υπερπλασίας από τον καρκίνο προσφέρει πολύ λίγα. Συνήθως χρησιμοποιείται η
χρώση για μυοεπιθηλιακά κύτταρα και τη βασική μεμβράνη, ο δείκτης
πολλαπλασιασμού Κi67 και το p53. Oμως ο κλινικός γιατρός που έχει την τελική
ευθύνη για τον άρρωστο, τι πρέπει να κάνει στις περιπτώσεις αυτές; Θα λέγαμε
ότι αρκεί να γνωρίζει ότι η παθολογοανατομική διάγνωση δεν είναι πάντοτε απλή
και ότι οι γκρίζες ζώνες αποτελούν αδιαμφισβήτητο γεγονός. Eχοντας αυτά κατά
νου ο κλινικός δεν πιέζει τον παθολογοανατόμο για σαφή διάγνωση, όταν αυτός
αδυνατεί να το πράξει. Oταν πιέζεται ασφυκτικά ο παθολογοανατόμος μπορεί να
δώσει μία διάγνωση που δεν ανταποκρίνεται στην πραγματικότητα με ενδεχόμενες
σοβαρές συνέπειες για τον άρρωστο.[8]
Τα μιτοχόνδρια είναι οργανίδια που βρίσκονται σ' όλους σχεδόν
τους οργανισμούς και θεωρούνται ως τα "ενεργειακά κέντρα" του
κυττάρου. Η εμφάνιση των μιτοχονδρίων διαφέρει σημαντικά μεταξύ των διαφόρων
κυτταρικών τύπων. Τα μιτοχόνδρια είναι συνήθως ωοειδή ή κυλινδρικά, με πλάτος
0,2μm και μήκος μέχρι και 7μm, ενώ υπάρχουν και σφαιρικά μιτοχόνδρια με διάμετρο
0,5 - 5 μm. Τα μιτοχόνδρια των ηπατοκυττάρων, π.χ., είναι ωοειδή, έχουν μήκος 1
- 2 μm και πλάτος 0,5 - 1 μm. Στους ζυμομύκητες τα μιτοχόνδρια είναι σφαιρικά
ενώ στους ινοβλάστες και στα κύτταρα της εξωκρινούς μοίρας του παγκρέατος είναι
επιμήκη και μπορεί να φτάσουν μερικές φορές σε μήκος τα 10 μm.
Το μέγεθος αλλά και το σχήμα των μιτοχονδρίων μπορεί να
μεταβληθεί κάτω από φυσιολογικές συνθήκες ή μετά την επίδραση διαφόρων ουσιών.
Πολύ μεγάλα μιτοχόνδρια, τα οποία ονομάζονται μεγαμιτοχόνδρια και έχουν μήκος
μέχρι και 30 μm, παρατηρούνται σε περιπτώσεις αλκοολισμού και σε διάφορες
παθολογικές καταστάσεις. Στο μυοκάρδιο, π.χ. κάτω από συνθήκες ανοξίας, υποξίας
ή μετά την επίδραση ορμονών ή φαρμάκων σχηματίζονται μεγαμιτοχόνδρια. Μεγαμιτοχόνδρια
παρατηρούνται και σε περιπτώσεις έλλειψης ριβοφλαβίνης ή χαλκού, με αποτέλεσμα
ο μιτοχονδριακός όγκος να αυξάνεται τουλάχιστον 10 φορές σε σχέση με τα κανονικά
μιτοχόνδρια.
Τα μιτοχόνδρια έχουν την ίδια μορφολογία σε κάθε συγκεκριμένο
κυτταρικό τύπο. Στα κύτταρα των θηλαστικών, το σχήμα και το μέγεθος των
μιτοχονδρίων μεταβάλλεται ανάλογα με την ορμονική κατάσταση του οργανισμού.
Αφαίρεση της υπόφυσης π.χ., προκαλεί αλλαγή στα μιτοχόνδρια των κυττάρων του
φλοιού των επινεφριδίων. Προσθήκη αδρενοκορτικοτρόπου ορμόνης επαναφέρει τα
μιτοχόνδρια στην κανονική τους κατάσταση. Η μορφολογία των μιτοχονδρίων μεταβάλλεται
επίσης κατά την ενηλικίωση αλλά και κατά τη μετατροπή ενός κανονικού κυττάρου
σε καρκινικό. Σε ηπατοκύτταρα γερασμένων ποντικών, τα μιτοχόνδρια είναι
μεγαλύτερα από τα μιτοχόνδρια νεαρών ατόμων. Επιπλέον, η μιτοχονδριακή μήτρα
στα γερασμένα άτομα έχει “αφρώδη” εμφάνιση ενώ και ο αριθμός των μιτοχονδριακών
ακρολοφιών είναι μικρότερος σε σχέση με τα νεαρά άτομα. Στα μιτοχόνδρια των
πτητικών μυών εντόμων, μειώνεται επίσης ο αριθμός των μιτοχονδριακών ακρολοφιών
με την ενηλικίωση των ατόμων. [9]
Νεοπλάσματα είναι συναθροίσεις κυττάρων, πού χαρακτηρίζονται από
υπερβολική αυτόνομη αύξηση, με αποτέλεσμα βλάβη του όλου οργανισμού. Εκτός από
τους κακοήθεις όγκους, πού επεκτείνονται καί διηθούν τους υγιείς ιστούς, στα
νεοπλάσματα περιλαμβάνονται καί οι λευχαιμίες. Κύτταρα του όγκου μπορούν να
αποσπασθούν καί να μεταφερθούν με την κυκλοφορία του αίματος καί της λέμφου σε
άλλους ιστούς καί όργανα, να συνεχίσουν έκεί την ανάπτυξη τους καί να σχηματίσουν
θυγατρικούς όγκους (μεταστάσεις).[10]
Σάν παθολογικός μετασχηματισμός χαρακτηρίζεται ή μετατροπή
φυσιολογικών κυττάρων σε κύτταρα πού πολλαπλασιάζονται χωρίς φραγμό. Τα κύτταρα
αυτά θα τα ονομάσουμε, νεοπλασματικά κύτταρα. Πολλοί τύποι κυττάρων (πιθανώς
όλοι) μπορούν να υποστούν νεοπλασματική εξαλλαγή καί να σχηματίσουν όγκους ή
νεοπλάσματα. Οι κακοήθεις όγκοι, πού προέρχονται από τα μεσεγχυματικά κύτταρα,
ονομάζονται σαρκώματα, ενώ αυτοί πού προέρχονται από επιθηλιακά κύτταρα,
καρκινώματα.[10]
Ή νεοπλασματική εξαλλαγή από φυλογενετική άποψη είναι πολύ
παλιά. Γνωρίζουμε φυτικούς όγκους, καθώς καί όγκους κατώτερων καί ανώτερων
ζώων. Οι όγκοι αυτοί συχνά αποτελούν ενδιαφέροντα πρότυπα για την εξέταση των
ιδιοτήτων των νεοπλασματικών κυττάρων. Ή μεγάλη εξάπλωση του νεοπλασματικοϋ
μετασχηματισμού στο βασίλειο των ζώων καί των φυτών είναι δείγμα του ότι οι
αιτίες της νεοπλασματικης εξαλλαγής βρίσκονται σε στενή συσχέτιση με το βασικό
φαινόμενο της ζωής.[10]
Βιολογικές Ιδιότητες των
νεοπλασματικών κυττάρων
Οι περισσότερες ιδιότητες των νεοπλασματικών κυττάρων έγιναν
γνωστές με πειράματα σε ζώα καί με μελέτες σε κυτταροκαλλιέργειες. Γι’ αυτό,
όσα θα αναφερθούν παρακάτω αφορούν πειραματικούς όγκους. Είναι άγνωστο αν οί
γνώσεις μας αυτές μπορούν να επεκταθούν καί στους ανθρώπινους όγκους. Οι
διαφορές, πού παρουσιάζονται μεταξύ όγκων διαφόρων ειδών ζώων, μας κάνουν λίγο
επιφυλακτικούς.[10]
Κυτταρική διαίρεση καί
πολλαπλασιασμός
Στούς φυσιολογικούς ιστούς μόνο τα κύτταρα πού καταστρέφονται αντικαθίστανται.
Πρέπει να υπάρχουν επομένως ρυθμιστικοί μηχανισμοί, πού κατευθύνουν την
κυτταρική διαίρεση με τέτοιο τρόπο ώστε να παρουσιάζεται ισορροπία (ομοιόσταση)
μεταξύ νεκρώσεως καί σχηματισμού νέων κυττάρων. Σέ πολλούς όγκους ή ρύθμιση
αυτή έχει διαταραχθεί, με αποτέλεσμα την υπερβολική παραγωγή κυττάρων (με
κυτταρική διαίρεση). Ή έννοια της «αυτόνομης αυξήσεως» προϋποθέτει, ότι τα
φυσιολογικά κύτταρα εμποδίζονται στο να διαιρούνται συνεχώς, λόγω άλληλεπιδράσεως
με άλλα κύτταρα του ίστού ή με άλλους παράγοντες ρυθμίσεως, ενώ τα
νεοπλασματικά κύτταρα δεν υπακούουν στο ρυθμιστικό αυτό μηχανισμό. Η γνώμη αυτή
είναι παραδεκτή σήμερα.[10]
'Οταν τα κύτταρα διαιρούνται, μηχανισμοί ελέγχου εξασφαλίζουν ότι το γενετικό υλικό ή με άλλα λόγια τα χρωμοσώματα, θα διανεμηθεί σωστά στα θυγατρικά κύτταρα. Ερευνητές του Ινστιτούτου Max Planck για τη Μοριακή Γενετική στο Βερολίνο εξήγησαν τη μοριακή βάση, πάνω στην οποία στηρίζεται ο μηχανισμός αυτός. Οι αποκαλούμενες κινάσες σημείων ελέγχου, δηλαδή τα ένζυμα που εκτελούν αυτόν τον έλεγχο, δεν συνδέονται άμεσα μόνο με τα χρωμοσώματα, όπως πιστευόταν πρωτύτερα. Αντιθέτως, αλληλεπιδρούν με μια διαφορετική κατηγορία πρωτεϊνών, οι οποίες αναμειγνύονται στην ανάπτυξη της μιτωτικής ατράκτου. Το εύρημα αυτό είναι ιδιαιτέρως σημαντικό, αφού μια λανθασμένη διανομή των χρωμοσωμάτων, μπορεί να οδηγήσει σε ανωμαλίες και νοσήματα, όπως ο καρκίνος. Η νέα κατανόηση αυτής της διαδικασίας προάγει με τη σειρά της την καλύτερη κατανόηση των μοριακών αιτιών του καρκίνου.[11]
Εικόνα 7 Aνώμαλη μιτωτική άτρακτος σε καρκινικό κύτταρο. Η τροποποιημένη
κατασκευή της οφείλεται στην αποτυχία των μηχανισμών με τους οποίους ελέγχεται
η κυτταρική διαίρεση. Με πράσινο εικονίζονται οι μικροσωληνίσκοι, με κόκκινο τα
χρωμοσώματα.[11]
Τα ραβδόμορφα νημάτια των μικροσωληνίσκων είναι υπεύθυνα για τη
διαίρεση των χρωμοσωμάτων ενός κυττάρου, καθώς συνδέουν τον κινητοχώρο με το
κεντροσωμάτιο. Το κεντροσωμάτιο οργανώνει την ατρακτοειδή διάταξη των
μικροσωληνίσκων μέσω συμπλεγμάτων δακτυλίων γάμμα σωληνίνης. Μέχρι τώρα
υποτίθετο ότι ο έλεγχος και η ακριβής διανομή των χρωμοσωμάτων καθοριζόταν μόνο
από τις κινάσες σημείων ελέγχου στους κινητοχώρους. Όταν οι μικροσωληνίσκοι
συνδέονταν ορθά στους κινητοχώρους, αυτές οι κινάσες, πληροφορούσαν το κύτταρο
ότι η ακριβής διανομή των χρωμοσωμάτων είναι πραγματοποιήσιμη. Οι επιστήμονες
του Ινστιτούτου ανακάλυψαν τώρα ότι οι κινάσες σημείων ελέγχου σχετίζονται επίσης
με τους δακτυλίους γάμμα σωληνίνης. Συγκεκριμένα ανακάλυψαν ότι οι κινάσες
σημείων ελέγχου υπάρχουν δίπλα στο κεντροσωμάτιο και εκδηλώνουν τη δράση τους
εκεί. Αυτό είναι ένα σημαντικό εύρημα, καθώς δείχνει ότι η ορθή οργάνωση των
μικροσωληνίσκων και στα δύο άκρα τους, είναι απαραίτητη για την ορθή διανομή
των χρωμοσωμάτων κατά την κυτταρική διαίρεση. Ένα άλλο εύρημα που εκπλήσσει
είναι ότι αυτοί οι μηχανισμοί ελέγχου δρουν ανεξαρτήτως από την ακεραιότητα του
κινητοχώρου και των κεντροσωματίων, πράγμα που σημαίνει ότι τα κύτταρα έχουν
πολλούς διαφορετικούς μηχανισμούς για τον έλεγχο της διανομής των χρωμοσωμάτων
και ότι τους εποπτεύουν στο επίπεδο των συμπλεγμάτων πρωτεϊνών. Τα στοιχεία
αυτά είναι άκρως σημαντικά για την κατανόηση των ρύθμισης της κυτταρικής
διαίρεσης, που συχνά αποδιοργανώνεται στα καρκινικά κύτταρα. Οι κινάσες σημείων
ελέγχου στα καρκινικά κύτταρα συχνά τροποποιούνται ή βρίσκονται υπό λανθασμένες
ποσοτικές αναλογίες. Στο επόμενο βήμα οι ερευνητές σκοπεύουν να εντοπίσουν τη
μελέτη τους, στη διερεύνηση των μοριακών αντιδράσεων μεταξύ των διαφορετικών
ρυθμιστικών πρωτεϊνών και στη συνέχεια να ανακαλύψουν πώς αυτές οι αντιδράσεις,
διαφέρουν ανάμεσα, στα υγιή και τα καρκινικά κύτταρα. Προοπτικά από τέτοιες
έρευνες είναι πιθανό να προκύψουν νέες θεραπευτικές ή διαγνωστικές στρατηγικές.[11]
Η υπόθεση των χαλονών.
Δεν είναι ακόμη γνωστό ποιοί μηχανισμοί ρυθμίζουν σε
φυσιολογικές καταστάσεις την ταχύτητα διαιρέσεως των κυττάρων των ιστών. Η
υπόθεση των χαλονών υποστηρίζει, ότι ή κυτταρική διαίρεση στον ιστό ελέγχεται
(καταστέλλεται) από ορισμένες ουσίες, πού ονομάζονται χαλόνες. Οί χαλόνες
παράγονται από τον ίδιο τον ιστό, είναι εξειδικευμένες όσον αφορά τον ιστό αλλά
όχι όσον αφορά το είδος.
Τον τελευταίο καιρό επιτεύχθηκε ή εκχύλιση καί ο εμπλουτισμός
χαλονών από διάφορους ιστούς, όχι όμως ή απομόνωση τους σε καθαρή κατάσταση. Από
χημική άποψη είναι γλυκοπρωτεϊνες. Διακρίνονται χαλόνες πού σταματούν τα κύτταρα
στη φάση G1( δηλαδή
πριν αρχίσει ό άναδιπλασιασμός του DΝΑ, και άλλες, πού διατηρούν τα κύτταρα στη φάση G2, ώστε παρά τον άναδιπλασιασμό
του DΝΑ να μην είναι
δυνατή ή μίτωση. Και στίς δύο περιπτώσεις προκαλείται αναστολή του πολλαπλασιασμού
των κυττάρων.
Θα μπορούσε κανείς να υποθέσει, ότι τα νεοπλασματικά κύτταρα
χαρακτηρίζονται από έλλειψη αντιδράσεως στίς ειδικές για τον ιστό χαλόνες. Γι’
αυτό το λόγο στα κύτταρα αυτά συνεχίζεται ή διαίρεση, παρ' όλο ότι υπάρχουν οί
χαλόνες, πού θα έπρεπε να την εμποδίζουν.[10]
Αναστολή πού οφείλεται στην
πυκνότητα του πληθυσμού.
Οταν φυσιολογικά κύτταρα σε καλλιέργεια σχηματίσουν ένα στρώμα κυττάρων θα έπρεπε, για να συνεχίσουν την αύξηση τους, να σχηματίσουν αναγκαστικά δεύτερο στρώμα κυττάρων. Αυτό δεν γίνεται γιατί παρατηρείται αναστολή της κυτταρικής διαιρέσεως (αναστολή λόγω πυκνότητας. Τα κύτταρα δεν μπορούν πια να αναπτυχθούν. Καλλιέργειες νεοπλασματικών κυττάρων δεν δείχνουν το φαινόμενο αυτό. Είναι άγνωστο αν ή αναστολή οφείλεται σε αντιγόνα επιφανείας, σε ρύθμιση του μεταβολισμού ή στίς προαναφερθείσες χαλόνες καί ποιο ρόλο παίζουν αυτές στους ιστούς in vivo.
Είκόνα 8 Συστατικά
της μεμβράνης και ιδιότητες των μεμβρανών των νεοπλαοτικών κυττάρων. - Μετά από
το μετασχηματισμό των φυσιολογικών κυττάρων σε νεοπλασματικά παρατηρούνται οί
ακόλουθες μεταβολές: μεταβολές στα ένζυμα επιφανείας, μεταβολές στο φορτίο,
εμφάνιση νέων αντιγόνων καθώς καί απώλεια αντιγόνων (κυρίως γλυκοπρωτεϊνών καί
γλυκολιπιδίων). Τα μόρια αυτά είτε χάνονται τελείως είτε έχουν μεταβληθεί τόσο
πολύ ώστε να μην αντιδρούν με τα αντίστοιχα αντισώματα. Από τίς βιολογικές
ιδιότητες της μεμβράνης χαρακτηριστική είναι ή ελαττωμένη κυτταρική
αλληλεπίδραση καί ή αναίρεση της αναστολής λόγω πυκνότητας της κυτταρικής αυξήσεως.
Αντίθετα, τα κύτταρα συγκολλούνται ευκολότερα με λεκτίνες.[10]
Ιδιότητες της μεμβράνης
Με το μετασχηματισμό αλλάζουν ή σύσταση καί οι ιδιότητες της
επιφάνειας του κυττάρου. Οί αλλοιώσεις των συστατικών της μεμβράνης, κυρίως των
γλυκοπρωτεϊνών, φαίνεται να είναι υπεύθυνες για μερικές από τίς αλλαγμένες
βιολογικές ιδιότητες των κυττάρων (κυρίως την αλληλεπίδραση τους).
Απώλεια των επιφανειακών αντιγόνων. Με ανοσολογικές μεθόδους
αποδεικνύεται, ότι τα καλλιεργούμενα κύτταρα χάνουν ορισμένα επιφανειακά
αντιγόνα μετά το μετασχηματισμό τους σε νεοπλασματικά κύτταρα από όγκογόνους
ιούς. Ιδιαίτερη σημασία έχει δοθεί σε μια μεγαλομοριακή γλυκοπρωτεΐνη πού
χαρακτηρίζεται σαν «LETS-γλυκοπρωτείνη»
Η πρωτεΐνη αυτή φαίνεται να είναι σημαντική για ορισμένες κυτταρικές
λειτουργίες, π.χ. για την αναστολή πυκνότητας καί για την προσκόλληση των
κυττάρων. Κύτταρα πού έχουν χάσει την LETS-πρωτεΐνη μπορούν να αναπτυχθούν σε καλλιέργειες αίωρήσεως,
κι αυτό είναι ένα συχνό χαρακτηριστικό των νεοπλασματικών κυττάρων. Επίσης καί
άλλες πρωτεΐνες, π.χ. ένα επιφανειακό αντιγόνο των ίνοβλαστών, εξαφανίζονται
μετά τον μετασχηματισμό των κυττάρων.[10]
Αντιγόνα όγκων.
Στά κύτταρα ορισμένων πειραματικών όγκων ανιχνεύονται αντιγόνα,
πού δεν παρατηρούνται στα αντίστοιχα φυσιολογικά κύτταρα. Καμιά φορά αυτά
δείχνουν διασταυρωτές αντιδράσεις με αντιγόνα εμβρυϊκών κυττάρων. Από αυτό
βγήκε το συμπέρασμα, ότι τα νεοπλασματικά κύτταρα «αποδιαφοροποιούνται» καί,
κατά κάποιο τρόπο, επανέρχονται στην εμβρυϊκή κατάσταση. Η αντίληψη αυτή πάντως
δεν προωθεί τίς γνώσεις μας, αφού δεν έχει επιτευχθεί ή διαλεύκανση των μοριακών
καί λειτουργικών βάσεων των ανοσολογικών αυτών διαφορών, ώστε να δοθεί αιτιολογική
εξήγηση για τίς βιολογικές ιδιότητες των όγκων.[10]
Αερόβιος γλυκόλυση
Το 1923 ό Warburg
παρατήρησε ότι νεοπλασματικά κύτταρα κάτω από αερόβιες συνθήκες παρουσιάζουν
αυξημένο σχηματισμό γαλακτικού οξέος. Λόγω του ότι στα φυσιολογικά κύτταρα
συνήθως μόνο σε αναερόβιες συνθήκες παρατηρείται αξιοσημείωτος σχηματισμός
γαλακτικού οξέος, ονόμασε το φαινόμενο αυτό αερόβιο γλυκόλυση. Το εύρημα αυτό
επιβεβαιώθηκε σε πολλά εργαστήρια. Πάντως δεν φαίνεται να είναι σωστό το συμπέρασμα,
οτι αυτή είναι ή διαφορά των νεοπλασματικών από τα φυσιολογικά κύτταρα του
οργανισμού. Υπάρχουν καί σε φυσιολογικούς οργανισμούς κύτταρα, πού δείχνουν
έντονη αερόβιο γλυκόλυση.
Πολυάριθμες μελέτες του μεταβολισμού των νεοπλασματικών
κυττάρων, κυρίως της αερόβιας γλυκολύσεώς τους, προσπάθησαν να δείξουν
ποιοτικές μεταβολές στην ένζυμική σύσταση ή στους μεταβολικούς τους δρόμους. Το
αποτέλεσμα ήτανε αρνητικό. Αν εξαιρέσουμε τίς «ένζυμικές ελλείψεις» πού καμιά
ψορά παρατηρούνται, τα νεοπλασματικά κύτταρα περιέχουν τα ίδια ένζυμα καί
παράγουν γαλακτικό οξύ κατά τον ίδιο τρόπο όπως καί τα φυσιολογικά
κύτταρα·επίσης ο οξειδωτικός μεταβολισμός τους είναι ποιοτικά όμοιος. Η
αυξημένη παραγωγή γαλακτικού οξέος πρέπει επομένως να εξηγηθεί σαν αποτέλεσμα
αλλοιωμένης ρυθμίσεως του μεταβολισμού.[10]
Αναπνοή
Έκτος από τη σχετικά μεγάλη ταχύτητα σχηματισμού γαλακτικού
οξέος κάτω από αερόβιες συνθήκες, ό Warburg παρατήρησε ότι ή πρόσληψη οξυγόνου από τα κύτταρα των
όγκων είναι πολύ μικρότερη άπ' αυτήν των άλλων ιστών. Οι μικρότερες τιμές αναπνοής
πάντως δεν είναι πάντοτε τυπικές για όλα τα είδη νεοπλασματικών κυττάρων, όπως
διεπίστωσε αργότερα σε μεγάλες σειρές πειραμάτων. Επίσης το εύρημα ότι μερικά
νεοπλασματικά κύτταρα περιέχουν λιγότερα μιτοχόνδρια, σε σύγκριση με τα φυσιολογικά,
δεν έχει γενική ισχύ.
Με βάση την παρατήρηση αυτή ό Warburg διετύπωσε την υπόθεση, ότι ή
μικρότερη αναπνοή καί ο σχετικά υψηλότερος ρυθμός της αερόβιου γλυκολύσεώς δεν
αποτελούν μόνο χαρακτηριστική ιδιότητα του νεοπλασματικοϋ κυττάρου, αλλά είναι
καί ή αιτία της κακοήθους εξαλλαγής. Ή υπόθεση αυτή κλονίσθηκε με πειράματα σε
«όγκους ελάχιστης αποκλίσεως» Με χημικά καρκινογόνα παράγονται ηπατικοί όγκοι,
πού μόλις διαφέρουν στο μεταβολισμό τους από τα φυσιολογικά ηπατικά κύτταρα. Ιδιαίτερα
δεν δείχνουν αυξημένη αερόβιο γλυκόλυση, παρ' όλο ότι έχουν όλες τίς ιδιότητες
των καρκινικών κυττάρων.
Ό Warburg συμπέρανε, ότι ή ενέργεια πού παράγεται από την αναερόβιο
γλυκόλυση είναι «μορφογενετικά κατώτερη». Δεν μπορούν όμως να καταδειχθούν
μηχανισμοί, πού να διακρίνουν το ΑΤΡ, πού παράγεται από τη γλυκόλυση, από το ΑΤΡ
πού δημιουργείται από τον οξειδωτικό μεταβολισμό. Επίσης, το συμπέρασμα ότι τα
κύτταρα πού πρέπει να καλύψουν τίς ενεργειακές τους ανάγκες με αναερόβιο
μεταβολισμό άποδιαφοροποιούνται, δεν έχει αποδειχθεί πειραματικά. Αντίθετα,
χαρακτηριστικό του εμβρυϊκού ιστού είναι ό σχετικά υψηλός ρυθμός γλυκολύσεώς.
Η θεωρία του Warburg,
με την οποία νόμισε ότι είχε λύσει το πρόβλημα του καρκίνου, δηλαδή ότι τα
κύτταρα λόγω ελαττώσεως ή δηλητήριασεως της κυτταρικής τους αναπνοής ωθούνται
στο δρόμο της αναερόβιας γλυκολύσεώς καί έτσι ανάγκα στικά άποδιαφοροποιοϋνται
καί μεταβάλλονται σε καρκινικά κύτταρα, δεν ισχύει πια στη μορφή αυτή.
Πάντως είναι αλήθεια, Οτι στα περισσότερα νεοπλασματικά κύτταρα
ή σημασία της αναπνοής καί της παραγωγής γαλακτικού οξέος είναι διαφορετικά
κατανεμημένες παρά στα φυσιολογικά κύτταρα από τον ίδιο ιστό. Η κύρια αιτία γι’
αυτό είναι άγνωστη. Δεν έχει βρεθεί απάντηση στο ερώτημα γιατί τα νεοπλασματικά
κύτταρα, σχεδόν χωρίς εξαίρεση, δείχνουν υψηλότερο ρυθμό αερόβιας γλυκολύσεως.
Ίσως αυτό να έχει σχέση με το γεγονός, ότι τα νεοπλασματικά κύτταρα παραλαμβάνουν
3-10 φορές γρηγορότερα τη γλυκόζη από τα φυσιολογικά κύτταρα.[10]
Ενδιάμεσος μεταβολισμός
Σέ πολυάριθμες μελέτες έγινε σύγκριση του κιτρικού κύκλου καί
των σχετικών μεταβολικών δρόμων μεταξύ όγκων καί φυσιολογικών ίστών. Από
ποιοτική άποψη δεν βρέθηκαν διαφορές. Ποσοτικές διαφορές βρέθηκαν συχνά προς τη
μια ή την άλλη κατεύθυνση, αλλά αυτό οφείλεται σε δυσκολίες ανευρέσεως του
κατάλληλου για σύγκριση ιστού. Ανάλογες μελέτες έγιναν σχετικά καί με άλλους
δρόμους του διάμεσου μεταβολισμού. Τα αποτελέσματα είναι γενικά πτωχά καί
δύσκολο να εξηγηθούν. Πάντως αποδείχθηκε, ότι δεν υπάρχει ουσιαστική μεταβολική
βλάβη στο νεοπλασματικό κύτταρο.[10]
Μεταβολισμός πρωτεϊνών καί
νουκλεϊνικών οξέων
Ο μεταβολισμός των αμινοξέων, καθώς καί ή βιοσύνθεση των πρωτεϊνών
καί των νουκλεϊνικών οξέων, προχωρεί στα νεοπλασματικά κύτταρα με όμοιο τρόπο
όπως καί στα φυσιολογικά. Ό ρυθμός της πρώτεϊνοσυνθέσεως στα νεοπλασματικά
κύτταρα είναι όμοιος, όπως καί σε άλλους γρήγορα αυξανόμενους ιστούς. Το ίδιο
ισχύει καί για το μεταβολισμό των νουκλεϊνικών οξέων.
Συμπερασματικά μπορούμε να πούμε, ότι με μοναδική εξαίρεση την
αερόβιο γλυκόλυση πού συζητήθηκε παραπάνω, δεν έχουν βρεθεί ουσιαστικές
διαφορές μεταξύ του μεταβολισμού των νεο-πλασματικών καί των φυσιολογικών
κυττάρων, παρ' όλο ότι έχουν γίνει πολυάριθμες έρευνες τα τελευταία 30 χρόνια.
Μπορούμε επομένως να συμπεράνουμε, ότι ή πρωτογενής διαφορά μεταξύ φυσιολογικών
καί νεοπλασματικών κυττάρων δεν οφείλεται σε διαφορές του διάμεσου μεταβολισμού.[10]
Απώλεια ενζύμων
Οι μόνες διαταραχές στο μεταβολισμό των νεοπλασματικών κυττάρων,
πού έχουν μια σχετική σημασία, είναι οί επονομαζόμενες «ένζυμικές απαλείψεις»,
δηλαδή ή απώλεια ορισμένων ενζύμων. Αυτό είναι αποτέλεσμα διεργασιών πού
γίνονται στον κυτταρικό πυρήνα: λόγω αυξήσεως της έτεροχρωματώσεως, δηλαδή μετατροπής
της εύχρωματίνης (της χρωματίνης πού μπορεί να μεταγραφεί σε RΝΑ) σε έτεροχρωματίνη (κλάσμα χρωματίνης
πού δεν μπορεί να μεταγραφεί), παύουν οι πληροφορίες για τη βιοσύνθεση της
πρωτεΐνης. Ετσι, μετά από λίγο χρόνο χάνεται το ένζυμο (πρόκειται δηλαδή για
λειτουργική απώλεια: δεν πρέπει να γίνει σύγχυση της έννοιας αυτής με την
απώλεια τεμαχίων χρωμοσωμάτων). Στούς διάφορους τύπους νεοπλασματικών κυττάρων
προσβάλλονται διαφορετικά ένζυμα. Πολλά νεοπλασματικά κύτταρα δεν εμφανίζουν
ένζυμικές απώλειες.
Σέ ορισμένους όγκους παρουσιάζεται απώλεια, πού εμποδίζει το
κύτταρο να συνθέτει ασπαραγίνη. Στά κύτταρα αυτά ή ασπαραγίνη μεταβάλλεται σε
«απαραίτητο άμινοξύ» πού πρέπει να προσφερθεί με την κυκλοφορία του αίματος. Ή
προσπάθεια να έμποδισθεί ή προσφορά της ασπαραγίνης με το ένζυμο ασπαραγινάση,
γεγονός πού θα οδηγούσε σε αναστολή της αυξήσεως, δεν είχε επιτυχία. Φαινόμενο
αντίθετο με την απώλεια ενζύμων είναι ή εμφάνιση πρωτεασών κατά τη διάρκεια του
κακοήθους μετασχηματισμού με ιούς. Στήν περίπτωση αυτή επάγονται πρωτεάσες του
κυττάρου, πού συντελούν στην ωρίμανση των πρωτεϊνών του ίου. Μπορεί επίσης να
επαχθούν καί εξωκυτταρικές πρωτεάσες, π.χ. ένας ενεργοποιητής της πλασμίνης.[10]
Μοριακή βιολογία του
νεοπλασματικοϋ μετασχηματισμού
Είναι γενικά παραδεκτό σήμερα, ότι ό μετασχηματισμός ενός
φυσιολογικού σε ένα νεοπλασματικό κύτταρο παριστάνει διεργασία στην οποία συμμετέχει
το γενετικό υλικό του κυτταρικού πυρήνα καί έχει σαν αποτέλεσμα αλλαγή στίς
γενετικές πληροφορίες. Μια τέτοια αλλαγή δεν σημαίνει ότι έχει εμφανισθεί ένα
νέο ή σκόπιμα μεταβλημένο δομικό γονίδιο. Το πιθανότερο είναι ή εξουδετέρωση
ρυθμιστικών ή ανασταλτικών γονιδίων, δηλαδή ή εξουδετέρωση γενετικών πληροφοριών,
πού είναι απαραίτητες για την ισορροπία των διαφόρων τάσεων καί διεργασιών μέσα
στο κύτταρο. Μια τέτοια διαταραχή στην ισορροπία μπορεί να οφείλεται σε
διάφορους μηχανισμούς:
·
Την ενσωμάτωση ξένου DΝΑ (π.χ. DΝΑ ίου) στο γονιδίωμα των σωματικών
κυττάρων: μετασχηματισμός από όγκογόνους ιούς.
·
Τη συνάντηση γενετικών στοιχείων από διάφορα
είδη, φυλές ή άτομα, πού δεν συμβιβάζονται: γενετικά καθορισμένος
νεοπλασματικόςμετασχηματισμός.
·
Την αυτόματη ή επαγόμενη μετάλλαξη σωματικών
κυττάρων, πού με κυτταρική διαίρεση μεταδίδουν στα θυγατρικά τους κύτταρα τίς
μετάβλημένες γενετικές πληροφορίες. Ετσι σχηματίζεται κλώνος, από τον όποιο
γεννώνται οι όγκοι: μετασχηματισμός με σωματική μετάλλαξη.
Οσον άφορα τους όγκους πού οφείλονται σε ιούς, γνωρίζουμε σε
πολλές περιπτώσεις την θέση του «όγκογόνου», δηλαδή το τμήμα του DΝΑ του ίου, πού έχει τίς πληροφορίες
για το μετασχηματισμό του κυττάρου σε νεοπλασματικό κύτταρο. Σέ μερικές
περιπτώσεις είναι επίσης γνωστό, ότι αυτά τα Οnc-γονίδια κωδικοποιούν ορισμένες
πρωτεΐνες·το Οnc-γονίδιο
του SV 40 κωδικοποιεί
π.χ. για το Τ-άντιγόνο στον πυρήνα. Πάντως δεν μπορεί ακόμη να συσχετισθούν
αιτιολογικά οι γενετικές πληροφορίες πού συνεισφέρουν οι ιοί με το νεοπλασματικό
μετασχηματισμό.[ι]
Μπορεί να διατυπωθεί ή ακόλουθη υπόθεση σχετικά με τον γενετικά
καθορισμένο καί τον εκλυόμενο από χημικά ή φυσικά καρκινογόνα νεοπλασματικό
μετασχηματισμό φυσιολογικών κυττάρων: τα περισσότερα ή όλα τα κύτταρα του
οργανισμού περιέχουν ήδη τη γενετική πληροφορία, πού είναι απαραίτητη για τίς
ιδιαίτερες βιολογικές ιδιότητες των καρκινικών κυττάρων. Δεν είναι ακόμη γνωστό,
αν ή πληροφορία αυτή είναι εντοπισμένη σε συγκεκριμένα γονίδια, πού είναι απαραίτητα
για ορισμένες φάσεις της φυσιολογικής εξελίξεως των ατόμων, ή εισήλθε στα
κύτταρα με πανταχού παρόντες ιούς, πιθανώς προ πολλών εκατοντάδων εκατομμυρίων
ετών. Η γενετική πληροφορία έχει συνήθως κατασταλεί με ορισμένα ρυθμιστικά ή
κατασταλτικά γονίδια. Μόνο σε περίπτωση έξουδετερώσεως των γονιδίων αυτών
προκαλείται ενίσχυση του όγκογόνου γονιδίου καί μεταβολή του κυττάρου σε νεοπλασματικό
κύτταρο. Για την αιτιολογία των περισσότερων όγκων πού προκαλούνται από φυσικά
ή χημικά καρκινογόνα υπάρχει ή υπόθεση ότι από τη μεταλλακτική επίδραση των
καρκινογόνων ουσιών εξουδετερώνονται ρυθμιστικά ή ανασταλτικά γονίδια πού κάτω
από κανονικές συνθήκες αναστέλλουν τα γονίδια των όγκων. "Ετσι
ενεργοποιείται το όγκογόνο γονίδιο, με αποτέλεσμα μετασχηματισμό των κυττάρων
σε νεοπλασματικά κύτταρα.[10]
Τα ρυθμιστικά γονίδια μπορούν επίσης να αποβληθούν μετά από
ορισμένες διασταυρώσεις (ή σπανιότερη περίπτωση καθαρά γενετικά προκαλούμενου
όγκου).
Είναι τελείως άγνωστη ακόμη ή φύση των πληροφοριών πού
μεταβιβάζονται με τα όγκογόνα γονίδια ή με το DΝΑ των όγκογόνων ίων. Θα μπορούσε να
έχει άμεση σχέση με τον κυτταρικό πολλαπλασιασμό, το πιθανότερο όμως είναι ότι
ή πληροφορία αυτή μετατρέπεται στο κύτταρο σε ορι σμένα στοιχεία της κυτταρικής
μεμβράνης. Οπως αναφέραμε παραπάνω, τα νεοπλασματικά κύτταρα διαφέρουν από τα
υγιή σε ορισμένες ιδιότητες των μεμβρανών τους. Στίς ιδιότητες αυτές των
μεμβρανών οφείλονται μερικά από τα βιολογικά χαρακτηριστικά, π.χ. ή έλλειψη της
αναστολής λόγω πυκνότητας (πιθανώς από ελλιπή αντίδραση στίς χαλόνες). Η
εμφάνιση των αλλαγμένων αυτών ιδιοτήτων στην κυτταρική μεμβράνη προκαλεί δευτερογενώς
εξουδετέρωση των μηχανισμών ρυθμίσεως, πού φυσιολογικά ελέγχουν τον κυτταρικό
πολλαπλασιασμό καί την κυτταρική αύξηση[10]
Χρωματοσωματικές μεταθέσεις
και ογκογένεση
Ένα σημαντικό εύρημα, που ενοποιεί την Κυτταρογενετική με τη
Μοριακή Γενετική του καρκίνου, είναι το ότι, σε ορισμένες περιπτώσεις, ένα
πρωτο-ογκογονίδιο ενεργοποιείται μέσω κάποιας χρωματοσωματικής μετάθεσης. Δύο
πολύ γνωστά παραδείγματα, τα δύο πρώτα στα οποία κλωνοποιήθηκαν τα σημεία
θραύσης της μετάθεσης, είναι η μετάθεση μεταξύ των χρωματοσωμάτων 8 και 14, στο
λέμφωμα Burkitt, και η
μετάθεση μεταξύ των χρωματοσωμάτων 9 και 22, που παρατηρείται στη χρόνια
μυελογενή λευχαιμία.[12]
Λέμφωμα Burkitt
Το λέμφωμα Burkitt είναι ένας καρκίνος των λεμφοκυττάρων Β της γνάθου, ο οποίος
εμφανίζει ασυνήθιστη γεωγραφική κατανομή. Είναι η συνηθέστερη μορφή παιδικού
καρκίνου στην ισημερινή Αφρική, αλλά οπουδήποτε αλλού σπανίζει. Στους
περισσότερους όγκους αυτού του τύπου, το πρωτο-ογκογονίδιο myc μετατίθεται από τη φυσιολογική
χρωματοσωματική του θέση (8q24)
σε κάποια θέση άπω ως προς τον γενετικό τόπο της βαριάς αλυσίδας της
ανοσοσφαιρίνης (14q32).
Κυτταρογενετικά, αυτό εμφανίζεται ως μια φαινομενικά ισοζυγισμένη μετάθεση
8/14. Δεν έχει ακόμη εξακριβωθεί πλήρως ο ακριβής μηχανισμός μέσω του οποίου η
μετάθεση επιτρέπει την ενεργοποίηση του γονιδίου myc και την έναρξη της ογκογένεσης. Απ'
ό,τι φαίνεται, η μετάθεση τοποθετεί κάποιον ενισχυτή ή άλλες αλληλουχίες που
ενεργοποιούν την μεταγραφή, οι οποίες φυσιολογικά συνδέονται με το γονίδιο της
ανοσοσφαιρίνης, κοντά στο τηγο. Την υπόθεση αυτή υποστηρίζει το ότι σε άλλες
μεταθέσεις που παρατηρούνται σε μικρότερο ποσοστό λεμφωμάτων Burkitt συμμετέχουν
επίσης γονίδια ελαφρών αλυσίδων ανοσοσφαιρινών στα χρωματοσώματα 22 ή 2. Οποιοσδήποτε
κι αν είναι ο μηχανισμός, οι μεταθέσεις αυτές ασκούν σαφώς σημαντική επίδραση
στο γονίδιο ηιγο, επιτρέποντας την ανεξέλεγκτη έκφραση του. [12]
Χρόνια μνελογενής λευχαιμία
Αρχικά, η κυτταρογενετική ανωμαλία που παρατηρείται στη χρόνια
μυελογενή λευχαιμία (CML)
περιγράφηκε ως έλλειμμα του μεγάλου βραχίονα του χρωματοσώματος 22, που
αποτελεί χαρακτηριστικό των κακοηθών κυττάρων όλων σχεδόν των ασθενών με CML. Όταν άρχισαν να χρησιμοποιούνται
οι τεχνικές χρωματοσωματικής ζώνωσης, το αποκαλούμενο χρωματόσωμα Φιλαδέλφεια
(Ρh1) προσδιορίσθηκε από
τον Rowel (1973) ως
προϊόν μετάθεσης μεταξύ των χρωματοσωμάτων 9 και 22, το τμήμα που έλειπε από το
χρωματόσωμα 22 δεν είχε απωλεσθεί, αλλά είχε μετατεθεί στο χρωματόσωμα 9
(Εικόνα 9 ). Η μετάθεση μετακινεί το πρωτοογκογονίδιο αbl από τη φυσιολογική χρωματοσωματική
του θέση στην «περιοχή σημείων θραύσης BCR» μια γονιδιακή περιοχή αγνώστου λειτουργίας στο χρωματόσωμα
22q. Η γειτνίαση των
αλληλουχιών ΒCR και abl επιτρέπει τη σύνθεση μιας
χιμαιρικής πρωτεΐνης, η οποία έχει μεγαλύτερο μήκος από τη φυσιολογική πρωτεΐνη
abl και αυξημένη
ενεργότητα κινάσης της τυροσίνης. Αν και η λειτουργία των φυσιολογικών
πρωτεϊνών abl και ΒCR δεν έχει ακόμη κατανοηθεί,
υποθέτουμε ότι το χιμαιρικό γονίδιο μεταβάλλει την έκφραση και τη λειτουργία
της πρωτεΐνης αβί στα κακοήθη αιμοποιητικά κύτταρα. Πράγματι, όταν στον μυελό
των οστών υγιών ποντικών έγινε εισαγωγή ενός ρετροϊικού γονιδιακού σκευάσματος
με το χιμαιρικό γονίδιο, τα μολυσμένα τρωκτικά ανέπτυξαν αιματολογικές κακοήθειες,
μεταξύ των οποίων και CML,.
Αυτό το αποτέλεσμα υποδεικνύει ότι το χρωματόσωμα Φιλαδέλφεια μπορεί πράγματι
να προκαλέσει την κακοήθεια από μόνο του. [12]
Κληρονομικές εύθραυστες
θέσεις και ογκογονίδια
Υπάρχουν τουλάχιστον 17 σημεία στα ανθρώπινα χρωματοσώματα με κληρονομική προδιάθεση για θραύση. Δέκα από αυτά τα σημεία βρίσκονται μέσα ή κοντά σε περιοχές που εμπλέκονται σε χαρακτηριστικές χρωματοσωματικές ανωμαλίες των λεμφωμάτων και των λευχαιμιών (οξεία μη λεμφοκυτταρική λευχαιμία και λέμφωμα μη-Hodgkin) και ορισμένα από αυτά βρίσκονται μέσα ή κοντά σε θέσεις πρωτοογκογονιδίων. Μέχρι τώρα, πάντως, όλες αυτές οι παρατηρήσεις δεν έχουν οδηγήσει σε τίποτα περισσότερο. Η ενδεχόμενη συσχέτιση κληρονομικών εύθραστων θέσεων με προδιάθεση για καρκίνο παραμένει αναπόδεικτη. [12]
Εικόνα 9 Η χρωματοσωματική
μετάθεση Φιλαδέλφεια, t(9q34/22q11). Το χρωματόσωμα Φιλαδέλφεια (Ρh1) είναι το παράγωγο
χρωματόσωμα 22, το οποίο έχει ανταλλάξει μέρος του μεγάλου βραχίονα του με
τμήμα υλικού από το χρωματόσωμα 9q που περιέχει το ογκογονίδιο αbl. Ο σχηματισμός του χιμαιρικού γονιδίου bcr-abl στο χρωματόσωμα Φιλαδέλφεια αποτελεί το κρίσιμο γενετικό
γεγονός για την ανάπτυξη της χρονιάς μυελογενούς λευχαιμίας [12]
Καρκίνος του πνεύμονα
Παρατηρείται συχνή απώλεια χρωμοσωμάτων σε περιπτώσεις καρκίνου
του πνεύμονα. Κυρίως απουσιάζουν τα χρωμοσώματα 3p, 9p και 17p, ενώ τρεις
περιοχές του χρωμοσώματος 3 (3p25, 3p21.3 και 3p14) απουσιάζουν στο 90% των
NSCLC όγκων και περίπου στο 50% των NSCLC όγκων. Τα ογκογονίδια Ras ευρίσκονται
συχνά ενεργοποιημένα (Κ-Ras 30% σε NSCLC και όχι σε SCLC). Τα ογκογονίδια Myc,
c-erbΒ2 και Bcl-2 κυρίως ευρίσκονται ενεργοποιημένα στο 10-25% των περιπτώσεων
με NSCLC. Ανωμαλίες στο ογκοκατασταλτικό γονίδιο Rb καθώς και σε μεταγραφικούς
παράγοντες και άλλους ρυθμιστές του κυτταρικού κύκλου (E2F, p53, p21WAF
κυκλίνες κ.ά.) είναι συχνό γεγονός στον καρκίνο του πνεύμονα. Αλλοιώσεις στο
ογκοκατασταλτικό γονίδιο της πρωτεΐνης p53 είναι το πιο συχνό γενετικό συμβάν
που συνυπάρχει με τον καρκίνο12. Οι μεταλλάξεις στο γονίδιο της p53
μπορεί να είναι είτε ελλείψεις τμήματος του γενετικού υλικού είτε σημειακές μεταλλάξεις.
Μπορεί επίσης να έχουμε υπερέκφραση του γονιδίου. Στον καρκίνο του πνεύμονα ο
κυρίαρχος τύπος σημειακής μετάλλαξης είναι μεταστροφή του ζεύγους βάσεων GC σε
ΤΑ η οποία σχετίζεται με σύμπλοκα βενζοπυρενίου, η δημιουργία των οποίων είναι
αποτέλεσμα του καπνίσματος. Η συχνότητα των μεταλλάξεων στο γονίδιο της p53
κυμαίνεται περί το 50% για τις περιπτώσεις NSCLC και 80% για τις SCLC. Ένα
επίσης σημαντικό ογκοκατασταλτικό γονίδιο που εμπλέκεται και στον καρκίνο του
πνεύμονα είναι το p16-INK4A που ευρίσκεται στο χρωμόσωμα 9p21. Το p16-ΙΝΚ4Α
εμποδίζει ρυθμιστές του κυτταρικού κύκλου, όπως είναι η οικογένεια των
κυκλινοεξαρτώμενων κινασών (CDKs), ενώ σύγχρονες μελέτες δείχνουν την εμπλοκή
του p16 σε περιπτώσεις NSCLC και SCLC. [13]
Γενετική Καρκίνου Ουροδόχου
Κύστεως : Φαινοτυπικά Χαρακτηρηστικά-Κυτταρογενετική Εξέλιξη.
Την τελευταία δεκαετία,οι μελέτες του ανθρώπινου καρκίνου έχουν
αρχίσει να δίδουν μοριακές πληροφορίες για την ταυτότητα πολλαπλών γενετικών
αλλαγών που χαρακτηρίζουν την ανάπτυξη και την πρόοδο των νεοπλασμάτων.Η
προσοχή εστιάστηκε αρχικά στα ογκογονίδια και πιο πρόσφατα στα ογκοκατασταλτικά
γονίδια.Σήμερα,αν και ατελής,έχει αρχίσει να μορφοποιείται η αποψή μας,στο πως
ο πολλαπλασιασμός των κυττάρων μπορεί να απορυθμίζεται από την ενεργοποίηση ή
την αδρανοποίηση αυτών των γονιδίων.Είναι ξεκάθαρο ότι οι διαφορές στον κλινικό
φαινότυπο μεταξύ όγκων που προέρχονται από τον ίδιο ιστό είναι κατευθείαν
αποτέλεσμα των γενετικών τους διαφορών,δηλαδή ότι φαινότυπος καθορίζεται από
τον γονότυπο.Η διαπίστωση αυτών των γενετικών αλλαγών και των συνεπειών τους
αποτελούν τις απαραίτητες προυποθέσεις στις μελλοντικές προσπάθειες για την
βελτίωση της διάγνωσης,πρόβλεψη της πρόγνωσης και την αντιμετώπιση των
νεοπλασμάτων στον άνθρωπο.Μερικές από τις προυποθέσεις έχουν τώρα καλυφθεί και
η κλινική εφαρμογή των μοριακών γενετικών πληροφοριών γρήγορα γίνεται
πραγματικότης.[ν]
Είναι φανερό από πολλά χρόνια ότι το καρκίνωμα μεταβατικού
επιθηλίου(TCC) αποτελεί μία ετερογενή ομάδα νεοπλασιών που εκδηλώνεται σε δύο
κυρίως κλινικούς φαινότυπους με τελείως διαφορετική πρόγνωση.Γύρω στο 20% των
όγκων είναι διηθητικοί στην πρώτη τους εμφάνιση.Αυτοί οι όγκοι συνοδεύονται από
κακή πρόγνωση και αποτελούν επίσης το μεγαλύτερο ποσοστό θανάτων από τα TCC.Τα
εναπομένοντα 80% είναι επιφανειακά, θηλώδη νεοπλάσματα που μπορεί να ελεχθούν
με τοπική αφαίρεση και με καλή πρόγνωση.Αν και μερικά από αυτά (10-20%)
προχωρούν σε μυική διήθηση,η φυσική εξέλιξη και η ακριβής σχέση μεταξύ αυτών
των τύπων δεν είναι ξεκαθαρισμένη.Και στις δύο ομάδες των όγκων,η αντιμετώπιση
επηρεάζεται από δυσκολίες στην υποταξινόμηση.Για τους επιφανειακούς όγκους,η
δυσκολία βρίσκεται στην διαπίστωση αυτών των όγκων που θα προχωρήσουν σε μυική
διήθηση και για τους οποίους η πρώιμη ριζική θεραπεία θα είναι ευεργετική.Για
τους διηθητικούς όγκους,χρειάζονται κριτήρια για να διαχωρίσουν τους
όγκους που μπορούν να ανταποκριθούν στην
θεραπεία και σε αυτούς που θα προχωρήσουν σε μετάσταση.Οι γενετικές αλλαγές που
θα διαπιστώνουν τις διαφορετικές κατηγορίες των όγκων ισως μπορούν να μας βοηθήσουν στην καλύτερη
αντιμετώπιση.[14]
Ο κυτταρικός κύκλος ρυθμίζεται από πολλά γονίδια που δρούν είτε
ευοδώνοντας την πρόοδο του κύκλου είτε σαν ρυθμιστές ποικίλων σημείων ελέγχου
που δρούν σαν συστήματα παρακολούθησης
διακόπτωντας τον κυτταρικό κύκλο όταν συμβεί βλάβη στο γονιδίωμα.Η
πρόοδος του κύκλου επι βλάβης του DNA ασφαλώς θα οδηγήσει σε
μεταλλαξιογένεση,που θα συμμετέχει στην εμφάνιση και την πρόοδο του καρκίνου.
[14]
Πρόσφατες μελέτες μοριακής ανάλυσης έχουν διαπιστώσει συχνές
γονιδιακές ενισχύσεις σε σκέλη διαφόρων χρωμοσωμάτων και περιοχές υψηλής ενίσχυσης DNA ενίσχυσης
σε δείγματα από καρκίνο κύστεως.Αυτές οι αλλαγές είναι σπάνιες σε Τα όγκους και
αυξάνονται σε Τ1 όγκους,ενώ είναι πολύ συχνώτερες σε διηθητικούς όγκους.,χωρίς
όμως να έχουν διαπιστωθεί ακόμη όλα τα υπεύθυνα ογκογονίδια. Με την ταχεία
ανάπτυξη της χαρτογράφησης του ανθρωπίνου γονιδιώματος,χιλιάδες καλώς χαρτογραφημένοι,πολυμορφικοί
δείκτες είναι τώρα διαθέσιμοι και μπορούν να χρησιμοποιηθούν για ευρεία έρευνα
των διαγραφών στο γονιδίωμα.Οι μέχρι τώρα διαπιστωθείσες γονιδιακές αλλαγές
στον καρκίνο μεταβατικού επιθηλίου,η συχνότητα εμφάνισης και η κλινική τους
σημασία σχετικά με την εξέλιξη της νόσου αναφέρονται στον ακολουθούντα πίνακα.
[14]
Γενετικές Μεταβολές στο
Καρκίνο της Κύστεως
-------------------------------------------------------------------------------------------------------
Γονίδιο
Μεταβολή
Συχνότης (%) Κλινική συσχέτιση
-------------------------------------------------------------------------------------------------------
Αλλαγές πρωτο-ογκογονιδίων
HRAS Σημειακή
Μετάλλαξη 6-44 grade?
MYC Γονιδιακή ενίσχυση stage/grade
ERBB2 Γονιδιακή
Ενίσχυση 14 stage/grade
Mdm2 Γονιδιακή
ενίσχυση 20 ?
CCND1 Γονιδιακή
Ενίσχυση 20 Καμμία
1q22-24 Γονιδιακή Ενίσχυση stage/grade
3p24 Γονιδιακή
Ενίσχυση stage/grade
6p22 Γονιδιακή
ενίσχυση stage/grade
8q21-22 Γονιδιακή
Ενίσχυση stage/grade
10q13-14 Γονιδιακή
Ενίσχυση stage/grade
10q22-23 Γονιδιακή
Ενίσχυση
stage /grade
12q15 Γονιδιακή
Ενίσχυση stage/grade
20q Γονιδιακή
Ενίσχυση
stage/grade
Αλλαγές ογκοκατασταλτικών γονιδίων
RB(13q14) Διαγραφή 30
High
stage(35-60%)
πρόοδος,επιβίωση
TP53 (17ρ13) Διαγραφή. 18-70 High
stage/grade (50-70%)
Σημ.Μετάλλαξη
πρόοδος,επιβίωση
3p LOH 48 High stage/grade(66%)
4p LOH 22 Καμμία
8p LOH 23 High stage/grade (53%)
9p & q LOH >60 Καμμία
10q
23(PTEN) LOH 10-30 High stage
11p LOH 40 High grade
11q LOH 15 ?
14q LOH 10-40 Stage
18q (DCC) LOH 30 Μυική διήθηση (80%)
[14]
Οι παρατηρήσεις των γονιδιακών αλλαγών τροποποιούν την θεωρία
των αλλαγών πεδίου(field defect) που είχε προταθεί για την εξήγηση των
πολλαπλών πολυεστιακών και μεταχρονικών όγκων στην κύστη όπου το καρκινογόνο
ερέθισμα έχει σαν αποτέλεσμα την ανεξάρτητη μετατροπή κλώνων πολλών επιθηλιακών
κυττάρων. Αντίθετα είναι πολύ πιθανότερη η μονοκλωνική προέλευση,δηλαδή ότι οι
πολλαπλοί όγκοι σε ένα ασθενή προέρχονται από την μετατροπή ενός κυττάρου στο
οποίο επισυμβαίνει μία αρχική γενετική αλλαγή και του δίνει το πλεονέκτημα πολλαπλασιασμού
και το οποίο με ενδοεπιθηλιακή μετανάστευση ή διά της διασποράς με τα ούρα
δίδει την γένεση σε πολυεστιακούς όγκους.Η μοριακή ανάλυση των όγκων στην ίδια
κύστη έδειξε ότι μοιράζονται κοινές αρχικές γενετικές αλλαγές ενώ επακολουθούσες
γονιδιακές μεταβολές μπορούν να μετατρέψουν ένα μικρό ποσοστό αυτών των κυττάρων
σε πιο διηθητικό φαινότυπο. [14]
Πολλές εκατοντάδες χαμηλού διαφοροποίηση επιφανειακών όγκων
έχουν συμπεριληφθεί σε γενετικές μελέτες και μόνο διαγραφές του χρωμοσώματος 9
έχουν βρεθεί σε σημαντική συχνότητα(>50%) πράγμα που οδηγεί στο συμπέρασμα
ότι αυτό είναι ένα πρώιμο αρχικό συμβάν στην εμφάνιση της υπερπλασίας και την ανάπτυξη
του θηλώδους TCC.Ακολουθούσες μεταλλάξεις της ρ53,RB και άλλων γονιδιακών
θέσεων συνοδεύουν την πρόοδο των επιφανειακών αυτών όγκων σε μυική διήθηση. Αντίθετα
ο δρόμος της δυσπλασίας-CIS-διηθητικού καρκινώματος καρακτηρίζεται από πρώιμες
μεταλλάξεις της p53 και
μεγάλης αστάθειας του γονιδιώματος και σε αυτή την διαδικασία η απώλεια
ετεροζυγωτίας του χρωμοσώματος 9 επισυμβαίνει αργότερα,πιθανόν στην μετάβαση
από Τα/Τ1 ή Τ1/Τ2.Οι μέχρι σήμερα μελέτες προτείνουν ένα μοντέλο δύο δρόμων
μετάβασης στην πρόοδο στο TCC. [14]
[1] http://www-jcb.bio.auth.gr/mor_biol/celldivision/texts/celldivision26.htm
[2] http://www-jcb.bio.auth.gr/mor_biol/celldivision/frames/div11.htm
[3] http://www.apjohncancerinstitute.org/treatment-1.htm
[4] http://www.cancerhelp.org.uk/help/default.asp?page=96
[5] http://www-jcb.bio.auth.gr/mor_biol/membranes/frames/membranes6.htm
[6] http://www.lungcancer.gr/default.asp?catid=4041
[7] http://www.lilly.gr/default.asp?pid=148&la=1
[8] http://www.hygeia.gr/analekta/analekta.shtml
[9] http://www-jcb.bio.auth.gr/mor_biol/mitochondria/texts/mitochondria2.htm
[10] Karlson P., Gerok W., Groβ W., Κλινική Παθολογική Βιοχημεία, Iατρικές Εκδόσεις Λίτσας, 1993,
σελ.448-458
[11] http://www.biology4u.gr/november/researchnov.htm
[12] Thompson M.W.,Mcinnes R.R., Willerd H.F., Ιατρική Γενετική, Πανεπιστημιακές Εκδόσεις Κρήτης, Ηράκλειο
2001, σελ.435-436
[13] http://www.mednet.gr/pneumon/1202-1g.htm
[14] Γ.Μουτζούρης, Γενετική Καρκίνου Ουροδόχου Κύστεως :
Φαινοτυπικά Χαρακτηρηστικά-Κυτταρογενετική Εξέλιξη, Ουρολογική Κλινική Πολυκλινικής,
http://medlab.cs.uoi.gr/erga/urology/blcgen.Moutzouris%20(2).doc
4. Ογκογονίδια και ογκοκατασταλτικά γονίδια:
Μηχανισμοί δράσης τους και κύριοι εκπρόσωποι
Εμφάνιση του καρκίνου
H εμφάνιση του καρκίνου δεν προκαλείται από μια και μόνο αιτία.
Συνήθως απαιτούνται 5-7 διαφορετικές αιτίες για τη μετατροπή ενός κανονικού
κυττάρου σε καρκινικό. Πολλαπλές αλλαγές, μερικές από τις οποίες χρειάζονται
αρκετά χρόνια για να εμφανιστούν, είναι απαραίτητες για την έκφραση των
καρκινικών κυττάρων. Μια αρχική γενετική αλλαγή μπορεί να προέλθει από πολλούς
παράγοντες περιλαμβανομένων των ακτινοβολιών, διαφόρων χημικών ουσιών,
ενσωμάτωση γενώματος ρετροϊών, δημιουργία μεταλλάξεων κατά την αντιγραφή,
τυχαία επέκταση της γονιδιακής δόσης του DNA ή τυχαία απώλεια ενός τμήματος του
DNA. Οι αρχικές αυτές αλλαγές μπορεί να είναι κληρονομήσιμες. Επειδή τα κύτταρα
πρέπει να υποστούν πολυάριθμες γενετικές αλλαγές για να δημιουργηθεί ένας
στέρεος μεταστατικός όγκος, είναι εύλογο, ότι ένα κύτταρο με μεγαλύτερη
γενετική αστάθεια θα διασχίσει το εξελικτικό αυτό μονοπάτι, πολύ πιο γρήγορα
απ’ ότι ένα κύτταρο με κανονική γενετική σταθερότητα. Η γενετική αστάθεια
μπορεί να είναι κληρονομήσιμη. Έχει υπολογιστεί ότι το 5% των καρκίνων στον
άνθρωπο έχουν άμεση σχέση με την κληρονομικότητα.
Τα διάφορα πειραματικά δεδομένα που υπάρχουν μέχρι τώρα
υποστηρίζουν την εξής πορεία για την εμφάνιση ενός καρκίνου: Η έκθεση ενός
κυττάρου σε μια καρκινογόνο ουσία οδηγεί σε μεταβολές του DNA που μετατρέπουν
ένα πρωτο-ογκογονίδιο σε ογκογονίδιο. Οι αλλαγές αυτές μεταβάλλουν το κύτταρο,
προσφέροντας σ’ αυτό αναπτυξιακά πλεονεκτήματα έναντι των γειτονικών του
κυττάρων. Καθώς αυξάνεται (ως καλοήθης όγκος ή πολύποδας, αλλά πιο συχνά ως
ένας μη ορατός κυτταρικός κλώνος), μια ή περισσότερες αλλαγές ενεργοποιούν και
άλλα πρωτο-ογκογονίδια που μετατρέπονται σε ογκογονίδια. Οι πολλαπλές γενετικές
τροποποιήσεις επιτρέπουν στον κλώνο να “δραπετεύσει” από όλους τους ελέγχους που
ρυθμίζουν την κυτταρική διαίρεση ανάλογα με τις ανάγκες του συγκεκριμένου
ιστού. Ο κυτταρικός κλώνος όχι μόνο αυξάνει χωρίς κανένα έλεγχο, αλλά τα
κύτταρά του γίνονται μεταστατικά και αρχίζουν να εξαπλώνονται σε νέες θέσεις.
Από το σημείο αυτό, ο κυτταρικός κλώνος αναγνωρίζεται ως κακοήθης όγκος.[1]
Η εμφάνιση του καρκίνου, όπως αναφέρθηκε λίγο πιο πάνω,
περιλαμβάνει πολλά στάδια, ορισμένα από τα οποία επηρεάζονται από γενετικούς
και άλλα από περιβαλλοντικούς παράγοντες. Μεταβολή του περιβάλλοντος ή των
συνθηκών και των συνηθειών διαβίωσης μπορεί να μειώσει δραστικά τις πιθανότητες
εμφάνισης καρκίνου. Υπολογίζεται ότι το 80-90% των καρκίνων θα μπορούσε να έχει
αποφευχθεί. Παρόλα αυτά είναι πολύ δύσκολο να ταυτοποιηθούν οι ειδικοί περιβαλλοντικοί
παράγοντες κινδύνου ή να βρεθούν οι τρόποι δράσης τους. Πρέπει πάντως να
τονιστεί ότι για τους περισσότερους τύπους καρκίνου, η πιθανότητα εμφάνισης
τους, αυξάνεται 3-5 φορές με την αύξηση της ηλικίας.[1]
Για τη δημιουργία του καρκίνου, δύο ομάδες γονιδίων έχουν πολύ
μεγάλη σημασία:
α. τα ογκογονίδια, τα οποία παρακάμπτουν τα σημεία ελέγχου της
κυτταρικής διαίρεσης, προκαλώντας ανεξέλεγκτη κυτταρική αύξηση, και
β. τα ογκο-κατασταλτικά γονίδια, τα οποία παρεμποδίζουν την
ανεξέλεγκτη δράση των ογκογονιδίων.
Μέχρι τώρα έχουν ανακαλυφθεί 100 περίπου διαφορετικά
ογκογονίδια. Τα προϊόντα των γονιδίων αυτών συμμετέχουν σ’ έναν περιορισμένο
αριθμό κυτταρικών δραστηριοτήτων και λειτουργούν ως:
α. πρωτεϊνικές κινάσες (προάγουν την κυτταρική διαίρεση, και
ορισμένες τη μετάσταση),
β. πρωτεϊνικοί αυξητικοί παράγοντες,
γ. μεμβρανικοί υποδοχείς για ορμόνες ή αυξητικούς παράγοντες,
δ. G πρωτεΐνες,
ε. υποδοχείς στεροειδών ορμονών ή ορμονών του θυρεοειδούς αδένα,
και
ζ. πυρηνικές πρωτεΐνες, οι οποίες πιθανόν ρυθμίζουν την γονιδιακή
δράση. Το προϊόν του γονιδίου myc, π.χ., το οποίο είναι μια πυρηνική πρωτεΐνη,
έχει την ικανότητα να συνδέεται άμεσα με το DNA και να ελέγχει τη μετάβαση από
τη φάση G1 στη φάση S. Τουλάχιστον τα ογκογονίδια της ομάδος myc-fos-myb που
κωδικοποιούν για πυρηνικές πρωτεΐνες, είναι διαδεδομένα από τους ζυμομύκητες
μέχρι τον άνθρωπο. Η εκτεταμένη εξάπλωση των γονιδίων αυτών ενισχύει την άποψη
ότι ορισμένοι βασικοί μηχανισμοί που ελέγχουν την κυτταρική διαίρεση είναι
παρόμοιοι σε όλα τα ευκαρυωτικά κύτταρα.[1]
Τα ογκοκατασταλτικά γονίδια έχουν την ικανότητα να παρεμποδίζουν
την αύξηση των όγκων που προάγεται από τα ογκογονίδια. Τα ογκοκατασταλτικά
γονίδια πρέπει να υπάρχουν μια τουλάχιστον φορά στα αδελφά χρωματίδια για να
εκδηλώσουν τη δράση τους. Τα γονίδια της ομάδος αυτής, περιλαμβανομένων των
γονιδίων rb και p53, έχουν προσελκύσει το έντονο ενδιαφέρον ως πιθανά μέσα
ελέγχου του καρκίνου, αφού έχει αποδειχτεί ότι η εισαγωγή των γονιδίων αυτών
στο γένωμα καλλιεργούμενων καρκινικών κυττάρων κατέστειλε την αύξηση τους.
Το γονίδιο rb βρίσκεται στο ανθρώπινο χρωμόσωμα 13 και
κωδικοποιεί την πρωτεΐνη RB η οποία συνδεόμενη στο DNA καταστέλλει τη μεταγραφή
του fos και άλλων ρυθμιστικών γονιδίων που προάγουν την κυτταρική διαίρεση. Όταν
υπάρχει ένα κανονικό αντίγραφο του γονιδίου, τα άτομα συνήθως δεν εμφανίζουν
καρκίνο. Όμως, η χρωμοσωμική περιοχή που περιέχει το γονίδιο rb έχει μεγάλη
συχνότητα εμφάνισης ελλειμμάτων. Ένα τέτοιο έλλειμμα οδηγεί στην εμφάνιση του
κακοήθους γλοιώματος του αμφιβληστροειδούς ή ρετινοβλαστώματος, που αναπτύσσεται
συνήθως στα παιδιά. Έλλειψη του γονιδίου rb υπάρχει στους καρκίνους των οστών,
πνευμόνων και προστάτη ενηλίκων ατόμων. Πιστεύεται ότι η πρωτεΐνη Rb καθορίζει
την πρόοδο του κύκλου της κυτταρικής διαίρεσης κάτω από κανονικές συνθήκες.
Η πρωτεΐνη p53, το προϊόν του γονιδίου p53, συνδέεται στο DNA
και η έλλειψή της σχετίζεται με τον καρκίνο της κύστης, του εγκεφάλου, του
στήθους, του παχέος εντέρου, του οισοφάγου, του ήπατος και των πνευμόνων. Οι
άνθρωποι που κληρονομούν από τους γονείς τους ένα μόνο λειτουργικό αντίγραφο
του γονιδίου p53 έχουν γενετική προδιάθεση για την ανάπτυξη καρκίνου και
μάλιστα σε σχετικά μικρή ηλικία. Η κλίση των ατόμων αυτών για ανάπτυξη καρκίνου
ονομάζεται σύνδρομο Li-Fraumeni το οποίο είναι πολύ σπάνιο, όπως και το
ρετινοβλάστωμα. Η πρωτεΐνη p53 συνδέεται στο DNA και ενεργοποιεί ένα γονίδιο,
το προϊόν του οποίου, μια πρωτεΐνη ΜΒ 21 kD, συνδέεται στον MPF και
παρεμποδίζει τη δράση του. Έτσι, το κύτταρο δεν περνά από τη φάση G1 στη φάση
S. Η πρωτεΐνη p53 είναι ένας μεταγραφικός παράγοντας ο οποίος πιθανόν ελέγχει
την έκφραση πολλών γονιδίων και δρα ως φρένο κινδύνου κατά την κυτταρική
διαίρεση κυττάρων που έχουν υποστεί γενετικές βλάβες. [1]
Κοινό γνώρισμα των καρκινωμάτων είναι οι διαταραχές στον έλεγχο του κυτταρικού κύκλου. Τα μετασχηματισμένα καρκινικά κύτταρα έχουν σήματα που προάγουν τον κυτταρικό κύκλο ανεξάρτητα του μιτογόνου παράγοντα που φυσιολογικά χρειάζονται για την ανάπτυξη. Σε πολλά καρκινώματα η λειτουργία αυτή γίνεται διά μέσω της ενεργοποίησης της έκφρασης και/ή της δραστηριοποίησης των κυρίαρχων ογκογονιδίων όπως το c-myc ή E2F [2].
Εικόνα 1 Έναρξη απόπτωσης
Σχηματική
παράσταση της αλληλεπίδρασης του Βcl-2 και του bax,
Η απορρύθμιση του κυτταρικού κύκλου δυνατόν να επιτελείται δια μέσου εξάλειψης ή μη δραστηριοποίησης των κατασταλτικών γονιδίων, τα οποία φυσιολογικά ελέγχουν τον κυτταρικό κύκλο. Τα πιο σημαντικά γονίδια είναι το p53 το οποίο παρουσιάζει μεταλλάξεις στο ήμισυ όλων των καρκινωμάτων και το κατασταλτικό γονίδιο του ρετινοδλαστώματος pRb του οποίου η φυσιολογική λειτουργία είναι να ελέγχει τη δραστηριότητα του E2F. Η δραστηριοποίηση των ογκογονιδίων και η μη δραστηριοποίηση μερικών κατασταλτικοί γονιδίων, αυξάνουν δραματικά την απόπτωση [3,·4, 5, 6], Η δράση των ογκοπρωτεϊνών Μyc και Ε2F υλοποιείται με το σχηματισμό ετεροδιμερών Myc/Max κάτω από συνθήκες διακοπής του κυτταρικού κύκλου, όπως είναι η αποστέρηση αυξητικών παραγόντων και μπορεί να προκαλέσει προαγωγή της απόπτωσης. Το σύμπλοκο Max/Max από την άλλη μεριά καταστέλλει τη λειτουργία του c-myc. Επομένως η σχέση του συμπλόκου c-myc / Max προς το σύμπλοκο Max/Max είναι καθοριστική για τις συνέπειες της ενεργοποίησης του c-myc. Επίσης η ταυτόχρονη υπερέκφραση του πρωτοογκογονιδίου blc-2 αναστέλλει την ικανότητα του αυξημένου c-myc να προάγει την απόπτωση [7].
Εικόνα 2 Δίκτυο της p53 [8]
Το γονίδιο p53
κωδικοποιεί μια πυρηνική πρωτεΐνη που ρυθμίζει τη μεταγραφή γονιδίων που είναι
υπεύθυνα για την επιδιόρθωση του DΝΑ, την κυτταρική διαίρεση και την απόπτωση. Ο φυσικός τύπος της
πρωτεΐνης p53 ελέγχει
τον κυτταρικό πολλαπλασιασμό σε καταστάσεις που προκαλούνται δομικές αλλοιώσεις
του DΝΑ όπως η
χημειοθεραπεία και η ακτινοβολία που χρησιμοποιούνται στη θεραπεία του καρκίνου
προκαλώντας άμεσα ή έμμεσα βλάβη του κυτταρικού DΝΑ. Αυτό επιτυγχάνεται με υπερέκφραση
της φυσικής πρωτεΐνης p53
η οποία προκαλεί στάση του κυτταρικού κύκλου ή απόπτωση. Πρόσφατα αναφέρθηκε
ότι η μεταγραφική ενεργοποίηση του p53 είναι σημαντική για την απόπτωση και επιτυγχάνεται μέσω της
αυξημένης παραγωγής της πρωτεΐνης του γονιδίου p21. Επί εκτεταμένης και μη
επιδιορθώσιμης βλάβης της δομής του DΝΑ η πρωτεΐνη p53
οδηγεί το κύτταρο σε απόπτωση προστατεύοντας έτσι το κυτταρικό DΝΑ από συσσώρευση και
μετάδοση μεταλλάξεων στα θυγατρικά κύτταρα [9].
Η αδρανοποίηση του p53 έχει άμεση σχέση με την αδυναμία του να προκαλέσει στάση του
κυτταρικού κύκλου στη φάση G1
ή απόπτωση. Η απόπτωση παρουσιάζει ενδιαφέρον στην αντοχή πολλών καρκινωμάτων
(πνεύμονας, παχύ έντερο, ουροδόχος κύστη και προστάτης) στη χημειοθεραπεία.
Ταυτοποίηση της παρουσίας
ογκογονιδίων σε νεοπλασίες του ανθρώπου
Η παρουσία κυτταρικών ογκογονιδίων αποδείχθηκε όταν η κυτταρική
σειρά ινοβλαστών ποντικού NH/3T3 μολύνθηκε με DNA από κακοήθη κύτταρα
νεοπλασίας ανθρώπου. Τα μολυσμένα ινοβλαστικά κύτταρα NH/3T3 απέκτησαν
ιδιότητες κακοηθών κυττάρων, όπως, δυνατότητα πρόκλησης κακοήθους νεοπλασίας
όταν εμφυτευθούν σε ανοσοκατεσταλμένο ποντίκι και απώλεια της αναστολής της
κυτταρικής ανάπτυξης λόγω επαφής των κυττάρων (loss ofcontact-inhibition). Η
μέθοδος της μόλυνσης κυτταρικών σειρών με DNA προερχόμενο από κακοήθεις
νεοπλασίες επέτρεψε την ταυτοποίηση κυτταρικών ογκογονιδίων σε 20% των
ανθρώπινων νεοπλασιών [10].
Λειτουργίες πρωτο-ογκογονιδίων: Για την κατανόηση της
δυνατότητας εξαλλαγής των κυττάρων λόγω της δράσης των ογκογονιδίων είναι
απαραίτητο να περιγραφούν οι βασικές αρχές της λειτουργίας των
πρωτο-ογκογονιδίων και η δράση τους κατά τη φυσιολογική κυτταρική ζωή. Η
διέγερση του κυττάρου και η είσοδός του στον κυτταρικό κύκλο σε φάση κυτταρικού
πολλαπλασιασμού προκαλείται συχνά από παράγοντες ανάπτυξης (αυξητικούς
παράγοντες) οι οποίοι συνδέονται με υποδοχείς στην κυτταρική μεμβράνη. Το σήμα
που δέχονται οι υποδοχείς αυτοί από τους αυξητικούς παράγοντες μεταβιβάζεται
στο κυτταρόπλασμα και κατόπιν στον πυρήνα μέσω κυτταροπλασματικών μεταβιβαστών
όπως, π.χ. Ca++. Κατά τη διάρκεια αυτής της διαδικασίας τα προϊόντα
των πρωτο-ογκογονιδίων παίζουν σημαντικό ρόλο. Τα προϊόντα των
πρωτο-ογκογονιδίων ταξινομούνται ανάλογα με το ρόλο τους στη διαδικασία
μεταβίβασης του σήματος. Κατά συνέπεια μπορεί να είναι:
α) Αυξητικοί παράγοντες (Growth Factors). Φαίνεται ότι η
απορρύθμιση της λειτουργίας των αυξητικών παραγόντων είναι δευτερογενές
φαινόμενο, δηλαδή δεν οφείλεται σε πρωτογενή βλάβη στο επίπεδο του DNA των
γονιδίων που κωδικοποιούν για αυξητικούς παράγοντες αλλά οφείλεται σε
ενεργοποίηση άλλων ογκογονιδίων τα οποία επιδρούν στη ρύθμιση της έκφρασης των
γονιδίων των αυξητικών παραγόντων.
β) Πρωτεϊνοκινάσες (ένζυμα φωσφορυλίωσης). Πρόκειται για ένζυμα
που καταλύουν τη μεταφορά φωσφορικών ομάδων σε υπόλοιπα τυροσίνης που
βρίσκονται σε πρωτεΐνες και εντοπίζονται στην κυτταρική μεμβράνη ή στο
κυτταρόπλασμα. Οι κινάσες της τυροσίνης που βρίσκονται στην κυτταρική μεμβράνη
έχουν λειτουργία υποδοχέα για αυξητικούς παράγοντες. Σε παθολογικό επίπεδο, η
αυξημένη δραστηριότητα (υπερέκφραση) των υποδοχέων συνδέεται περισσότερο με υπερέκφραση
φυσιολογικών υποδοχέων παρά με υπερέκφραση παθολογικών υποδοχέων (εξαίρεση
αποτελεί το γονίδιο erb-B2 και σε μερικές περιπτώσεις το γονίδιο του EGFR).
γ) GTP–συνδέουσες πρωτεΐνες. Σ’ αυτή την κατηγορία ανήκει η
οικογένεια ras. Οι πρωτεΐνες που κωδικοποιούνται από πρωτο-ογκογονίδια της
οικογένειας ras έχουν σημαντική ομολογία αμινοξέων με τις G-πρωτεΐνες που
εντοπίζονται στο εσωτερικό της κυτταρικής μεμβράνης και συμμετέχουν στη
μεταβίβαση του σήματος από το εξωτερικό περιβάλλον στο κυτταρόπλασμα. Όταν η πρωτεΐνη
ras-p21 κωδικοποιείται από γονίδιο ras με μετάλλαξη, τότε παραμένει διαρκώς σε
ενεργοποιημένη κατάσταση, γεγονός που οδηγεί σε ενίσχυση του σήματος που έχει
προκαλέσει την ενεργοποίησή της. Οι μεταλλάξεις του ras είναι οι πιο συχνά
απαντώμενες ανωμαλίες ογκογονιδίων στις ανθρώπινες κακοήθεις νεοπλασίες αλλά
παρατηρούνται και σε καλοήθεις νεοπλασίες, γεγονός που υπαινίσσεται πρώιμη
συμμετοχή του ογκογονιδίου ras στην ογκογένεση.
δ) Πυρηνικές πρωτεΐνες. Τα προϊόντα των πρωτο-ογκογονιδίων myc,
fos, και myb είναι πυρηνικές πρωτεΐνες και συμμετέχουν στη ρύθμιση του
κυτταρικού πολλαπλασιασμού. Έχουν μικρό χρόνο ημιζωής και συνδέονται με ειδικές
DNA–αλληλουχίες. Οι περισσότερες θεωρούνται ως μεταγραφικοί παράγοντες που
ενέχονται στο διπλασιασμό του DNA και την κυτταρική διαφοροποίηση. Η οικογένεια
c-myc θεωρείται ότι συμμετέχει στην παθογένεση κακοηθών νεοπλασμάτων κυρίως
μέσω γονιδιακής ενίσχυσης. Εν τούτοις, έχει παρατηρηθεί υπερέκφραση του c-myc
και χωρίς γονιδιακή αλλοίωση και θεωρείται ότι σε αυτές τις περιπτώσεις
αντανακλά περισσότερο τον αυξημένο κυταρικό πολλαπλασιασμό. Με αυτή την έννοια,
η υπερέκφραση του c-myc θα ήταν περισσότερο αποτέλεσμα παρά αιτία ογκογένεσης [10].
Ενεργοποίηση
πρωτο-ογκογονιδίων
Για τη μετατροπή ενός πρωτο-ογκογονιδίου σε ογκογονίδιο αρκεί η
ενεργοποίηση του ενός μόνο αλληλόμορφου, δηλαδή, τα ογκογονίδια συμπεριφέρονται
με κυρίαρχο χαρακτήρα στο κυτταρικό επίπεδο. Τα πρωτο-ογκογονίδια μπορούν να
μετατραπούν σε ογκογονίδια μέσω σημειακών μεταλλάξεων, χρωμοσωμικών
διαμεταθέσεων ή/και γονιδιακής ενίσχυσης. Σημειακές μεταλλάξεις ενεργοποιούν τα
πρωτο-ογκογονίδια ras. Οι χρωμοσωμικές διαμεταθέσεις μπορούν να ενεργοποιήσουν
πρωτο-ογκογονίδια είτε με την τοποθέτησή τους κοντά σε ισχυρούς
προαγωγείς/ενισχυτές της μεταγραφής, είτε με συγχώνευση του γονιδίου και δημιουργία
νέων γενετικών αλληλουχιών που κωδικοποιούν χιμαιρικές πρωτεΐνες. Η γονιδιακή ενίσχυση
είναι αναδιπλασιασμός του γενετικού υλικού συγκεκριμένης περιοχής, για
παράδειγμα, ενίσχυση του C-erb B πρωτο-ογκογονιδίου παρατηρείται συχνά στο
καρκίνωμα του μαστού.
Επιλεκτική ενεργοποίηση πρωτο-ογκογονιδίων ανάλογα με τον ιστό
και τον τύπο της νεοπλασίας (tumor and tissue specificity of oncogene
activation). Το εύρος της συμμετοχής των ογκογονιδίων στις νεοπλασίες αντανακλά
εν μέρει τη διαφορετική έκφραση των αντίστοιχων πρωτο-ογκογονιδίων στα
αντίστοιχα φυσιολογικά κύτταρα από τα οποία προέρχεται η νεοπλασία.[10]
Ογκοκατασταλτικά γονίδια: Μία κακοήθης νεοπλασία μπορεί να
αναπτυχθεί επίσης μέσω αδρανοποίησης γονιδίων που καταστέλλουν τον κυτταρικό
πολλαπλασιασμό. Αυτά τα γονίδια ονομάζονται ογκοκατασταλτικά γονίδια (αρχικά
αντι-ογκογονίδια) και έχουν τη δυνατότητα να ελέγχουν αρνητικά την κυτταρική
ανάπτυξη και τον πολλαπλασιασμό και κατ’ επέκταση να καταστέλλουν το σχηματισμό
όγκων. Θεωρείται ότι τα μεταλλαγμένα ογκοκατασταλτικά γονίδια συμπεριφέρονται
με υπολειπόμενο χαρακτήρα στο κυτταρικό επίπεδο. Κύτταρα στα οποία έχει
αδρανοποιηθεί μόνο το ένα αλληλόμορφο δεν εκφράζουν νεοπλασματικό φαινότυπο.
Όταν αδρανοποιηθεί και το δεύτερο αλληλόμορφο τότε παύει ο αρνητικός έλεγχος
στο κυτταρικό επίπεδο και ευνοείται η δημιουργία νεοπλασίας. Δηλαδή, για την
απώλεια της ογκοκατασταλτικής δράσης ενός γονιδίου είναι απαραίτητη η απώλεια ή
απενεργοποίηση και των δύο αλληλόμορφων. Χαρακτηριστικός αντιπρόσωπος αυτής της
κατηγορίας είναι το γονίδιο του ρετινοβλαστώματος (Rb gene). Επίσης το γονίδιο
p53 είναι ογκοκατασταλτικό, αλλά το μεταλλαγμένο p53 συμπεριφέρεται με κυρίαρχο
χαρακτήρα στο κυτταρικό επίπεδο[11]
Συνεργική δράση
ογκογονιδίων και ογκοκατασταλτικών γονιδίων στην παθογένεση των νεοπλασιών.
Ο υπέρμετρος πολλαπλασιασμός θα μπορεί να είναι αποτέλεσμα είτε
ενεργοποίησης ογκογονιδίων, είτε απενεργοποίησης ογκοκατασταλτικών γονιδίων .
Σύμφωνα με τις τρέχουσες απόψεις, η ενεργοποίηση ενός μόνο ογκογονιδίου είναι
επαρκής μόνο προσωρινά για την επαγωγή ανώμαλης κυτταρικής ανάπτυξης. Για την
ανάδυση ενός αυτόνομου κυτταρικού κλώνου απαιτείται συμμετοχή πολλών
ενεργοποιημένων ογκογονιδίων και αδρανοποιημένων ογκοκατασταλτικών γονιδίων,
όπως επίσης και συμμετοχή άλλων κυτταρικών κυκλωμάτων σχετικών με τη ρύθμιση
του κυτταρικού κύκλου και του κυτταρικού θανάτου. Επιπλέον, η ανάδυση ενός
αυτόνομου νεοπλασματικού κλώνου σχετίζεται με διαδικασίες επιλογής ανθεκτικών κυτταρικών
κλώνων. Κλασικό παράδειγμα συνεργικής δράσης ογκογονιδίων και ογκοκατασταλτικών
γονιδίων στην πολυπαραγοντική και πολυσταδιακή διαδικασία της ογκογένεσης
αποτελεί το καρκίνωμα του παχέος εντέρου, για τη μοριακή βιολογία του οποίου
γίνεται λόγος ειδικότερα στο επόμενο κεφάλαιο [10, 11]
Ογκογένεση και απόπτωση
Η απόπτωση είναι ένας τύπος κυτταρικού θανάτου που παίζει
σημαντικό ρόλο στην ανάπτυξη και τη διαφοροποίηση των φυσιολογικών ιστών. Είναι
ο σπουδαιότερος μηχανισμός κυτταρικού θανάτου στους ανθρώπους. Ρυθμίζεται από
φυσιολογικά ερεθίσματα και παρατηρείται σε πολλά είδη και ιστούς. Θεωρείται ως
μία μορφή προγραμματισμένου κυτταρικού θανάτου με ειδικά μορφολογικά και
βιοχημικά χαρακτηριστικά και διαφέρει από την άλλη μορφή κυτταρικού θανάτου που
ονομάζεται νέκρωση [12]
Τα μορφολογικά χαρακτηριστικά της απόπτωσης είναι: συρρίκνωση
του κυττάρου χωρίς διάσπαση της κυτταρικής μεμβράνης, πύκνωση της πυρηνικής
χρωματίνης, εξοίδηση του ενδοπλασματικού δικτύου, κατάτμηση του πυρήνα και
τελικά κατάτμηση του κυττάρου σε σωματίδια που περικλείονται από κυτταρική
μεμβράση σχηματίζοντας κυστίδια και ονομάζονται αποπτωτικά σωμάτια. Η ταχεία
πρόσληψη του κυττάρου από φαγοκύτταρα προλαμβάνει τη φλεγμονώδη διήθηση. Από
βιοχημική άποψη, η απόπτωση είναι διαδικασία που απαιτεί κατανάλωση ενέργειας
με τη διέγερση μεταβολικών οδών, μεταγραφή γονιδίων και πρωτεϊνοσύνθεση. Ένας
σημαντικός μηχανισμός είναι η ενεργοποίηση ενδονουκλεασών που προκαλούν
κατάτμηση του DNA σε σταθερά τμήματα. Σε αντίθεση, η κλασική νέκρωση
παρουσιάζει εξοίδηση του κυττάρου και τυχαία κατάτμηση του DNA [12, 13, 14].
Η απόπτωση συνδέεται με την ενεργοποίηση γονιδιακών προγραμμάτων
στα οποία συμμετέχουν επαγωγείς και καταστολείς της διαδικασίας. Επαγωγή ή
καταστολή προκαλείται ως απάντηση σε εξωκυττάρια ή ενδοκυττάρια σήματα όπως
κυτταροκίνες, ορμόνες, πρωτεΐνες ιών, φυσικοί και χημικοί παράγοντες. Σημαντικό
για την κατανόηση των διαφορών απόπτωσης/νέκρωσης είναι το γεγονός ότι η
απόπτωση αποτελεί μια γονιδιακά κατευθυνόμενη διαδικασία που οδηγεί στην κυτταρική
αυτοκτονία, ενώ η νέκρωση είναι ένας τυχαίος κυτταρικός θάνατος που προέρχεται
από την αποτυχία των προσαρμοστικών γενετικών και μεταβολικών απαντήσεων του
κυττάρου σε βλαπτικούς παράγοντες (κυρίως ανοξία και οξειδωτικές ουσίες).
Βέβαια και στη νέκρωση παρατηρούνται καθορισμένες γενετικά απαντήσεις, όπως η
έκφραση heat-shock πρωτεϊνών και αντιοξειδωτικών προϊόντων (όπως
μεταλλοθειονίνες και αιμο-οξυγενάση) που επάγεται από οξειδωτικούς παράγοντες.
Όμως, στην απόπτωση οι μηχανισμοί ενεργοποίησης γονιδιακών προγραμμάτων
εξαρτώνται από το κύτταρο-στόχος, ενώ στη νέκρωση οι κυτταρικοί μηχανισμοί
είναι κοινοί και ανεξάρτητοι από το κύτταρο-στόχος [14].
Εν τούτοις, τα σύνορα απόπτωσης/νέκρωσης δεν είναι εντελώς σαφή.
Για παράδειγμα, η επαγόμενη από τον παράγοντα νέκρωσης όγκων (TNF) κυτταροτοξικότητα
μπορεί να οδηγήσει σε απόπτωση ή νέκρωση. Επίσης, στο μοντέλο της ισχαιμικής
νέκρωσης του ήπατος αρχικά παρατηρείται κεντρολοβιακή νέκρωση και αργότερα
απόπτωση περιφερικά των λοβίων. Θα ήταν λοιπόν δυνατό να υποτεθεί ότι σε
ορισμένες περιπτώσεις κάποια διεγερτικά σήματα μπορούν να επάγουν κατ’ αρχήν
απαντήσεις κοινές για τους δύο τύπους κυτταρικού θανάτου αλλά η συνύπαρξη άλλων
παραμέτρων όπως χρόνος, εντόπιση, ένταση διέγερσης, καθορίζουν την επέλευση
νέκρωσης ή απόπτωσης [12,14].
Διάφορα ερεθίσματα μπορούν να επάγουν την απόπτωση, ακόμα και
στο ίδιο κύτταρο. Στα κύτταρα του θύμου αδένα η απόπτωση ενεργοποιείται από τα
γλυκοκορτικοειδή, που αποτελούν φυσιολογικό ερέθισμα, αλλά και από χαμηλής
δόσης ακτινοβολία ή από έκθεση σε συγκεκριμένα δηλητήρια. Όταν πρόκειται για
εξωγενή βλαπτικά ερεθίσματα, για να είναι δυνατό να ενεργοποιηθεί το
«αποπτωτικό πρόγραμμα» πρέπει η βλάβη που προκαλούν να μην είναι ιδιαίτερα
σοβαρή. Τα θυμοκύτταρα που θερμαίνονται στους 43οC πεθαίνουν με
νέκρωση αν παραμείνουν σ’ αυτή τη θερμοκρασία, ενώ αν επιστραφούν σύντομα στους
37οC, πεθαίνουν με απόπτωση. Τελεολογικά, έχει υποτεθεί ότι μπορεί
να είναι αρκετά επικίνδυνο για τα λεμφοκύτταρα να προσπαθήσουν να επιδιορθώσουν
συγκεκριμένες βλάβες, καθώς η ελλατωματική επιδιόρθωση θα οδηγούσε δυνητικά σε
λευχαιμία ή ενεργοποίηση των αυτοάνοσων μηχανισμών. Αντ’ αυτού, ενεργοποιούν
τον αποπτωτικό μηχανισμό, διαπράττοντας κατά κάποιον τρόπο ένα είδος
“αλτρουϊστικής αυτοκτονίας”. Η αυτοκτονία των σωματικών κυττάρων εξασφαλίζει
την επιβίωση των γαμετών, ένα κεντρικό σενάριο στη βιολογία, που ανευρίσκεται
και σε εντελώς διαφορετικά συστήματα, όπως η κοινωνία των μελισσών [14].
Η μελέτη της απόπτωσης οδηγεί και σε μια άλλη κρίσιμη ερώτηση.
Πότε αρχίζει και πότε τελειώνει; Μία ενδιαφέρουσα παρατήρηση από το μοντέλο των
επιθηλιακών κυττάρων δείχνει ότι μετά την απόπτωση συμβαίνουν επιπλέον
εκφυλιστικές αλλοιώσεις, οι οποίες έχουν χαρακτηριστικά νέκρωσης. Άρα, είναι
πιθανό σε μερικές περιπτώσεις η απόπτωση να μην αποτελεί την «τελική λύση» στην
υπόθεση της φυσιολογικής ανανέωσης των κυττάρων αυτών. Από την άλλη πλευρά, δεν
υπάρχουν ασφαλείς δείκτες για την επισήμανση της έναρξης της απόπτωσης. Στο
μοντέλο της επαγόμενης από τα γλυκοκορτικοειδή απόπτωσης των θυμοκυττάρων ως
πρώιμες ενδείξεις απόπτωσης θεωρούνται η μειωμένη πρόσληψη γλυκόζης και η
σύνθεση RNA και πρωτεϊνών [12].
Στη ρύθμιση της απόπτωσης συμμετέχουν ορισμένα ογκογονίδια, όπως το bcl-2 και το myc, καθώς και το ογκοκατασταλτικό γονίδιο p53. Το bcl-2 θεωρείται ότι αναστέλλει την απόπτωση και επηρεάζεται αρνητικά από την έκφραση του p53. Το ογκογονίδιο c-myc ενέχεται στη ρύθμιση του κυτταρικού πολλαπλασιασμού και της απόπτωσης και κατά συνέπεια μπορεί να επηρεάζει την κακοήθη εξαλλαγή μέσω μιας από τις δύο ανταγωνιστικές αυτές οδούς. Η δράση του εξαρτάται από την παρουσία αυξητικών παραγόντων. Συγκεκριμένα, μη-ενεργοποίηση του c-myc απουσία αυξητικών παραγόντων οδηγεί σε αναστολή του πολλαπλασιασμού, ενεργοποίησή του παρουσία αυξητικών παραγόντων προάγει τον πολλαπλασιασμό και ενεργοποίησή του απουσία αυξητικών παραγόντων οδηγεί σε απόπτωση, με ενδιάμεσα στάδια μεταξύ αυτών των διαδικασιών.[15]?
Εικόνα 3 Δομές από Bcl-2 οικογενειακά
μέλη.
Επίσης σημαντικό ρόλο στην απόπτωση παίζει ο μεμβρανικός
υποδοχέας APO-1/fas(CD95), ο οποίος ανήκει στην ίδια κατηγορία με τους
υποδοχείς για νευρωνικούς αυξητικούς παράγοντες (NGFR) και τους υποδοχείς για
τον παράγοντα νέκρωσης όγκων (TNFR). Ο υποδοχέας APO-1/fas επάγει την απόπτωση
σε λεμφικά κύτταρα όταν αυτά βρεθούν σε περιβάλλον με ειδικά αντισώματα
εναντίον των ανοσοσφαιρινών. Άλλα μόρια που μπορούν να επάγουν απόπτωση είναι
λιπόφιλα μόρια (γλυκοκορτικοειδή, ρετινοειδή), τα οποία αντιδρούν με πυρηνικούς
υποδοχείς και επάγουν τη μεταγραφή αποπτωτικών γονιδίων [12].
Σημαντική για την απόπτωση είναι και η λειτουργία του
ανοσοποιητικού συστήματος. Τα κυτταροτοξικά Τ-λεμφοκύτταρα και τα κύτταρα
“φυσικοί φονείς” (Natural Killers-NK) μπορούν να καταστρέφουν νεοπλασματικά
κύτταρα προκαλώντας απόπτωση. Εκτός από το ανοσοποιητικό σύστημα, απόπτωση στα
κακοήθη νεοπλασματικά κύτταρα επάγουν φυσικοί παράγοντες (γ-ακτινοβολία,
υπεριώδης ακτινοβολία) και χημικοί-φαρμακευτικοί παράγοντες (σισπλατίνη, ετοποσίδη,
αλκυλιωτικοί παράγοντες) [12].
Αν ανακεφαλαιώσουμε τη σχέση απόπτωσης/ογκογένεσης θα πρέπει να
την τοποθετήσουμε στο επίπεδο της απορρύθμισης των φυσιολογικών λειτουργιών των
επαγωγέων (c-myc, wild type p53, bax) και αναστολέων της απόπτωσης (bcl-2,
bclx). Επειδή όμως τα c-myc και wt-p53 εκτός από επαγωγείς απόπτωσης είναι και
επαγωγείς κυτταρικού πολλαπλασιασμού (το πρώτο) και ογκοκατασταλτικό γονίδιο
(το δεύτερο), η σχέση απόπτωσης/ογκογένεσης συνδέεται άμεσα με τον κυτταρικό
πολλαπλασιασμό και τις λειτουργίες καταστολής του κακοήθους φαινότυπου.
Ένας από τους λόγους που το κύτταρο επιλέγει τον
προγραμματισμένο κυτταρικό θάνατο είναι η παρουσία βλαβών του γενετικού του
υλικού σε μια προσπάθεια να διακόψει τη διαιώνισή τους. Όταν η απόπτωση
αποτυγχάνει να φτάσει ως διαδικασία στην ολοκλήρωσή της οι βλάβες αυτές
παραμένουν και πιθανόν να αναπαράγονται στους απογόνους αν το κύτταρο διατηρεί
την ικανότητα να πολλαπλασιάζεται. Επίσης, όταν ο μηχανισμός της απόπτωσης
αναστέλλεται από κάποιους παράγοντες οδηγεί σε επιμήκυνση της επιβίωσης των
κυττάρων με αποτέλεσμα τη μεγαλύτερη επιδεκτικότητα σε επιπρόσθετες αλλοιώσεις
πρωτο-ογκογονιδίων ή ογκοκατασταλτικών γονιδίων. Έτσι, η αναστολή της απόπτωσης
συμμετέχει στην ογκογένεση επιτρέποντας την επιβίωση κττάρων με γονιδιακές
αλλοιώσεις και αυξάνοντας την πιθανότητα συσσώρευσης νέων γονιδιακών αλλοιώσεων
[13,14].
Κυτταρικός κύκλος και
ογκογένεση
Πρόσφατες μελέτες ανέδειξαν το σημαντικό ρόλο που κατέχουν στην
ογκογένεση ορισμένες πρωτεΐνες που συμμετέχουν στον κυτταρικό κύκλο και έιναι
οι κυκλίνες (cyclines) και οι κυκλινοεξαρτώμενες κινάσες (cyclin-dependent
kinases/CDKs). Πολλές ενδείξεις προέρχονται από τις κυκλίνες D. Αυτές δρουν στη
φάση G1 του κυτταρικού κύκλου όπου τα κύτταρα αποφασίζουν αν θα αναδιπλασιάσουν
το DNA τους για να προχωρήσουν στη μίτωση. Οι D κυκλίνες δρουν ως αισθητήρια
όργανα των αυξητικών παραγόντων και μαζί μ’ αυτούς βοηθούν το κύτταρο να
προχωρήσει στον αναδιπλασιασμό του DNA. Μόλις το κύτταρο εισέλθει σε αυτή τη
φάση δεν έχει πλέον ανάγκη τους αυξητικούς παράγοντες, ενώ οι κυκλίνες
συνεχίζουν να επιδρούν, γεγονός που συνεχίζεται και κατά τη μίτωση. Ένα από τα
κύρια χαρακτηριστικά των νεοπλασματικών κυττάρων είναι η κυτταρική διαίρεση
χωρίς διέγερση από εξωτερικούς παράγοντες. Άρα είναι λογικό να υποτεθεί ότι η
υπερδιέγερση κυκλινών D, προκαλώντας ανεξέλεγκτη κυτταρική διαίρεση χωρίς
ανάγκη από αυξητικούς παράγοντες, θα έχει σημαντικό ρόλο στην ογκογένεση.
Παράδειγμα η διαμετάθεση 11:14 σε Β-λεμφώματα του μανδύα του βλαστικού κέντρου
των δευτερογενών λεμφοζιδίων ενεργοποιεί την κυκλίνη D1, η οποία θεωρείται
πλέον ταυτόσημη με το ογκογονίδιο bcl–1.
Bcl-2 Οικογένεια
|
gene |
proposed name |
products (proteins) |
species |
function |
binding partners |
other features |
3D |
Motif Structure |
KO |
tramscriptional
regulators |
regulation signals |
locus |
|
BCL2 |
human, mouse, rat, LThamster, P.p., P.m., bovine, deer, cat, chicken |
Bcl-2,
Bax
, Bcl-xL, Bcl-xS,
Hrk,
Bad,
Bak,
BAG-1,
c-raf,
R-ras,
c-ras,
calcineurin
Abeta, Bid,
Nip1,
Nip2, Nip3, Bim,
beclin,
BI-1,
Rad9,
Btf,
Bis,
Noxa,
Bmf,
Pin1,
FKBP38,
HAX1,
HSpin,
ITM2B(s),
Nur77,
PP1a,
calcineurin,
Cdc2 |
BH4/P?/BH3/BH1/BH2/TM |
Aiolos,
B-Myb,
c-Myb,
v-Myb,
Brn-3a/(-),
AP1,
CREB,
p53,
E2F1,
c-Myc,
Rb,
AP2,
Bcl-6,
NF-kB,
NF-AT,
PAX8,
RAR,
RXR, GR,
WT1,
PU.1,
Pi1,
STATs,
SRF,
GATA-1,
GLI1, SP1/ER(1,
2),
FLI-1,
E2F1,
Mitf,
HOX11 |
IL1b, IL2, IL3, IL4, IL5(N), IL6, IL7, IL8, IL10, IL15, IL18, IL21, IL24, AH, G-CSF(-), GM-CSF, EGF, VEGF, IFNb, PEDF, bFGF, TNF, Fas, OX40, BAFF, TACI, CD3/CD28, PMA, BCR, IGFBP2, SST, substance P, PTHrP, TRH, CD31, CD69, CD90, LTD4, LPS, Hp, Sd, Mt, Ang, bombesin, neurotrophins, prolactin, FLT3L, SHH, irrrad, ischemic stress adaptation, progesterone, O stress, antioxidant, GSH, UVB, NO, 3-NP, OA, PTDS, DTDS, curcumin, As2O3, melarsoprol, gluc.redct., PTK, PP2A, TGFa, TGFb(N), COX2, DEX, estrogen, RA, D3, MEQ, IGF-I, Am80, T3, IKKb, PI3K, Akt, PTEN, Src, JNK(?), avb5, E-Cad., p38, MKP1, Par4, Bit1, AES, TLE1, hemopoietins, Ask1, Cdk1, Cdk6, v-cyclin, CDC2, AUF1, Nef, JAK2, JAK3, NGF, PLCg2, PKCd, GH, Plakoglobin, minocycline, tat, finasteride, caffeine |
|||||||
|
|
|
|
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|
|||
|
BCL2L1 |
human, mouse, rat, pig, chicken, sheep, bovine, rabbit, dog, zebrafish(bclx, blp1) |
Bax,
Bcl-xS,
Bcl-xL,
Hrk,
Bik,
Bid,
Bad,
Bak,
Bcl-xL,
Bcl-2,
Bim,
Apaf-1,
BI-1,
Btf,
Aven, Aiolos,
Bpr,
Diva/Bcl-B,
Bcl-G,
Bmf,
FKBP38,
HSpin,
Noxa,
p53,
Rad9,
SphK2,
Siva1,
chelerythrine |
highly expressed in
erythroid |
GATA-1,GATA-4,
Ets2,
PU.1,
NF-kB,
CREB,
Bcl-6,
STAT3(-),
STAT5A&B,
STAT6,
Brn-3a,
EWS,
PAX3,
Pax5,
Smad1,
p53,
Bcl6,
AFX,
TEL,
c-Myc,
Csx |
TCR/CD3/28/PMA, CTLA4/B7, BCR, EGF, PEDF, GM-CSF(-), M-CSF, TGFa/(-), TGFb, Bmp2, Epo, thrombopoietin, IL1, IL3, IL4, IL6, IL8, IL10, IL10/12, IL15, IL18, IL21, TNFa, OX40, BAFF, TACI, 4-1BB/4-1BBL, HGF, SCF, DEX, MUC1, COX2, estrogen, progesterone, CD40, CD31, hypoxia, H2O2, NO, LPS, Ec, Hp, Ma, Sm, g-irrad., UVA, DEX, GADD153, ECM, EGFR, Taxol, p38, Akt/PI3K, PKCb, estramustine, 3-NP, MPTP, Jnk, c-Abl, DDR1, HTLVs, tax, HCV core, HBx, ALK, NIK, MKK4, ERKs, finasteride, TCDD |
|||||||
|
|
|
|
BH4/BH3/TM |
|
|
|||||||
|
|
|
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|
||||
|
|
|
|
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|
|||
|
|
|
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|||||
|
BAX |
human, mouse, rat, bovine, sheep, cat, dog, deer, frog, zebrafish |
Bax,
Bcl-2,
Bcl-xL,
Bid,
Bcl-B,
E1B
19K, Bif-1,
Ku70,
14-3-3sigma,
14-3-3q,
NS5A,
Asc |
function similar to Bak, Ub, cleaved by calpain, highest levels in hematopoietic
cells |
BH4/BH3/BH1/BH2/TM |
p53(no res.), p73, p63, AIRE, Brn-3a, Gfi-1, myc(-), PLZF, Sp1, Ahr, HMGs, RARb,NF-kB, Brn3a |
IL1b, IL6(-), IL8, IL10, IL24, TNFa, BAFF, TACI, TCR, PMA, LPS, b-glucan, Hp, Ma, Mt, Sd, ischemia, NO, MEQ, G-CSF, SCF, SST, TRH, prolactin, ATP, SSI-1, DEX, TGFb, COX2, JAK3,PKR, FRAP, LATS1, PAHs, Expi, H2O2, ROS, MG132, DHA, lactacystin, g-irrad, hypoxia, YAP, TCDD, cisplatin, KA, calpain |
||||||
|
rat |
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|
|||||
|
|
|
BH4/BH3/BH1/(BH2)/TM |
|
|
|
|
||||||
|
human |
|
|
|
|
|
|
|
|
||||
|
|
induce |
Bcl-2, Bcl-xL, Baxalpha |
|
|
BH4/BH3 |
|
|
|
|
|||
|
kappa |
|
|
|
|
BH3/BH1/BH2/TM |
|
|
|
|
|||
|
BAK1 |
function similar to Bax, Ub, highest levels in epithelium, preB |
BH4/BH3/BH1/BH2/TM |
estrogen,
progesterone,
IFNg,
IL1a,
RANTES,
PMA,
LPS,
EV71,
g-irrad.,
Raf,
IL6(-),
DEX,
UV,
camptothecin,
butyric
acid |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
MCL1 |
human, mouse, rat, sheep, pig, dog, chicken, zebrafish (a, b), carp |
highest level in myeloid, lymphocytes, APCs, Macrophage-inducible gene, casp3 |
|
BH4/BH3/BH1/BH2/TM |
IL3,
IL6,
IL7,
TNFa,
IFNg,
GM-CSF,
SCF,
PDGF,
Subst.P,
HGF,
VEGF,
Thrombin,
LMP1,
E1A, PI3K,
DNA
damage, UVB, PMA,
LPS, CSBG,
Ct,
Lm,
Ma,
Mt,
Ng,
Ye,
HHV8,
UV,
Epo,
gonadotropins,
estrogen,
myocardial
infarction, cAMP,
Akt,
p38,
Jak,
PI3K,
IEX1S,
Jnk,
Nef,
flavopiridol,
DIM,
ER,
AdV,
TCDD |
|||||||
|
|
Mcl-1sDTM,Mcl-1s |
induce |
|
|
|
BH4/BH3 |
|
|
|
|
||
|
BCL2A1 |
highest level in myeloid, preB, APCs, lymphocytes |
|
BH4/BH3/BH1/BH2/TM |
GM-CSF, G-CSF, LPS, b-glucan, Ld, Lm, Ma, Mt, Ng, Tg, HHV8, CD40, CD31, TNFa, IL1b/TNFa, IFNa, TCR/CD3, 4-1BB, PMA, BCR, TGFb, PLCg2, D3, DEX, IL10, irrad, Am80, T3, butyric acid, DIM |
||||||||
|
BCL2L2 |
important for spermatogenesis (1, 2), highest level in brain |
BH4/BH3/BH1/BH2/TM |
|
|||||||||
|
mtd* |
BOK |
highest level in bone marrow (but not in
ovary/testis) |
|
BH4/BH3/BH1/BH2/TM |
|
|
||||||
|
|
|
rat |
|
|
|
BH4/BH31/BH2/TM |
|
|
|
|
||
|
BCL2L10 |
ovary/testis-specific in mouse adults |
|
BH4/BH3/BH1/BH2/TM |
|
|
|||||||
|
|
BCLG |
Bcl-xL,
Bcl-2 |
testis-specific |
|
?/BH3/(BH1)/BH2 |
|
|
|
||||
|
|
BH2 |
|
|
|
|
|||||||
|
BCL2L13 |
Bcl-Rambo/MIL1 |
|
|
|
BH4/BH3/BH1/BH2/Ex/TM |
|
|
|
||||
|
BCL2L12 |
|
highest
level in preB, bone marrow, lymphocytes |
|
BH2 |
|
|
||||||
|
BPR variant 1 |
|
|
|
|
|
|
|
|
||||
|
LOC148280 |
|
|
|
BH4/BH3/BH1/BH2 |
|
|
|
|||||
|
NR-13 |
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|||||
|
xRII |
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|||
|
xR1 |
|
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
||
|
|
inhibit |
|
BH4/BH3/BH1/BH2/TM |
1 |
|
|
3 |
|||||
|
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
UV |
42E-43A |
||||
|
buffy |
|
Buffy |
inhibit |
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
2 48A-E |
|
|
bhp1 |
|
|
|
|
BH4?/3?/BH1/BH2/TM |
|
|
|
|
|||
|
HRK |
BH3-only subfamily, RGCs, 4-cell embryo |
BH3/TM |
NGF,
b-amyloid,
IL3, Fas,
T3,
progesterone,
methylation,
KA,
JNK,
calcineurin,
TCDD,
KCl |
|||||||||
|
bik/nbk/blk |
BIK |
BH3-only subfamily |
|
P/BH3/TM |
TGFb, BCR,
CD27,
TNFa,
CD40,
SCF,
Nef,
E1A,
RA,
Estrogen,
LPS,
hypoxia-ischemia,
TCDD |
|||||||
|
BNIP1 |
NIP1/BNIP1 |
|
Sec20, no BH3 |
|
BH3?//TM |
|
|
|||||
|
nip3 |
BNIP3 |
|
BH3?/TM |
1 |
||||||||
|
bnip3l |
BNIP3L |
promote |
Bcl-2, E1B19K |
BH3
subfamily(?) |
|
BH3?/TM |
1 |
|||||
|
|
|
sNix |
|
|
|
|
|
|
|
|
||
|
bnip3h |
|
human |
promote |
|
|
|
|
|
|
|
|
|
|
BID |
cleaved by casp-8, -3, -2, cathepsins, calpain, granzyme B; Ub; myristoylated |
Bcl-xL-like with BH3, highest level in APCs,
NK & their precursors |
IL1b,
TNFa,
Fas,
LPS,
Subst.P,
hypoxia,
camptothecin,
lactacystin;
Hsp90,
MG132,
TCDD |
|||||||||
|
BAD |
Bad,
Bad S |
Bcl-xL,
Bcl-2,
Bcl-w(-),
glucokinase,
Mcl1,
Ced-9,
BHRF1(-),
14-3-3 |
P/BH3 |
IL2,
IL3,
Estrogen,
SDF1,
Subst.P,
TRH,
GLP2,
LPS,
Ca,
Mt,
RSKs,
PKBalpha,
TIP30,
FTIs,
Akt/PI3K,
PKA,
PAK1,
Pak5,
PKCtheta,
p70S6K,
MEKs,
ERKs,
Jnk,
CKII,
GSK3,,
Cdc2,
calcineurin,
PP1a,
PP2a,
p75NTR,
Nef,
Ub,
US3,
finasteride,
camptothecin,
butyric
acid, nicotine,
hypoxia |
||||||||
|
BCL2L11 |
human(S,L,EL, AD, gamma), mouse(S,L,EL), rat (S,M,L), pig(partial) |
BH3-only subfamily, caspase substrate |
dynein-BD/BH3/TM |
IL2,,IL3, GM-CSF, TCR, TGFb, LPS, Lm, NGF, IGF-I, MIP3, detachment, b1, EGFR, ERKs, JNK, PKC, PKA, calcineurin, IL10, CD40, UV, estrogen, DEX, KA, Ub, cAMP, FK506, CsA, KCl |
||||||||
|
BMF |
BH3-only subfamily |
|
DLC/BH3 |
|
|
|||||||
|
puma/bbc3 |
BBC3 |
BH3-only subfamily |
|
IFNa,
IFNg,
DEX,
serum,
IGF1,
IGFBP2,
EGF,
flagellin,
g-irrad, UV,
ER
stress, VSV,
p300 |
||||||||
|
PMAIP1 |
|
(BH3/)BH3, highest in B, NK, APCs |
IFNs,
TNFa,
IL2,
IL15,
irrad,
UV,
MeDNA,
flagellin,
PMA,
RA,
heat
shock, HBx,
E1A,
estrogen,
cantharidin,
Blimp1 |
|||||||||
|
|
BH3 |
1 |
5 |
|||||||||
|
cip-1 |
|
C.elegans |
|
|
|
BH3 |
|
|
|
|
||
|
|
BHRF1 |
Bik, Bok, Rab acceptor 1, HAX1 |
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
||||
|
|
LMH-5W/A179L |
|
|
|
(BH4?)/BH3/BH1/BH2/TM |
|
|
|
|
|||
|
|
A9 |
inhibit |
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
||
|
|
ORF16 |
inhibit |
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
||
|
|
vBcl-2 |
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|||||
|
|
|
M11 |
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|||
|
|
|
|
inhibit |
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|
|
|
|
FPV039 |
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|
|
|
|
ORF81 |
|
|
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
|
|
|
inhibit |
|
|
BH4/BH3/BH1/BH2/TM |
|
|
|
|
||||
|
E1B |
|
E1B 19K |
inhibit |
NIP1-3, Nbk, Hrk, Bax, Btf, Ced4, Casp8, |
|
|
BH4?/BH3/BH1/BH2 |
|
|
|
|
|
|
Incorrectly reported |
|
BRCC2, BRAG-1, BmP109, p193, APE1820, ITM2B(s), MAP-1, Rad9, Spike, SphK2, SP1610 |
|
|
|
belongs to other
families |
|
no homo. to BHs |
|
|
|
|
[15]
Περιοχές της Bcl-2 Οικογένειας
|
|
|
|
|
BH4 |
a1 |
|
|
non-cons |
|
Vance,
Chang,
Cheng,
Clem,
Fujita,
Fang,
Srivastava,
Wang,
Kirsch
, Rodi, |
|
BH3 |
a2 |
Boyd,
Chittenden,
Han.,
Zha,Simonian(1, 2),
Diaz,
Ink,
Ottilie(1,
2),
Simonen,
Kelekar,
Elangovan,
Cosulich,
Holinger,
Nechushtan,
Polster,
Moreau |
|
BH1-BH2 |
|
|
|
TM |
|
[15]
Στον κυτταρικό κύκλο όμως συμμετέχουν και οι αναστολείς των
κυκλινοεξαρτώμενων κινασών (cyclin-dependent kinase inhibitors). Ένας γενικός
αναστολέας των CDKs είναι το παράγωγο του WAF1/CIP1 γονιδίου, η πρωτεΐνη
p21WAF1/CIP1. [16]
Η p21WAF1 είναι ισχυρός και συγχρόνως αναστρέψιμος αναστολέας
της προόδου του κυτταρικού κύκλου στις φάσεις G1 και G2 και ενεργοποιείται ως
ανταπόκριση σε βλάβη του DNA. Μη αναστρέψιμη αναστολή του κυτταρικού κύκλου
στις φάσεις G1 και G2 οδηγεί σε απόπτωση [16].
Η υπερέκφραση, λοιπόν, του γονιδίου WAF1 καταστέλλει την
ανάπτυξη, γεγονός που συμφωνεί με τη λειτουργία του πρωτεϊνικού παραγώγου του
p21WAF1 ως αναστολέα των κυκλινοεξαρτώμενων κινασών. Αποτελεί επίσης ένα από τα
γονίδια-στόχους του p53 προκειμένου αυτό να ασκήσει τη δράση του στην καταστολή
της κυτταρικής ανάπτυξης.
Βλέπουμε ότι η σχέση μεταξύ ογκογένεσης, απόπτωσης και
κυτταρικού κύκλου διαπλέκεται ακόμα περισσότερο. Έλλειψη της p21WAF1 προκαλεί
αδυναμία αναστολής του κυτταρικού κύκλου όταν υπάρχουν βλάβες στο DNA βοηθώντας
στην ογκογένεση, ενώ όταν η p21WAF1 λειτουργεί σωστά προκαλεί διακοπή του
κυτταρικού κύκλου που θα οδηγήσει στην έναρξη της απόπτωσης αποτρέποντας την
πιθανότητα ογκογένεσης [16].
Επιπλέον, το ογκοκατασταλτικό γονίδιο p53 συμμετέχει στη διακοπή
του κυτταρικού κύκλου ενεργοποιώντας τη μεταγραφή του WAF1.
[1] http://www-jcb.bio.auth.gr/mor_biol/celldivision/texts/celldivision29.htm
[2] DeGregori J, Kowalik T, Nevins JR: Cellular targets
for actuation by the E2F1 transcription factor include DNA synthesis and
Gl/S-regulatory genes. Mol Cell Biol 15:4215-4524, 1995.
[3] Askew DS, Ashrnun
RA, Simmons BQ Cleveland JL: Constitutive c-myc expression in an IL-3 dependent
myeloid cell line suppresses cell cycle
arrest and accelerates apoptosis. Oncogene 6:1915-1922, 1991.
[4] Packham G, Cleveland JL: c-myc and apoptosis. Biochim Biophys Acta 1242:
11-28, 1995.
[5] Evan Gl,
Wyllie AH, Gilbert CS, Littlewood TD, Land H, Brooks M, et al: Induction of apoptosis
in fibroblasts by c-myc protein. Cell 69:119-128, 1992.
[6] Green DR, Bissonnette RP, Cotter TG: Apoptosis and cancer. In: Important
Advances in Oncology, De Vita VT, Hellman S and Rosenberg SA, eds, 1994, p.
37-52.
[7] Fanidi A, Harrington FA, Evan Gl: Cooperative interaction between c-myc
and bcl-2 proto-oncogenes. Nature
359:554-556, 1992.
[8] http://www.gene-regulation.com/pub/databases/transpath/6.0/doc/doc/maps/p53.html
[9] Canrnan CE, Gilmer TM, Couts SB,
[10] Bishop JM.
Molecular themes in oncogenesis. Cell 1991;64:235-248.
[11] Marshall
CJ. Tumor suppressor genes. Cell 1991;64:313-326.
[12] Cohen J.
Apoptosis. Immunology today 1993;14:126-130.
[13] Mikulski
SM. Pathgenesis of cancer in view of mutually opposing apoptotic and
anti-apoptotic growth signals. Int J Oncology 1994;4:1257-1263.
[14] Apoptosis
and cancer by DR Green, RP Bissonnette and TG Cotter in, Important Advances in
Oncology by VT DeVita, S Hellman and SA Rosenberg, ed. Lippincot Co,
Philadelphia 1994, ch 3, p:37-51.
[15] http://www-personal.umich.edu/~ino/List/2342.htm
[16] Harper JW,
Adami GR, Wei N, Keyomarsi K, Elledge SJ. The p21 cdk-interacting protein Cip-1
is a potent inhibitor of G1 cyclin dependent kinases. Cell
1993;75:805-16.
5. Ιοί που εμπλέκονται στην καρκινογένεση
Πολλοί φυσικοί και τεχνητοί παράγοντες ενεργοποιούν ή προάγουν
την ανάπτυξη του καρκίνου. Οι παράγοντες αυτοί ονομάζονται καρκινογόνα και
είναι κυρίως διάφορα χημικά προϊόντα ή διάφοροι τύποι ακτινοβολιών που
προκαλούν αλλαγές στο DNA ή μεταβάλλοντας τη δράση των βιολογικών μορίων και
την τιμή διαφόρων βιολογικών διεργασιών. Καρκινογόνο δράση έχουν επίσης και
αρκετοί ιοί.
Οι ρετροϊοί και οι DNA ογκοϊοί συνδέονται άμεσα με τη δημιουργία
καρκίνου, και το 15-20% των περιπτώσεων καρκίνου σχετίζεται άμεσα με τις ομάδες
αυτές. Το γένωμα των ρετροϊών ενσωματώνεται στο γένωμα του κυττάρου-ξενιστή με
τη μορφή DNA αντιγράφου. Όλα τα θηλαστικά έχουν ενσωματωμένο στο γένωμά τους το
γενετικό υλικό ρετροϊών. Σε σπάνιες περιπτώσεις, οι ρετροϊοί έχουν γονίδια που
μπορούν να επάγουν μη ελεγχόμενες κυτταρικές διαιρέσεις και να συμβάλλουν στην
εμφάνιση των υπολοίπων χαρακτηριστικών των καρκινικών κυττάρων.
Συνήθως, οι DNA ογκοϊοί δεν ενσωματώνονται στο γένωμα των
κανονικών κυττάρων, αλλά μόνο όταν ενωθούν με καρκινικά κύτταρα. Οι
περισσότεροι DNA ογκοϊοί είναι μέλη των πιο γνωστών ομάδων ιών που προσβάλλουν
τα διάφορα θηλαστικά και τον άνθρωπο, χωρίς φυσικά να προκαλούν καρκίνο. [1]
Οι ιοί συνδέθηκαν από παλιά με την αιτιολογία της καρκινογένεσης,
καθώς υπάρχουν αρκετοί ιοί που προκαλούν καρκίνους σε ζώα. Σε ορισμένες
περιπτώσεις υπάρχουν βάσιμες ενδείξεις ότι ιοί προκαλούν ορισμένους τύπους
καρκίνου στον άνθρωπο (ηπατίτιδα Β', Epstein-Bar, ιός μολυσματικής
μονοπυρήνωσης). Οι ρετροϊοί αντιπροσωπεύουν τη γνωστότερη κατηγορία ιών που προκαλούν
καρκίνο. Ο ρετροϊός HTLV-1 είναι γνωστό ότι προκαλεί σε ενήλικες λευχαιμία
τύπου Τ, ενώ ένας άλλος ρετροϊός, ο HIV, προκαλεί το AIDS, που εξασθενεί το ανοσοποιητικό
σύστημα και αυξάνει την ευαισθησία στον καρκίνο και διάφορες μολύνσεις.
Όλοι οι ογκογόνοι ιοί μεταμορφώνουν τα κύτταρα σε καρκινικά,
μέσω ενσωμάτωσης του νουκλεϊνικού τους οξέος στο DNA των χρωμοσωμάτων του
ξενιστή (αυτή η ενσωμάτωση είναι μόνιμη. Ο προϊός δεν αποσχίζεται όπως ο
προφάγος). Οι DNA ογκογόνοι ιοί, ενσωματώνουν το DNA τους άμεσα. Οι ρετροϊοί
πρέπει πρώτα να συνθέσουν DNA από το RNA με την αντίστροφη μεταγραφάση. Η
μόνιμη αυτή ενσωμάτωση τον DNA του ιού σε ένα χρωμόσωμα του ξενιστή δίνει το
έναυσμα για την έκφραση ογκογονιδίων που υπάρχουν στο DNA του ιού αλλά και σε
φυσιολογικά κύτταρα πολλών ειδών. Σε μερικές περιπτώσεις ο ογκογόνος ιός δεν
έχει ογκογονίδια, αλλά μεταμορφώνει το κύτταρο σε καρκινικό, προκαλώντας την
έκφραση ή αυξάνοντας την έκφραση ενός ή περισσότερων κυτταρικών ογκογονιδίων.[2]
Οι πρώτες ενδείξεις συµµετοχής ιών στην ογκογενετική διαδικασία
προήλθαν πριν από έναν αιώνα από τον Rous στον οποίο και απονεµήθηκε το βραβείο
Νobel το 1968. Το 1944 ο Avery έδειξε σε βακτηρίδια ότι η γενετική πληροφορία
περιέχεται στο DNA, κάτι που οδήγησε στην ιδέα ότι οι καρκίνοι µπορεί να
προέρχονται από µεταλλάξεις στο γενετικό υλικό των κυττάρων. Το 1963, οι Vogt
και Dulbecco καλλιέργησαν φυσιολογικά κύτταρα in vitro τα οποία µετά από
µόλυνση µε τον πολυόµα ιό απέκτησαν πολλά από τα χαρακτηριστικά των καρκινικών
κυττάρων. Το γεγονός αυτό, γνωστό ως µεταµόρφωση, αποτέλεσε κλειδί στην µελέτη
του προκαλούµενου από ιούς καρκίνου.
Σήµερα υπάρχει αποδεδειγµένη συµµετοχή ιογενών λοιµώξεων στην
αιτιολογία ενός στους επτά καρκίνους που συµβαίνουν παγκοσµίως µε τον ιό του
θηλώµατος του ανθρώπου (HPV) και τους ηπατοτρόπους ιούς (HBV,HCV) να ευθύνονται
για πάνω από 80% αυτών των περιπτώσεων. Οι ιοί που µπορούν να συµβάλλουν στην
δηµιουργία όγκων στον άνθρωπο µπορεί να είναι είτε DNA είτε RNA ιοί. [3]
Τα περισσότερα είδη ζώων καθώς και ο άνθρωπος είναι φυσικοί
ξενιστές των αντίστοιχων για κάθε είδος ρετροϊών. Η µετάδοση συµβαίνει µε τρεις
τρόπους: οριζόντια, συγγενώς και γενετικώς. Στον οριζόντιο τρόπο µετάδοσης, ο
ιός διαδίδεται µε άµεση επαφή ή διαµέσου της αναπνευστικής οδού µεταξύ
µολυσµένων και ευαίσθητων ζώων. Η συγγενής µετάδοση είναι κάθετος τρόπος
µετάδοσης κατά τον οποίο ο ιός µεταδίδεται από την µητέρα στον απόγονο είτε µε
ενδοµήτρια µόλυνση είτε µέσω του µητρικού γάλακτος. Τέλος, η γενετική µετάδοση
αποτελεί επίσης κάθετο τρόπο µετάδοσης όπου ο ιός κληρονοµείται στους απογόνους
ως αντίγραφο του DNA του ιού (προϊός) το οποίο είναι ενσωµατωµένο στο χρωµόσωµα
των κυττάρων του σπέρµατος του πατρικού ζώου.[3]
Το γένωµα του ρετροϊού περιέχει βασικά 4 γονίδια:
1. Το γονίδιο gag κωδικοποιεί για τα πρωτεϊνικά αντιγόνα του εσωτερικού
περιβλήµατος του ιού.
2. Το γονίδιο pol κωδικοποιεί την αντίστροφη µεταγραφάση.
3. Το γονίδιο env κωδικοποιεί για την γλυκοπρωτεΐνη του ελύτρου
του ιού.
4. Το γονίδιο onc κωδικοποιεί για µια πρωτεΐνη που ευθύνεται για
την εξαλλαγή των κυττάρων.
Οι RNA ογκογόνοι ιοί διακρίνονται ανάλογα µε το ογκογενετικό
τους δυναµικό σε δύο οµάδες. Η πρώτη περιλαµβάνει αυτούς που επάγουν αµέσως
καρκινικό φαινότυπο σε όλα τα κύτταρα τα οποία µολύνουν (transducing viruses).
Οι ιοί αυτής της κατηγορίας ενσωµατώνουν στο γονιδίωµά τους φυσιολογικά
κυτταρικά γονίδια (πρωτο-ογκογονίδια) τα οποία µετατρέπουν σε ενεργοποιηµένα
ογκογονίδια µέσα στο κύτταρο του ξενιστή. Η δεύτερη οµάδα περιλαµβάνει τους
βραδέως εξαλάσσοντες (slowly transforming) ρετροϊούς οι οποίοι προκαλούν
καρκινική εξαλλαγή πολύ αργότερα από τη λοίµωξη και µετά από µεσολάβηση
επιπρόσθετων αλλοιώσεων στο DNA του ξενιστή. Στην περίπτωση αυτή το RNA του ιού
ενσωµατώνεται κοντά σε κυτταρικά πρωτο-ογκογονίδια οδηγώντας σε αυξηµένη
µεταγραφή τους.[3]
Οι ρετροϊοί που προκαλούν όγκους στα ζώα διακρίνονται σε ιούς
που προκαλούν σάρκωµα και σε αυτούς που προκαλούν λευχαιµία. Όσον αφορά στον
άνθρωπο, έχουν περιγραφεί τέσσερις τύποι ρετροϊών και όλοι τους µολύνουν κατά
προτίµηση τα Τ-λεµφοκύτταρα. Οι ιοί αυτοί είναι οι ΗΤLV-I, HTLV-II και HIV-I,
HIV-II. Οι ιοί ΗΤLV-I και HTLV-II έχουν αποµονωθεί από λεµφικές κακοήθειες. Ο
συχνότερος είναι ο ΗΤLV-I ο οποίος προκαλεί λεµφώµατα των Τ-κυττάρων κυρίως
στην νότια Ιαπωνία και την Καραϊβική.
Οι ιοί HIV-I και HIV-II πρωτοεµφανίστηκαν στην κεντρική Αφρική και προκαλούν το σύνδροµο της επίκτητης ανοσολογικής ανεπάρκειας (AIDS). Το σύνδροµο αυτό χαρακτηρίζεται από αναστροφή των σχέσεων Τ4/Τ8 των Τ-λεµφοκυττάρων, σάρκωµα Kaposi (Εικόνα 1 ) και ευκαιριακές µολύνσεις µε συνηθέστερη την πνευµονία από pneumonocystis carinii. Άλλες µολύνσεις περιλαµβάνουν λοιµώξεις από έρπητα, κυτταροµεγαλοϊό, τοξόπλασµα, κρυπτοσπορίδια και µυκοβακτηρίδια.[3]
Εικόνα 1 Αυτός ο ασθενής από τον HIV που παρουσιάζεται
με ενδοστοματικό Kaposi σάρκωμα
από το σκληρό ουρανίσκο δευτερογενές ως προς τη μόλυνση του AIDS. Περίπου 7.5-10 % των ασθενών του AIDS επιδικνύουν
σημάδια με στοματικό σάρκωμα Kaposi,
και μπορούν να κυμανθούν
στην εμφάνιση από μικρές ασυμτωματικές αυξήσεις που είναι βαθύ πορφυρό - κόκκινο στο χρώμα,
σε μεγαλύτερες οζώδεις
αυξήσεις [4,5]
Το λέμφωμα είναι μια κακοήθης νεοπλασματική νόσος του λεμφικού συστήματος, που με την σειρά του αποτελεί μέρος του ανοσοποιητικού συστήματος. Περιλαμβάνει τα λεμφαγγεία, που διακλαδώνονται στον οργανισμό όπως τα αιμοφόρα αγγεία, καθώς και μικρά οργανίδια που διατάσσονται κατά μήκος αυτού του δικτύου και ονομάζονται λεμφαδένες. Μέσα στα λεμφαγγεία κυκλοφορεί η λέμφος, ένα άχρωμο υδαρές υγρό που περιέχει κύτταρα της άμυνας του οργανισμού, τα λεμφοκύτταρα. Οι δε λεμφαδένες σχηματίζουν ομάδες στις μασχάλες, στον τράχηλο, στο θώρακα, στη βουβωνική χώρα και στην κοιλία. Τέλος, μέρος του λεμφικού συστήματος είναι και ο σπλήνας, ο θύμος αδένας, οι αμυγδαλές και ο μυελός των οστών. Το λέμφωμα παρουσιάζεται όταν, για κάποιο άγνωστο λόγο, ένα λεμφοκύτταρο υποστεί καρκινική εξαλλαγή και αρχίσει να πολλαπλασιάζεται ανεξέλεγκτα. Αυτό μπορεί να συμβεί σε έναν λεμφαδένα ή οπουδήποτε αλλού απαντάται λεμφικός ιστός, δηλαδή σχεδόν παντού, και με αφετηρία αυτό το σημείο να επεκταθεί σε οποιοδήποτε σημείο του σώματος. Δυστυχώς τα αίτια της νόσου παραμένουν αδιευκρίνιστα. Ωστόσο, οι επιστήμονες έχουν καταφέρει να εντοπίσουν ορισμένες καταστάσεις που προδιαθέτουν σε κάποιες μορφές λεμφώματος. Έτσι, γνωρίζουμε ότι άνθρωποι σε ανοσοκαταστολή όπως πχ οι πάσχοντες από AIDS, διατρέχουν αυξημένες πιθανότητες να προσβληθούν. Επίσης ορισμένοι ιοί, όπως ο HTLV-1, (Εικόνα 2 ) έχουν συσχετιστεί με τη νόσο αλλά και πιο κοινοί ιοί όπως ο Epstein-Barr που προκαλεί λοιμώδη μονοπυρήνωση σχετίζονται με μια σπανιότερη μορφή λεμφώματος, το λέμφωμα Burkitt, που απαντάται κυρίως σε χώρες της Αφρικής.[6]
Εικόνα 2 [7]
Εικόνα 3 [8]
Οι DNA ογκογόνοι ιοί έχουν την ικανότητα να ενσωµατώνουν
περιοχές του γονιδιώµατός τους στο γενετικό υλικό των ξενιστών. Αν και σε
ορισµένες περιπτώσεις ολόκληρο το γένωµα του ιού είναι ενσωµατωµένο στο
χρωµόσωµα του κυττάρου του ξενιστή, εν τούτοις στις περισσότερες περιπτώσεις
παρευρίσκεται µόνο ένα µικρό τµήµα του DNA του ιού. Οι ιικές πρωτεΐνες εκφράζονται
στα προσβεβληµένα κύτταρα τροποποιώντας την συµπεριφορά γονιδίων που
εµπλέκονται στην καρκινογένεση. Με τέτοιο µηχανισµό προκύπτει απενεργοποίηση
του ογκοκατασταλτικού γονιδίου p53 στο ηπατοκυτταρικό καρκίνωµα, µετά από
ενσωµάτωση του γονιδίου ORF X του ιού της ηπατίτιδας Β, στα ηπατοκύτταρα των
πασχόντων από την νόσο.
Οι DNA ογκογόνοι ιοί του ανθρώπου περιλαµβάνουν τους
ηπατοτρόπους ιούς (ΗΒV,HCV), τον Epstein-Barr (EBV), (Εικόνα 4 ) τον ιό του
απλού έρπητα και τους ιούς του ανθρώπινου θηλώµατος (HPV).[3]
HSV-4 Epstein-Barr virus, λοιμώδης μονοπυρήνωση (αρχική
μόλυνση), περιλαμβάνει τους όγκους Β λεμφοκυττάρων (το λέμφωμα Burkitt,
ανοσοβλαστικά λεμφώματα) συν το ρινοφαρυγγικό καρκίνωμα, μερικοί όγκοι Τ
λεμφοκυττάρων.
HHV-8 KSHV, σάρκωμα Kaposi, όγκοι που συμπεριλαμβάνουν το Kaposi
και κάποια λεμφώματα B λεμφοκυττάρων. [9]
Επίσης σε αυτήν την κατηγορία περιλαµβάνονται οι αδενοϊοί και οι πολυόµα ιοί οι οποίοι είναι ογκογόνοι in vitro και in vivo αλλά δεν έχουν συνδεθεί µε όγκους που απαντούν στη φύση.
Εικόνα 4 [10]
Οι HBV και HCV προκαλούν πρωτοπαθή ηπατοκυτταρικό καρκίνο. Αυτός
ο καρκίνος είναι κοινός στην Αφρική και την Άπω Ανατολή. Οι περιοχές υψηλής
συχνότητας συµπίπτουν µε εκείνες στις οποίες υπάρχει υψηλή στάθµη των φορέων
του ιού. Τα καρκινικά κύτταρα του ήπατος περιέχουν ενσωµατωµένα στα χρωµοσώµατά
τους DNA της ηπατίτιδας.
Ο ιός EBV ευθύνεται για το λέµφωµα Burkitt και το ρινοφαρυγγικό
καρκίνωµα. Ο ιός του απλού έρπητα ενέχεται στην παθογένεια του καρκίνου του
τραχήλου της µήτρας ενώ οι HPV ευθύνονται για µια πληθώρα καρκίνων µεταξύ των
οποίων περιλαµβάνονται ο καρκίνος του τραχήλου της µήτρας, ο δερµατικός
καρκίνος κ.ά. Οι ανωτέρω ιοί αναπτύσσονται διεξοδικά στα ακόλουθα κεφάλαια. [3]
Είναι ένας μικρός ιός της οικογένειας Papovαviridae, με δίκλωνο DNA. Το γένωμα του HPV έχει μέγεθος 7,9kb και περιλαμβάνει 8 ανοικτά πλαίσια ανάγνωσης (open reeding frames - ORFs), που κωδικοποιούν 6 πρώιμες (early - E) τις E1, E2, E4, E5, E6, E7, και 2 όψιμες (late - L) τις L1 και L2 πρωτεΐνες. Ο διαχωρισμός σε πρώιμα και όψιμα ιικά γονίδια γίνεται με βάση τον χρόνο εμφάνισής τους κατά τη φυσική εξέλιξη της HPV λοίμωξης. Μια μεγάλη ρυθμιστική περιοχή (long control region - LCR) περιέχει προαγωγικές και ενισχυτικές ακολουθίες και τα γονίδια αντιγραφής του ιού. Ο HPV προσβάλλει αποκλειστικά επιθηλιακά κύτταρα και για την ολοκλήρωση του κύκλου της ζωής του εξαρτάται απόλυτα από τη διαδικασία κερατινοποίησης του επιθηλίου. Τα κύτταρα της βασικής στιβάδας του επιθηλίου του τραχήλου της μήτρας μεταναστεύουν προοδευτικά προς υπερκείμενα στρώματα, και αντικαθίστανται διαρκώς με νεότερα κύτταρα που προέρχονται από τη βασική στιβάδα. Η επιφανειακή στιβάδα του επιθηλίου περιλαμβάνει κύτταρα απύρηνα, πλήρως κερατινοποιημένα, τα οποία τελικά αποφολιδώνονται. Τα σωματίδια του ιού συνδέονται και μολύνουν τα κύτταρα της βασικής στιβάδας του επιθηλίου στη ζώνη μετάπτωσης του τραχήλου.[11]
Εικόνα 5 Επίθεση:
ο HPV πολιορκεί επιθηλιακά
κύτταρα [12]
Αυτό μπορεί να έχει σχέση με κάποια τοπική βλάβη ή μικροτραυματισμούς που διαταράσσουν την ακεραιότητα του επιθηλίου και επιτρέπουν τη διείσδυση του ιού. Οι πρωτεΐνες L1 και L2 του καψιδίου του ιού πιστεύεται ότι διαμορφώνουν συγκεκριμένη δομή, η οποία είναι ικανή να αντιδρά με υποδοχείς της επιφάνειας του κυττάρου, διευκολύνοντας την είσοδο του DNA του ιού μέσα στο κύτταρο. Η έκφραση των γονιδίων του ιού σχετίζεται με τη διαδικασία ωρίμανσης και αποφολίδωσης των κυττάρων του επιθηλίου (πίνακας 1).
Οι πρωτεΐνες Ε1 και Ε2 εκφράζονται στα κύτταρα της παραβασικής στιβάδας, όπου είναι απαραίτητες για τη διατήρηση της σταθερότητας του ιϊκού επισώματος (αυτόνομο, αυτο-αντιγραφόμενο εξω-χρωμοσωμικό ιικό DNA) και την έναρξη της αναπαραγωγής του ιού. Η Ε2 λειτουργεί ως ρυθμιστής της παραγωγής των πρωτεϊνών Ε6 και Ε7 του ιού. Οι πρωτεΐνες αυτές παρεμβαίνουν στους ρυθμιστικούς μηχανισμούς του κυττάρου-ξενιστή και επαναδραστηριοποιούν τη σύνθεση του DNA και των κυτταρικών πρωτεϊνών, με σκοπό να διευκολύνουν την αντιγραφή του DNA του ιού. Οι πρωτεΐνες L1 και L2 εκφράζονται μόνο στα τελικά διαφοροποιημένα κερατινοκύτταρα των ανώτερων στρωμάτων του επιθηλίου, όπου επίσης εκφράζεται και η πρωτεΐνη Ε4. Η Ε4 πιστεύεται ότι διευκολύνει την απελευθέρωση των νεοσχηματιζόμενων σωματιδίων του ιού από το κύτταρο-ξενιστή. Ο κύκλος ζωής του ιού ολοκληρώνεται με την παραγωγή και τη συνάθροιση των νέων ιϊκών σωματιδίων, την απελευθέρωσή τους από το ώριμο κερατινοκύτταρο και την επακόλουθη προσβολή νέων κυττάρων-ξενιστών. Οι πρωτεΐνες Ε6 και Ε7 του ογκογόνου HPV συνδέονται με τα παράγωγα των κυτταρικών ογκοκατασταλτικών γονιδίων p53 και ρετινοβλαστώματος (Rb) αντίστοιχα. Η σύνδεση της υψηλού κινδύνου Ε6 με το p53 διευκολύνει την εξάπλωση και τη λειτουργική έκπτωση του p53, με αποτέλεσμα την απώλεια της εξαρτώμενης από το p53 απόπτωσης του επιθηλίου και την αναστολή του κυτταρικού κύκλου στη φάση G1. Η ένωση της υψηλού κινδύνου Ε7 με το Rb οδηγεί στη διαταραχή του φυσιολογικού μηχανισμού ελέγχου του κυτταρικού κύκλου, με συνέπεια τον ανεξέλεγκτο κυτταρικό πολλαπλασιασμό. Σε καλοήθεις αλλοιώσεις το γένωμα του ιού διατηρείται σταθερά, ως εξω-χρωμοσωμικό επίσωμα, στο κυτταρόπλασμα του κυττάρου ξενιστή. Η κακοήθης εξαλλαγή των κυττάρων έχει ως αποτέλεσμα την ενσωμάτωση του ιϊκού DNA στο γένωμα του ξενιστή, τη διάσπαση του γονιδίου που κωδικοποιεί την πρωτεΐνη Ε2 και επομένως την απώλεια έκφρασης της συγκεκριμένης πρωτεΐνης. Επειδή η Ε2 είναι απαραίτητη για την καταστολή των Ε6 και Ε7 ογκοπρωτεϊνών, η απώλειά της προκαλεί την υπερέκφραση αυτών των ογκογονιδίων. Η συνδυασμένη δράση των Ε6 και Ε7 ογκογονιδίων δημιουργεί το κατάλληλο περιβάλλον που οδηγεί στον πολλαπλασιασμό των κυττάρων, ενώ παράλληλα διαταράσσονται οι φυσιολογικοί μηχανισμοί ελέγχου του κυτταρικού κύκλου. Αυτό επιτρέπει να εμφανίζονται περιοδικές μιτώσεις και ανεξέλεγκτα λάθη, τα οποία συμβάλλουν στην εξαλλαγή των κυττάρων. Είναι πλέον βέβαιο ότι τα ογκογονίδια Ε6 και Ε7 είναι ισχυροί καρκινογόνοι παράγοντες, οι οποίοι μπορεί να προκαλέσουν αέναη κυτταρική διαίρεση και, σε συνδυασμό με άλλους παράγοντες, καρκινογένεση. Η ανάπτυξη του καρκίνου του τραχήλου (Εικόνα 6 ) είναι τελικά μια σταδιακή συνδυασμένη διεργασία επίμονης HPV λοίμωξης, διαταραχής των ιϊκών ογκογονιδίων και συσσώρευσης περαιτέρω γενετικών δεδομένων που οδηγούν στη νεοπλασία.[11]
Εικόνα 6 Καρκίνος του τραχήλου της μήτρας [13]
Ο μη-μελανωματικός καρκίνος του δέρματος αποτελεί την συχνότερη
κακοήθεια παγκοσμίως στους Καυκάσιους. Η αναλογία βασικοκυτταρικού προς
ακανθοκυτταρικό καρκίνο του δέρματος είναι 5:1 και απαντάται κυρίως σε
εκτεθειμένες στον ήλιο περιοχές του σώματος. Στην προσπάθεια ερμηνείας της
πολυπαραγοντικής φύσης της καρκινογένεσης, φαίνεται ότι γενετικοί παράγοντες
αλληλεπιδρούν με περιβαλλοντικούς παράγοντες και με ιικά γονίδια ώστε να
εκδηλωθεί τελικά η νεοπλασία. Η συμμετοχή ιών στην ανάπτυξη καρκίνου του
δέρματος και η διαλεύκανση του ρόλου τους αποκτά ιδιαίτερο ενδιαφέρον λόγω της
υψηλής συχνότητας εμφάνισης αυτής της νεοπλασίας.
Οι περισσότερες μελέτες που αφορούν στους ιούς του θηλώματος του
ανθρώπου (HPV) έχουν διενεργηθεί σε ανοσοκατεσταλμένους ασθενείς. Έγινε
προσπάθεια ανίχνευσης των HPV σε 108 δείγματα μη ανοσοκατεσταλμένων ασθενών με
καρκίνο του δέρματος και προκαρκινωματώδεις αλλοιώσεις. Σε όλα τα δείγματα
εφαρμόσθηκε η τεχνική της αλυσιδωτής αντίδρασης με πολυμεράση (PCR). Οι ιοί HPV
ανιχνεύθηκαν σε ποσοστό 27% των δειγμάτων. Ακολούθως, έγινε προσπάθεια
ταυτοποίησης συγκεκριμένων τύπων HPV και βρέθηκε ότι οι συχνότερα απαντώμενοι τύποι
ήταν οι HPV 8 (62%) και HPV 18 (48%). Επίσης διαπιστώθηκε μόλυνση αρκετών
δειγμάτων με περισσότερους από έναν τύπους.
Στη συνέχεια, τα ίδια 108 δείγματα ελέγχθηκαν για την ύπαρξη
ερπητοϊών και συγκεκριμένα εξετάσθηκε η παρουσία σε αυτά των ιών του απλού
έρπητα (HSV), του Epstein-Barr (EBV) και του κυτταρομεγαλοϊού (CMV).
Εφαρμόστηκε και εδώ η αλυσιδωτή αντίδραση πολυμεράσης. Όλα τα δείγματα ήταν
αρνητικά για την ύπαρξη HSV και EBV. Αντιθέτως, ο κυτταρομεγαλοϊός ανιχνεύθηκε
στο 39% των δειγμάτων. Επιπλέον, κάποια από τα δείγματα έφεραν μόλυνση
ταυτόχρονα από HPV και CMV. Από τα ανωτέρω προκύπτει ότι οι ιοί HPV και CMV
είναι παρόντες σε προκαρκινικά και καρκινικά δείγματα και ενέχονται στην
καρκινογενετική διαδικασία του μη μελανωματικού καρκίνου, διαδραματίζοντας σε
συνδυασμό και με άλλους παράγοντες σημαντικό ρόλο στην δημιουργία αυτής της
νεοπλασίας. Η μόλυνση αρκετών δειγμάτων με διαφορετικούς τύπους HPV υποδηλώνει
ότι ο συνδυασμός ενός ογκογόνου και ενός δυνητικά ογκογόνου τύπου ο οποίος
θεωρείται μη παθογόνος για τον γενικό πληθυσμό, θα μπορούσε να οδηγήσει στην
ανάπτυξη κλινικά έκδηλης νόσου μέσω μηχανισμών ιικής αλληλεπίδρασης.
Αντίστοιχα, η σύγχρονη μόλυνση με HPV και CMV υπονοεί μία συνεργική δράση αυτών
των ογκογόνων ιών στην ανάπτυξη του καρκίνου του δέρματος. [14]
Ο ηπατοκυτταρικός καρκίνος είναι ο πέμπτος συχνότερος καρκίνος
παγκοσμίως. Υπολογίζεται ότι κάθε χρόνο 560.000 νέοι ασθενείς προσβάλλονται από
ηπατοκυτταρικό καρκίνο. Οι πιθανότητες πλήρους ίασης είναι πολύ μικρές και ο
ηπατοκυτταρικός καρκίνος είναι η τρίτη συχνότερη αιτία θανάτου από καρκίνο
παγκόσμια και περίπου 250.000 άνθρωποι πεθαίνουν κάθε χρόνο εξαιτίας αυτής της
μορφής καρκίνου.
Είναι η πρώτη αιτία θανάτου από καρκίνο στην υποσαχάρια Αφρική
και πολύ συχνός στην Κίνα και τη Νοτιοανατολική Ασία. Η επίπτωση σε αυτές τις
περιοχές κυμαίνεται μεταξύ 35 και 50 ανά 100.000 πληθυσμού. Στην Ελλάδα και τη
Βαλκανική χερσόνησο η επίπτωση κυμαίνεται μεταξύ 5 και 15 ανά 100.000 πληθυσμού
και είναι η μεγαλύτερη της Ευρώπης. Οι άνδρες νοσούν περισσότερο από τις
γυναίκες και η αναλογία ανδρών / γυναικών κυμαίνεται μεταξύ 8/1 στην Αφρική και
2/1 στις χώρες της Ευρώπης [15]
ΑΙΤΙΟΛΟΓΙΑ
Αρκετοί πιθανοί αιτιολογικοί παράγοντες έχουν ενοχοποιηθεί για
τη γένεση αυτού του τύπου καρκίνου. Οι κυριότεροι είναι η προϋπάρχουσα κίρρωση,
η λοίμωξη με τους ιούς της ηπατίτιδας Β και C, η περιβαλλοντική έκθεση σε
αφλατοξίνες και η προϋπάρχουσα αιμοχρωμάτωση.[15]
Ηπατίτιδα Β
Υπάρχουν πολλές μελέτες που συνδέουν τη χρόνια λοίμωξη με τον ιό της Ηπατίτιδας Β με τον ηπατοκυτταρικό καρκίνο. Περιοχές της γης με υψηλό επιπολασμό της Ηπατίτιδας Β έχουν ταυτόχρονα και μεγάλη επίπτωση του ηπατοκυτταρικού καρκίνου. Είναι χαρακτηριστικό ότι η οξεία λοίμωξη (θετικό αντιγόνο core και θετικό αντιγόνο e ) ή η παλαιά λοίμωξη ( θετικό αντίσωμα στο αντιγόνο επιφανείας ) δεν αυξάνουν την πιθανότητα του ηπατοκυτταρικού καρκίνου. Η κάθετη μετάδοση της λοίμωξης από τη μητέρα στο έμβρυο και η επακόλουθη πολύχρονη φορεία της νόσου αποτελούν προδιαθεσικούς παράγοντες ανάπτυξης καρκίνου.
Εικόνα 7 [16]
Μελέτες έχουν δείξει ότι το DNA του ιού μπορεί να ενσωματωθεί στο γονιδίωμα των ηπατικών κυττάρων του ξενιστή και να επηρεάσει την εξέλιξη τους. Πρακτικά, οι φορείς του ιού της ηπατίτιδας Β είναι οι μοναδικοί που μπορούν να αναπτύξουν ηπατοκυτταρικό καρκίνο χωρίς να έχουν αναπτύξει κίρρωση, λόγω αυτής ακριβώς της ιδιότητας του ιού. Ωστόσο η πλειοψηφία των ασθενών με καρκίνο και ηπατίτιδα Β έχουν προηγούμενα αναπτύξει κίρρωση.
Εικόνα 8 [16]
Η επιλοίμωξη με τον ιό της ηπατίτιδας D δεν σχετίζεται με την
ανάπτυξη ηπατοκυτταρικού καρκίνου.[15]
Ηπατίτιδα C
Ο ιός αυτός που ανακαλύφθηκε το 1989 έχει ενοχοποιηθεί ως
προδιαθεσικός παράγοντας για την γένεση ηπατοκυτταρικού καρκίνου. Προκαλεί
χρόνια φορεία στο 70-75% των ασθενών, από τους οποίους ένα 8-10% θα αναπτύξουν
κίρρωση και ηπατοκυτταρικό καρκίνο 30 με 40 χρόνια αργότερα. Ο μηχανισμός
παραμένει άγνωστος αλλά η συντριπτική πλειοψηφία αναπτύσσουν χρόνια ηπατοπάθεια
πριν την δημιουργία νεοπλασίας. Αυτό οδήγησε στην ανάπτυξη μιας θεωρίας που αναφέρει
ότι ο ιός προκαλεί καρκίνο με έμμεσους μηχανισμούς, μέσω χρόνιας φλεγμονής των
ηπατοκυττάρων 3. Η ταυτόχρονη λοίμωξη με τον ιό της Β και της C, καθώς και η
ταυτόχρονη παρουσία αλκοολικής κίρρωσης και λοίμωξης με τον ιό της ηπατίτιδας C
αυξάνει τον κίνδυνο πρόκλησης κακοήθους εξαλλαγής των ηπατοκυττάρων,
ενισχύοντας τη θεωρία του δευτέρου χτυπήματος, ότι δηλαδή ο ιός δρα συνεργικά
με άλλους παράγοντες στη διαδρομή της καρκινογένεσης.[15]
[1] http://www-jcb.bio.auth.gr/mor_biol/celldivision/texts/celldivision31.htm
[2] Ε.Γ. Αλεξανδρή (1995). Εισαγωγή
στη Βιολογία. Πανεπιστήμιο Αθηνών, Τμ. Βιολογίας, σελ. 192-193
[3] Μπιλίρη Α. Καλλιόπη, Ο
ρολος των ερπητοιών και των ιών του θηλώματος του ανθρώπου στον καρκίνο του
δέρματος, ∆ιδακτορική ∆ιατριβή, Πανεπιστήμιο Κρήτης, Τμήμα Ιατρικής, Εργαστήριο
Ιολογίας, Ηράκλειο 2004, σελ. 17-20
[4] http://www.lib.uiowa.edu/hardin/md/cdc/6070.html
[5] http://www.kcom.edu/faculty/chamberlain/website/lectures/lecture/image/kaposi.gif
[6] http://health.in.gr/news/article.asp?lngArticleID=45570
[7] http://researchnews.osu.edu/archive/htlvil2pics.htm
[8] http://www.dundee.ac.uk/biomedres/brighty.htm
[9] Κουρεπίνη Ευαγγελία, Διερεύνηση
της επίδρασης των ερπητοϊών στην παθογένεια της χρόνιας ιδιοπαθούς
ουδετεροπενίας - cin, Μεταπτυχιακή εργασία, Πανεπιστήμιο Κρήτης, Τμήμα Ιατρικής,
Ηράκλειο Σεπτέμβριος 2005, σελ. 12
[10] http://www.uni-duisburg-essen.de/home/fb/ifz/forschung/amg/image_0_7.jpg
[11] http://www.iatrikionline.gr/EL_M_1_2005/6.htm
[12] http://www.msnbc.msn.com/id/12333785/site/newsweek/
[13] http://www.biosci.ohiou.edu/virology/Papilloma/symptoms.htm
[14] Μπιλίρη Α Καλλιόπη, Ο
ρόλος των ερπητοιών και των ιών του θηλώματος του ανθρώπου στον καρκίνο του
δέρματος, 2004,
[15] Ντάμπος Κωνσταντίνος, Ηπατοκυτταρικός
καρκίνος, αιτιολογία, κλινική εικόνα, διάγνωση και θεραπεία, Γαστρεντερολόγος
– Ηπατολόγος, Γ.Ν.Χίου "Σκυλίτσειο", http://www.chios-medical.gr/dabos.htm
[16] http://info.cancerresearchuk.org/cancerstats/causes/infectiousagents/hepatitisviruses/
http://dlib.libh.uoc.gr/Dienst/UI/2.0/Describe/uch.med.phd/2004biliri?Language=English
Οι G πρωτεΐνες είναι πρωτεΐνες που είναι συνδεδεµένες µε ένα
νουκλεοτίδιο γουανίνης. ∆εν είναι ενδοµεµβρανικές πρωτεΐνες παρά το γεγονός ότι
συνδέονται µε την έσω πλευρά της κυτταροπλασµατικής µεµβράνης. Βρέθηκε ότι
αποτελούνται από τρεις υποµονάδες: α, β και γ. Η α υποµονάδα συνδέεται χαλαρά
µε την µεµβράνη και είναι συνήθως ο φορέας που συνδέει τον υποδοχέα και το
πρώιµο ένζυµο-ενεργοποιητή.(Εικόνα 1) Σε αντίθεση, το σύµπλεγµα βγ είναι πολύ
περισσότερο στενά συνδεδεµένο µε την µεµβράνη από ότι η α υποµονάδα. Άλλωστε το
σύµπλεγµα βγ µπορεί να επηρεάσει και άµεσα τα ιοντικά κανάλια. Σήµερα έχουν
αναγνωρισθεί περισσότεροι από 12 διαφορετικούς τύπους α υποµονάδων. Οι G
πρωτεΐνες µε διαφορετικές α υποµονάδες έχουν διαφορετικές δράσεις και για το λόγο
αυτό διαφορετικά ονόµατα. Τα µόρια των G πρωτεϊνών σε ένα κύτταρο είναι πολύ
περισσότερα από τον αριθµό των υποδοχέων µε τους οποίους συνδέονται. Καθώς ένας
υποδοχέας µπορεί να ενεργοποιήσει πολλές G πρωτεΐνες, οι Gπρωτεΐνες χρησιµεύουν
για την ενίσχυση ενός µικρού συναπτικού σήµατος ( το οποίο αντιπροσωπεύεται από
τα σχετικώς λίγα µόρια νευροµεταβιβαστών και υποδοχέων) σε ένα µεγάλο αριθµό
ενεργοποιηµένων συµπλεγµάτων κυκλάσης που είναι απαραίτητα για την κατάλυση της
σύνθεσης µιας λειτουργικής συγκέντρωσης cAMPµέσα στο κύτταρο. Μεγαλύτερη
ενίσχυση επιτυγχάνεται µε τη δράση της πρωτεϊνικής κινάσης, το επόµενο βήµα
στον καταρράκτη του cAMP.[1]


Εικόνα 1 Οι διάφοροι
τύποι συναπτικών υποδοχέων.Α. Ιοντοτροπικός υποδοχέας. Β. Οι G protein-coupled
receptors αποτελούνται από 7 διαµεµβρανικές περιοχές και συνδέονται µε τον
ενεργοποιητή µέσω µιας G πρωτεΐνης. Σε αυτή την οικογένεια υποδοχέων ανήκουν οι
α-και β-αδρενεργικοί υποδοχείς, οι µουσκαρινικοί υποδοχείς της Ακετυλοχολίνης
(Ach), οι υποδοχείς GABAB, ορισµένοι γλουταµικοί και σεροτονεργικοί υποδοχείς,
οι υποδοχείς των νευροπεπτιδίων καθώς και οι οσφρητικοί υποδοχείς και η
ροδοψίνη. c. Υποδοχέας τυροσινικής κινάσης. Η κυτταροπλασµατική περιοχή ενός
υποδοχέα τυροσινικής κινάσης είναι ένα ένζυµο που φωσφορυλιώνει τον εαυτό του
αλλά και άλλες πρωτεΐνες σε κατάλοιπο τυροσίνης. Η φωσφορυλίωση της
κυτταροπλασµατικής περιοχής του υποδοχέα του επιτρέπει να συνδεθεί και εποµένως
να ενεργοποιήσει άλλες πρωτεΐνες, συµπεριλαµβανοµένων και άλλων κινασών που
µπορούν να δράσουν σε ιοντικά κανάλια. Οι υποδοχείς της τυροσινικής κινάσης
ενεργοποιούνται τυπικά από ορµόνες, αυξητικούς παράγοντες και νευροπεπτίδια. [1]

Εικόνα
Οι υποδοχείς με επτά διαμεμβρανικές έλικες είναι υπεύθυνοι για
τη διαβίβαση πληροφοριών που δημιουργήθηκαν από σήματα όπως τα φωτόνια, οι
οσμηρές και οι γευστικές ουσίες, οι ορμόνες και οι νευροδιαβιβαστές (Πίνακας
1). Πολλές χιλιάδες τέτοιοι υποδοχείς είναι γνωστοί και ο κατάλογος συνεχίζει
να αυξάνεται. Όπως υποδηλώνει το όνομα τους, οι υποδοχείς αυτοί περιέχουν επτά
έλικες που διαπερνούν τη μεμβρανική διπλοστιβάδα. Οι υποδοχείς αυτοί συχνά
αναφέρονται ως υποδοχείς τύπου «σερπαντίνας» διότι η απλή πολυπεπτιδική αλυσίδα
ελίσσεται οφιοειδώς διά μέσου της μεμβράνης επτά φορές (Εικόνα2). Ένα πολύ καλά
χαρακτηρισμένο μέλος αυτής της οικογένειας είναι η ροδοψίνη. Το «πρόσδεμα» της
πρωτεΐνης αυτής, το οποίο έχει πολύ σημαντικό ρόλο στην όραση, είναι ένα
φωτόνιο. Ένα παράδειγμα ενός υποδοχέα που αποκρίνεται σε ένα χημικό σήμα είναι
ο αδρενεργικός υποδοχέας β. Η πρωτεΐνη αυτή δεσμεύει την επινεφρίνη (ονομάζεται
και αδρεναλίνη), μια ορμόνη υπεύθυνη για την απόκριση τύπου «αγωνίσου ή φύγε».[3]
 [3]
[3]
Ο αριθµός των ουσιών που αναγνωρίζονται να δρουν ως δεύτεροι
αγγελιοφόροι στη συναπτική µεταβίβαση είναι πολύ µικρότερος από των αριθµό των
νευροµεταβιβαστών. Οι λίγοι δεύτεροι αγγελιοφόροι που έχουν µελετηθεί εκτενώς
ταξινοµούνται σε δύο κατηγορίες: στους µη αέριους και στους αέριους.
Στους µη αέριους δεύτερους αγγελιοφόρους ανήκει η κυκλική
µονοφωσφορική αδενοσίνη, διεθνώς γνωστή ως cAMP. Ακόµη, µια άλλη κατηγορία µη
αέριων δεύτερων αγγελιοφόρων, που παράγεται από την υδρόλυση των φωσφολιπιδίων
της κυτταροπλασµατικής µεµβράνης του κυττάρου, είναι η διακυλογλυκερόλη (DAG),
η πολυφωσφορική ινοσιτόλη (IP3) και το αραχιδονικό οξύ. Ακόµη στους µη αέριους
δεύτερους αγγελιοφόρους µπορούµε να εντάξουµε τα Ca2+ και το cGMP. Οι
αέριοι δεύτεροι αγγελιοφόροι έχουν µεγάλη ικανότητα διάχυσης. Οι πιο καλά
µελετηµένοι αέριοι δεύτεροι αγγελιοφόροι είναι το οξείδιο του αζώτου (nitric
oxide, NO) και το µονοξείδιο του άνθρακα (carbon monoxide, CO). Το ένζυµο
συνθάση του οξειδίου του αζώτου παράγει ΝΟ ενώ η οξυγενάση της αίµης παράγει
CO. Παρά τις διαφορές τους, οι δεύτεροι αγγελιοφόροι έχουν πολλά κοινά βασικά
χαρακτηριστικά τόσο στην παραγωγή τους όσο και στον τρόπο δράσης τους (Εικ. 3).
[1]

Εικόνα 3 Ο κοινός
µηχανισµός δράσης των συστηµάτων των δεύτερων αγγελιοφόρων. Η ενεργοποίηση του
ενεργοποιητή στους υποδοχείς που συνδέονται µε G πρωτεΐνες απαιτεί τη συµµετοχή
διαφόρων πρωτεϊνών. Τυπικά ο ενεργοποιητής είναι ένα ένζυµο που παράγει έναν
δεύτερο αγγελιοφόρο. Οι δεύτεροι αυτοί αγγελιοφόροι µε τη σειρά τους,
πυροδοτούν ένα βιοχηµικό καταρράκτη είτε µέσω ενεργοποίησης συγκεκριµένων
πρωτεϊνικών κινασών που φωσφορυλιώνουν διάφορες πρωτείνες του κυττάρου (σε
κατάλοιπα σερίνης ή θρεονίνης) είτε µέσω κινητοποίησης ιόντων Ca2+
από τις ενδοκυττάριες αποθήκες. Με τον τρόπο αυτό ξεκινούν οι αντιδράσεις που
µεταβάλλουν την βιοχηµική κατάσταση του κυττάρου.[1]
Η σύνδεση του νευροµεταβιβαστή σε έναν υποδοχέα που συνδέεται µε
G πρωτεΐνη ενεργοποιεί την τριµερή G πρωτεΐνη (Για τις G-πρωτεΐνες βλέπε Παράρτηµα
1). Η ενεργοποιηµένη G πρωτεΐνη στη συνέχεια συνδέεται µε την α υποµονάδα της,
σε ένα ένζυµο-ενεργοποιητή: στην αδενυλική κυκλάση στην οδό του cAMP, στη
φωσφολιπάση C στην οδό της πολυφωσφορικής ινοσιτόλης και στην φωσφολιπάση Α
στην οδό του αραχιδονικού οξέος. (Εικόνα 4) Το cAMP, η πολυφωσφορική ινοσιτόλη
και το αραχιδονικό οξύ αποτελούν τους δεύτερους αγγελιοφόρους. Κάθε µια από
αυτές τις οδούς εγκαινιάζει αλλαγές σε συγκεκριµένες πρωτεΐνες στόχους µέσα στο
κύτταρο ενεργοποιώντας πρωτεϊνικές κινάσες που φωσφορυλιώνουν τις πρωτεΐνες
στόχους.
Καθώς µια και µόνο πρωτεϊνική κινάση µπορεί να φωσφορυλιώσει
πολλές διαφορετικές πρωτεΐνες στόχους, η αλλαγή της κατάστασης µιας κινάσης
µπορεί να οδηγήσει σε ενίσχυση και διάδοση του σήµατος.[1]

Εικόνα 4 [4]
Μία πρωτεΐνη που δεσμεύει το γουανυλο-νουκλεοτίδιο αποτελεί ένα
ενδιάμεσο στη μεταγωγή σήματος από τους υποδοχείς μιε επτά διαμεμβρανικές έλικες.
Η πρωτείνη που συνδέεται με το σήμα ονομάστηκε πρωτεΐνη G (το G προέρχεται από το
guanylnucleotide), Η ενεργός πρωτεΐνη G διεγείρει τη δραστικότητα της αδενυλικής κυκλάσης, ενός ενζύμου
που αυξάνει τη συγκέντρωση της cΑΜΡ,
σχηματίζοντας την από ΑΤΡ (Εικόνα 5) [3]

Εικόνα 5 [3]
Στην κατάσταση απενεργοποίησης, το γουανυλο-νουκλεοτίδιο που
δεσμεύεται από την πρωτεϊνη G είναι η GTΡ. Σε αυτή τη μορφή, η πρωτεΐνη G
υφίσταται ως ετεροτριμερές αποτελούμενο από υπομονάδες α, β και γ·. Η υπομονάδα
α (αναφερόμενη ως Gα,) δεσμεύει το νουκλεοτίδιο (Εικόνα 6).

Εικόνα 6 [3]
Η υπομονάδα α είναι μέλος της οικογένειας των ΝΤΡασών με θηλιές
Ρ ενώ η θηλιά Ρ συμμετέχει στη δέσμευση του νουκλεοτιδίου. Η υπομονάδα β
περιέχει δομή επτά λογχοειδών προωστήρων και η υπομονάδα γ περιέχει ένα ζεύγος
α-ελίκων (Εικόνα 7) οι οποίες περιτυλίσσονται γύρω από την υπομονάδα β (Εικόνα
8).

Εικόνα 7 Πρωτεϊνη G: Μοντέλο δομής [5]

Εικόνα 8 [3]
Οι υπομονάδες α και γ είναι συνήθως «αγκυροβολημένες» στη
μεμβράνη μέσω ομοιοπολικώς συνδεδεμένων με αυτές λιπαρών οξέων. Ο ρόλος του δεσμευμένου
στην ορμόνη υποδοχέα είναι να καταλύει την ανταλλαγή της GTΡ για να δεσμεύσει
την GΤΡ. Το σύμπλοκο ορμόνης-υποδοχέα αλληλεπιδρά με την ετεροτριμερή πρωτείνη G
και ανοίγει τη θέση δέσμευσης του νουκλεοτιδίου, έτσι ώστε η GDΤ να μπορεί να αποδεσμευθεί και να
δεσμευθεί η GΤΡ από το
διάλυμα. Η υπομονάδα α ταυτόχρονα απομακρύνεται από το διμερές βγ (Gβγ). Η δομή της υπομονάδας Gα προσαρμόζεται σφιχτά στο
μόριο της GΤΡ και
συγκεκριμένα τρία πολυπεπτιδικά τμήματα (ονομαζόμενα διακόπτης Ι, διακόπτης II
και διακόπτης III) αλληλεπιδρούν είτε άμεσα είτε έμμεσα με τη γ - φωσφορική
ομάδα της GΤΡ (Εικόνα 9).

Εικόνα 9 [3]
Οι δομικές αυτές αλλαγές είναι υπεύθυνες για τη μειωμένη
συγγένεια της υπομονάδας Gα,,
προς το διμερές Gβγ. Ο
διαχωρισμός της ετεροτριμερoύς
πρωτεΐνης G σε μονάδες Gα και Gβγ μεταδίδει το μήνυμα ότι ο υποδοχέας
έχει δεσμεύσει το πρόσδεμα. Πολύ περισσότερο, οι επιφάνειες των Gα και Gβγ, οι οποίες δομούσαν την επιφάνεια
επαφής μεταξύ των υπομονάδων στο τριμερές, τώρα βρίσκονται εκτεθειμένες ώστε να
αλληλεπιδράσουν με άλλες πρωτεΐνες.
Ένα και μόνο σύμπλοκο ορμόνης-υποδοχέα μπορεί να διεγείρει την
ανταλλαγή νουκλεοτιδίων σε πολλές ετεροτριμερείς πρωτεΐνες G. Συνεπώς,
εκατοντάδες μόρια Gα,, μετατρέπονται από τη μορφή GDΡ στη μορφή GΤΡ, (Εικόνα 10)
για κάθε μόριο δεσμευμένης στον υποδοχέα ορμόνης, δίνοντας μια ενισχυμένη
απόκριση.


Εικόνα 10 [6]
Όλοι οι υποδοχείς με επτά διαμεμβρανικές έλικες φαίνεται να
σχετίζονται με πρωτεΐνες G και έτσι οι υποδοχείς με επτά διαμεμβρανικές έλικες
αναφέρονται και ως υποδοχείς συζευγμένοι με πρωτεϊνες G. (Εικόνα 11) Όλα τα
σήματα που λειτουργούν μέσω υποδοχέων με επτά διαμεμβρανικές έλικες
χρησιμοποιούν την ίδια πρωτεΐνη G; Στην ουσία, όχι. Υπάρχουν διαφορετικές
πρωτεΐνες G οι οποίες μπορούν να επιδρούν σε μεταγενέστερους στόχους μέσω
διαφορετικών πορειών όταν ενεργοποιούνται. Παραδείγματος χάριν, ως προς την
πρωτεΐνη G που σχετίζεται
με τον αδρενεργικό υποδοχέα β, η υπομονάδα α δεσμεύεται στην αδενυλική κυκλάση
και διεγείρει την ενζυμική δραστικότητα της. Η υπομονάδα αυτή αναφέρεται και ως
Gαs, όπου το s του δείκτη
δηλώνει τον διεγερτικό ρόλο της υπομονάδας. Το ανθρώπινο γονιδίωμα περιέχει περισσότερα
από 15 γονίδια που κωδικεύουν υπομονάδες α, 5 που κωδικεϋουν υπομονάδες β και
10 που κωδικεύουν υπομονάδες γ. Συνεπώς, σε γενικές γραμμές, θα μπορούσαν να
υπάρχουν περισσότερες από χίλιες ετεροτριμερείς πρωτεΐνες G ωστόσο, ο αριθμός των συνδυασμών που
υπάρχουν είναι στην πραγματικότητα άγνωστος. Επιλεγμένα μέλη αυτής της
οικογένειας παρουσιάζονται στον Πίνακα 2. Μόνο ένα μικρό υποσύνολο των
πρωτεϊνών αυτών εκφράζονται σε ένα συγκεκριμένο κύτταρο.[3]
 [3]
[3]

Εικόνα 11 [4]
Μερικές G-πρωτεΐνες ρυθμίζουν διαύλους
ιόνιων
Οι πρωτεΐνες-στόχοι για τις υπομονόδες των G-πρωτεϊνών είναι δίαυλοι ιόνιων ή
μεμβρανικά ένζυμα. Οι διάφοροι στόχοι επηρεάζονται από διαφορετικά είδη G πρωτεϊνών
(στα κύτταρα των θηλαστικών έχουν ήδη ανακαλυφθεί περίπου 20) και στη συνέχεια
οι διάφορες G-πρωτε'ίνες
ενεργοποιούνται από διαφορετικούς υποδοχείς της κυτταρικής επιφάνειας. Έτσι. η
πρόσδεση ενός εξωκυττάριου σηματοδοτικού μορίου σε έναν υποδοχέα που συνδέεται με
μια G-πρωτεϊνη επιδρά
μόνο σε ένα υποσύνολο πρωτεϊνικών στόχων, που είναι κατάλληλοι για αυτό το σήμα
και για αυτό το είδος του κυττάρου.
Αρχικά θα θεωρήσουμε ένα παράδειγμα ρύθμισης διαύλων ιόντων μέσω
G-πρωιεϊνών. Η καρδιακή
συχνότητα ελέγχεται από δύο ομάδες νευρικών ινών η μία από αυτές επιταχύνει την
καρδιακή συχνότητα ενώ η άλλη την επιβραδύνει. Οι νευρικές ίνες που
σηματοδοτούν την επιβράδυνση εκλύουν ακετυλοχολίνη, η οποία προσδένεται στα μυοκαρδιακά
κύτταρα σε έναν υποδοχέα που διασυνδέεται με μια G-πρωτεΐνη. Μόλις, η ακετυλοχολίνη
προσδεθεί στον υποδοχέα, η G-πρωτεΐνη
ενεργοποιείται, δηλαδή διίσταται σε μια α υπομονάδα και ένα σύμπλοκο βγ (Εικόνα
12). Στο συγκεκριμε'νο παράδειγμα, το ενεργό σηματοδοτικό συστατικό είναι το
σύμπλοκο βγ. Το σύμπλοκο αυτό προσδένεται στην ενδοκυττάρια πλευρά ενός διαύλου
Κ+ της κυτταρικής μεμβράνης των μυοκαρδιακών κυττάρων και
εξαναγκάζει ιόν δίαυλο να προσλάβει την ανοικτή διαμόρφωση. Αυτό έχει ως
συνέπεια να μεταβληθούν οι ηλεκτρικές ιδιότητες του μυοκαρδιακού κυττάρου, το
οποίο πλέον συστέλλεται λιγότερο συχνά. Η δράση του συμπλόκου βγ τερματίζεται
και ο δίαυλος Κ+ ξανακλείνει μόλις αδρανοποιηθεί η α υπομονάδα (με
υδρόλυση του συνδεμένου GΤΡ)
και ξανασυνδεθεί με το σύμπλοκο βγ για να σχηματίσει μια ανενεργό G-πρωτε'ϊνη.[7]

Εικόνα 12 [7]
Ορισμένες G-πρωτείνες ενεργοποιούν
μεμβρανικά ένζυμα
Οι αλληλεπιδράσεις των G-πρωτεϊνών με διαύλους ιόντων προκαλούν μια άμεση μεταβολή στην
κατάσταση και τη συμπεριφορά του κυπάρου. Οι αλληλεπιδράσεις τους με ενζυμικοΰς
στόχους έχουν πιο περίπλοκες συνέπειες, καθώς οδηγούν στο σχηματισμό επιπλέον
ενδοκυττάριων σηματοδοτικών μορίων. Τα πιο συνήθη ένζυμα-στόχοι για τις G-πρωιεΐνες είναι η αδενυλική
κυκλάση, η οποία είναι υπεύθυνη για την παραγωγή ενός μικρού σηματοδοτικού
μορίου, του κυκλικού ΑΜΡ, και η ψωσφολιπάση C, η οποία είναι υπεύθυνη για την παραγωγή δύο άλλων μικρών σηματοδοτικών
μορίων, της τριφωσφορικής ινοσιτόλης και της διακυλογλυκερολης. Τα δυο αυτά
ένζυμα ενεργοποιούνται από διαφορετικά είδη G-πρωιεϊνών και σχηματίζουν τα μικρά ενδοκυττάρια σηματοδοτικά
μόρια υπό την επίδραση διαφόρων εξωκυττάριων σημάτων, Αυτή η σύζευξη μπορεί να
είναι είτε διεγερτική (να διαμεσολαβείται από μια διεγερτική G-πρωτεΐνη) είτε ανασταλτική (να
διαμεσολαβείται από μια ανασταλτική (G-πρωτεΐνη). Τα μικρά ενδοκυττάρια σηματοδοτικά μόρια αυτών των
οδών συχνά αποκαλούνται δεύτεροι αγγελιοφόροι (ενώ "πρώτοι
αγγελιοφόροι" θεωρούνται τα εξωκυττάρια σήματα), Παράγονται σε μεγάλες ποσότητες
όταν ενεργοποιείται το μεμβρανικό ένζυμο και κατόπιν απομακρύνονται με διάχυση
από τη θέση παραγωγής τους και αναμεταδίδουν το σήμα σε όλο το κύτταρο (Εικόνα 13).
[7]

Εικόνα 13 [7]
Η ενεργοποίηση της αδενυλικής κυκλάσης (παραγωγή cΑΜΡ) μπορεί να ενεργοποιήσει
τη cΑΜΡ-εξαρτώμενη
κινάση πρωτεΐνης (cΑΜΡ ΡC), η οποία αποτελείται από 2
καταλυτικές, C, και 2
ρυθμιστικές, R,
υπομονάδες. (Εικόνα 14,15) Η ενεργοποιημένη κινάση διασπάται και οι καταλυτικές
υπομονάδες της φωσφορυλιώνουν ειδική πρωτεΐνη, της οποίας τροποποιούν τη
φυσιολογική δράση. Εξ άλλου, σε σύνδεση του υποδοχέα με αναστολέα (π.χ.
αδενοσίνη) ενεργοποιείται η υπομονάδα α της Gi,, αποσπάται το αGi;, συνδέεται με την αδενυλική κυκλάση, της οποίας αναστέλλεται
η δραστηριότητα.[8]

Εικόνα 14 [8]
Παραδείγματα υποδοχέων που δραστηριοποιούν την αδενυλική κυκλάση
μέσω των Gs είναι;
οι β-αδρενεργικοί υποδοχείς των λείων μυϊκών ινών που προκαλούν
τη χάλασή τους,
οι υποδοχείς της καρδίας που αυξάνουν την καρδιακή συχνότητα και
την ένταση της συστολής των μυοκαρδιακών ινών,
οι υποδοχείς του γλυκογόνου, που επιτρέπουν την υδρόλυση του
γλυκογόνου στα ηπατικά κύτταρα,
οι υποδοχείς της θυρεοειδοτρόπου ορμόνης που εξασφαλίζουν την
έκκριση της Θυροξίνης από το θυρεοειδή αδένα.
Στους υποδοχείς που αναστέλλουν την αδενυλική κυκλάση μέσω των Gi| περιλαμβάνονται:
οι υποδοχείς της προστακυκλίνης, που αναστέλλουν τη
δραστηριότητα των αιμοπεταλίων
οι α2 αδρενεργικοί υποδοχείς που διεγείρουν τόσο τη συσσωμάτωση
όσο και την έκκριση των αιμοπεταλίων.[8]

Εικόνα 15 [4]
Η ενεργοποίηση της φωσφολιπάσης C από την Gp οδηγεί στη διάσπαση της Ρ1Ρ2 σε DΑG και ΙΡ3. Η DΑG παραμένει στην κυτταρική μεμβράνη και ενεργοποιεί την κινάση C πρωτεΐνης, η οποία μπορεί
να φωσφορυλιώσει ειδική πρωτεΐνη, προκαλώντας βιολογική ανταπόκριση. Η ΙΡ3
προκαλεί την έξοδο ασβεστίου οπό οργανίδια (πχ. ενδοπλασματικό δίκτυο) με τη
διάνοιξη διαύλων.
Τα ιόντα Ca2+
(α) συμμετέχουν στην ενεργοποίηση της κινάσης C πρωτεΐνης, (β) ενεργοποιούν τη
φωσφολιπάση Α2 (σχηματισμός εικοσανοειδών), και (γ) σχηματίζουν σύμπλοκο με
καλμοδουλίνη ενεργοποιούσα ειδική κινάση πρωτείνης η οποία φωσφορυλιώνει
πρωτεΐνη.
Η ποσότητα του ενδοκυττάριου cΑΜΡ ρυθμίζεται από τη φωσφοδιεστεράση, η οποία το υδρολύει. Η
δράση του ενζύμου αυτού μπορεί να ανασταλεί εκλεκτικώς από τη θεοφυλλίνη, την
καφεΐνη και άλλα παράγωγα της ξανθίνης. Η ενεργοποίηση πρωτεΐνης Gk και Go από το σύμπλοκο υποδοχέα-αγωνιστή
μπορεί να οδηγήσει στην ενεργοποίηση διαύλου Κ+ και Ca2+, χωρίς την
παρεμβολή του αγωνιστή.[8]
Η ινσουλίνη, ορισμένοι αυξητικοί παράγοντες και πολυπεπτίδια με
μιτογόνο δράση συνδέονται με εξωκυττάρια θέση διαμεμβρανικών υποδοχέων με μια
μόνο α-έλικα και δραστηριότητα κινάσης τυροσίνης. Αυτή η ενζυμική δραστηριότητα
εντοπίζεται στο τελικό άκρο του υποδοχέα στο εσωτερικό του κυττάρου. Η σύνδεση
του αγωνιστή με τον υποδοχέα διεγείρει τη δραστηριότητα του υποδοχέα να
καταλύει φωσφορυλιώσεις άλλων πρωτεϊνών, με αποτέλεσμα τη βιολογική
ανταπόκριση.[8]
Οι υποδοχείς αυτοί είναι άθροισμα πεπτιδίων με πολλές
διαμεμβρανικές περιοχές (δικαιοδοσίες) το καθένα. Σε αυτούς περιλαμβάνονται οι
νικοτινικοί υποδοχείς της ακετυλοχολίνης, ο υποδοχέας Α του GΑΒΑ, ο υποδοχέας 5ΗΤ-3 της σεροτονίνης,
ο υποδοχέας της γλυκίνης και οι υποδοχείς αμινοξέων-διεγερτών.
Όταν οι υποδοχείς αυτοί συνδέονται με αγωνιστή, λαμβάνει χώρα
πρόσκαιρη διαμορφωτική μεταβολή στη διάταξη των υπομονάδων-πεπτιδίων τους, με
αποτέλεσμα το σχηματισμό διαύλων. Αυτοί οι δίαυλοι επιτρέπουν την εκλεκτική
δίοδο ιόντων κατά τη φορά της πτώσης του ηλεκτροχημικού δυναμικού.[8]
Για πολλές λειτουργίες του νευρικού συστήματος - για παράδειγμα,
η διεργασία της μνήμης - απαιτούνται παρατεταμένες μεταβολές σε νευράδες για
δευτερόλεπτα, ως και μήνες μετά την απομάκρυνση της διαβιβαστικής ουσίας. Οι
δίαυλοι ιόντων δεν είναι κατάλληλοι για την πρόκληση παρατεταμένων αλλοιώσεων
στις μετασυναπτικές νευράδες, γιατί αυτοί οι δίαυλοι συγκλείονται σε msec μετά την απομάκρυνση της
διαβιβαστικής ουσίας. Σε πολλές περιπτώσεις, παρατεταμένη δραστηριότητα της
νευράδας επιτυγχάνεται με δραστηριοποίηση συστήματος χημικού "δεύτερου
αγγελιοφόρου," που βρίσκεται στην ίδια τη μετασυναπτική νευράδα, και στη
συνέχεια ο δεύτερος αυτός αγγελιοφόρος προκαλεί την παρατεταμένη επίδραση.
Υπάρχουν διάφοροι τύποι συστημάτων δεύτερου αγγελιοφόρου. Σε
έναν από τους επικρατέστερους τύπους σε νευράδες, χρησιμοποιείται μία ομάδα
πρωτεϊνών που ονομάζονται G-πρωτεϊνες.
Στην εικόνα 16 (άνω αριστερή γωνία) απεικονίζεται μία πρωτεΐνη υποδοχέα
μεμβράνης, που ε'χει ενεργοποιηθεί με την επίδραση μεταβιβαστικής ουσίας. Μία G-πρωτεϊνη συνδέεται με το
τμήμα της δεκτικής πρωτεΐνης που προβάλλει προς το εσωτερικό του κυττάρου. Με
τη σειρά της η G-πρωτεΐνη
αποτελείται από τρεις συνιστώσες: μία άλφα (α) συνιστώσα, η οποία αποτελεί το
ενεργοποιητικό τμήμα της G-πρωτείνης,
μία βήτα (β) και μία γάμα (γ) συνιστώσες, που συνδεουν τη G-πρωτείνη προς το εσωτερικό της
κυτταρικής μεμβράνης, δίπλα στη δεκτική πρωτεΐνη. Κατά την ενεργοποίηση από
νευρική ώση, το τμήμα άλφα της G-πρωτεΐνης,
αποχωρίζεται από τα βήτα και γάμα τμήματα και, στη συνέχεια, είναι ελεύθερο να
διακινείται μέσα στο κυτόπλασμα του κυττάρου.[9]

Εικόνα 16 [9]
Μέσα στο κυτόπλασμα, η αποχωρισθείσα άλφα συνιστώσα επιτελεί μία
ή περισσότερες πολλαπλές λειτουργίες, ανάλογα με τα ειδικά χαρακτηριστικά της
κάθε νευράδας. Στην εικόνα 16 απεικονίζονται 4 μεταβολές, οι ακόλουθες:
1. Διάνοιξη ειόικών διαύλων ιόντων στή μετασυναπτική κυτταρική
μεμβράνη. Στην άνω δεξιά γωνία της εικόνας απεικονίζεται δίαυλος καλίου, που
διανοίγεται σε απάντηση προς G-πρωτείνη.
Αυτός ο δίαυλος συχνά παραμένει ανοιχτός για παρατεταμένο χρονικό διάστημα, σε
σύγκριση με την ταχεία σύγκλειση διαύλων ιόντων που ενεργοποιούνται με άμεσο
τρόπο, στους οποίους δεν χρησιμοποιείται σύστημα δεύτερου αγγελιοφόρου.
2. Ενεργοποίηση κυκλικής μονοφωσφορικής αδενοσίνης (ΑΜΡ) είτε κυκλικής
μονοφωσφορικής γουανοσίνης (GΜΡ)
στο νευραδικό κύτταρο. Υπενθυμίζεται ότι η κυκλική ΑΜΡ, είτε η κυκλική GΜΡ. μπορούν να ελέγχουν
εξαιρετικά εξειδικευμένους μεταβολικούς μηχανισμούς της νευράδας και, κατά
συνέπεια, μπορούν να επιφέρουν οποιοδήποτε χημικό αποτέλεσμα, συμπεριλαμβανομένων
και μακροπροθέσμων μεταβολών στην ίδια τη δομή του κυττάρου, και με αυτό τον
τρόπο να μεταβάλλουν τη μακροπρόθεσμη διεγερσιμότητα της νευράδας.
3. Ενεργοποίηση ενός είτε περισσοτέρων ενδοκυτταρικών ενζύμων. Η
G-πρωτείνη μπορεί να
ενεργοποιήσει, με άμεσο τρόπο, ένα είτε και περισσότερα ενδοκυττάρια ένζυμα. Με
τη σειρά τους τα ένζυμα μπορούν να προκαλέσουν την πραγματοποίηση οποιαδήποτε
από πολλές ειδικές χημικές λειτουργίες στο κύτταρο.
4. Ενεργοποίηση μεταγραφής γονιδίων. Αυτό αποτελεί πιθανώς το
πλέον σημαντικό σύστημα δεύτερου αγγελιοφόρου στη μετασυναπτική νευράδα. Με τη
μεταγραφή γονιδίων μπορεί να επιτυγχάνεται ο σχηματισμός νέων πρωτεϊνών μέσα
στη νευράδα, και αυτές μπορούν να μεταβάλλουν μεταβολικούς μηχανισμούς του κυττάρου,
είτε ακόμα και της δομής του. Πράγματι,είναι καλά γνωστό ότι, μεταβολές της
δομής νευράδων που ενεργοποιούνται κατάλληλα, πράγματι συμβαίνουν, ιδιαίτερα σε
διεργαοίες που αφορούν τη μακροπρόθεσμη μνήμη.
Κατά συνέπεια, είναι φανερό ότι η ενεργοποίηοη των συστημάτων
δευτέρου αγγελιοφόρου στη νευράδα. είτε αυτά είναι του τύπου G-πρωτεΐνης είτε άλλου τύπου, είναι
εξαιρετικά σημαντική για τη μεταβολή των χαρακτηριστικών της απάντησης των
διαφόρων νευραδικών οδών.[9]

Εικόνα 17 Με GTP - σύνδεση
πρωτεϊνες [10]

Εικόνα 18 [10]
Το παράδειγµα της
G-πρωτεϊνης Ras

Εικόνα 19 [10]

Εικόνα 20 [4]
Η μελέτη των διεγερτικών και των ανασταλτικών νευροδιαβιβαστών
αποκάλυψε την ύπαρξη ενός μεγάλου αριθμού άλλων χημικών ουσιών που
απελευθερώνονται από τους νευρώνες. Πολλές από αυτές επηρεάζουν τους
νευρωνικούς μηχανισμούς αλληλεπιδρώντας με διαφορετικές πρωτεΐνες στις μεμβράνες των νευρώνων, που
ονομάζονται μεταβοτροπικοί υποδοχείς. Αυτοί οι υποδοχείς δεν περιέχουν ιοντικά
κανάλια, δεν εντοπίζονται πάντα στην περιοχή της σύναψης και, κυρίως, δεν
οδηγούν στην έναρξη δυναμικών ενέργειας. Τώρα πλέον θεωρούμε ότι αυτοί οι
υποδοχείς ρυθμίζουν ή τροποποιούν την τεράστια ποικιλία χημικών διεργασιών που πραγματοποιούνται στο
εσωτερικό των νευρώνων και για το λόγο αυτό η επίδραση που ασκούν οι
μεταβοτροπικοί υποδοχείς ονομάζεται νευρορύθμιση ή νευροτροποποίηση. Οι
μεταβοτροπικοί υποδοχείς συνήθως βρίσκονται σε πολύπλοκα σωματίδια που συνδέουν
το εξωτερικό του κυττάρου με ένζυμα που βρίσκονται μέσα στο κύτταρο και που επηρεάζουν τον μεταβολισμό του. Όταν ένας
νευροδιαβιβαστής αναγνωριστεί και δεσμευτεί σε ένα μεταβοτροπικό υποδοχέα,
συνδετικές ρυθμιστικές πρωτεΐνες, που ονομάζονται G-πρωτεΐνες και άλλα ένζυμα
της μεμβράνης ενεργοποιούνται ομαδικά. Η δέσμευση του διαβιβαστή από τους μεταβοτροπικούς υποδοχείς μπορεί να παραλληλιστεί με σπινθήρα
ανάφλεξης. ∆εν επιτρέπουν τη διέλευση ιόντων από τη μεμβράνη, όπως οι ιονοτροπικοί
υποδοχείς, αλλά αντίθετα ενεργοποιούν ταχύτατα δεύτερους αγγελιαφόρους,
προκαλώντας ένα καταρράκτη βιοχημικών γεγονότων.(Εικόνα 21) Στη συνέχεια ο
μεταβολικός μηχανισμός του νευρώνα ξεκινάει «να παίρνει στροφές» και
ενεργοποιείται. Τα αποτελέσματα της νευροτροποποίησης περιλαμβάνουν μεταβολές
στα ιοντικά κανάλια, στους υποδοχείς, στις αντλίες, ακόμη και στην έκφραση
γονιδίων. Αυτές οι αλλαγές έχουν βραδύτερη έναρξη και μεγαλύτερη διάρκεια από
αυτές που προκαλούνται από τους διεγερτικούς και τους ανασταλτικούς διαβιβαστές
και τα αποτελέσματά τους επεκτείνονται πέρα από το επίπεδο της σύναψης. Αν και
δεν προκαλούν δυναμικά ενέργειας, επιδρούν ουσιαστικά στη διαδικασία μετάδοσης
των ώσεων δια μέσου των νευρωνικών δικτύων.[11]

Εικόνα 21 [11]

Εικόνα 22 [12]
Ο καταρράκτης μηνυμάτων που ευθύνεται για την αντίληψη του φωτός
στα σπονδυλωτά αρχίζει με την ροδοψίνη στους δίσκους των ραβδίων. Τα μάτια των
σπονδυλωτών περιέχουν φωτοχρωστικές ουσίες στις συσσωρευμένες μεμβράνες (discs)
στο εσωτερικό των νευρικών κυττάρων φωτοδεκτών. Στον αμφιβληστροειδή των
ανώτερων σπονδυλωτών βρίσκονται και τα δύο, τα ραβδία (για την όραση σε επίπεδα
χαμηλού φωτός) και τα κωνία (αρμόδια για την αντίληψη χρώματος). Η ροδοψίνη
είναι σε θέση να απορροφήσει το φως στο ορατό φάσμα (500nm στο μήκος κύματος) μόνο
επειδή περιέχει 11-cis-ρετινάλη, ένα παράγωγο της βιταμίνης-A, σαν μικρό μόριο
χρωμοφόρο και ως εκ τούτου αρχίζει ο. καταρράκτης μηνυμάτων. Η ροδοψίνη
σχηματίζεται όταν αποπρωτεϊνώνεται, η οψίνη συνδέεται ομοιοπολικά με την
11-cis-ρετινάλη. Όταν το φως απορροφάται, η 11- cis -ρετινάλη ισομεριώνεtai se
όλο-trans-ρετινάλη, με αλλαγή της μορφής του μορίου και του υποδοχέα που είναι
συνδεδεμένος. Κατόπιν μια σειρά αλλαγών διαμόρφωσης της ροδοψίνης οδηγεί στον
σχηματισμό φωτοευαίσθητης μεταροδοψίνης-II [Rhodopsin (500nm)
—>Batho-Rhodopsin (543nm) —>Lumi- Rhodopsin (497nm) —>Meta-Rhodopsm-I
(480nm) —>Meta-Rhodopsm-II (380nm)] [13].
Αυτή την αλλαγή στο σχήμα της ροδοψίνης την επιφέρει η
αλληλεπίδρασή της με μεταγωγή, μελών της G - πρωτεϊνικής οικογένειας γονιδίων
που έχει το συγκεκριμένο ρόλο στην οπτική μεταγωγή σημάτων. Ο μεσάζων
μεταροδοψίνη-II είναι σήμα ικανό για αλληλεπίδραση με τις G-πρωτεϊνες. Η
μεταροδοψίνη -II ενεργοποιεί την μεταγωγή της ετερομερούς G-πρωτεϊνης. Η GTP
συνδέεται με GN-AlphaT (Guanme Nucleotide-Binding πρωτεϊνική G(t)-Alpha)
υπομονάδα) ελευθερώνεται και δεσμεύεται έπειτα στην ανασταλτική Gamma-υπομονάδα
της PDE (Phosphodiesterase) και την αφαιρεί. Η PDE είναι τώρα ικανή να
υδρολύσει το cGMP (Cyclic Guanosme Monophosphate) [14,15]


Εικόνα 23 [16]
Εκτός από το μονοπάτι της σποριογένεσης, μια παράλληλη ανάμειξη
μονοπατιών ετεροτριμερούς G-πρωτεϊνης, FadA ρυθμίζει τον πολλαπλασιασμό του
μυκήλιου και ανταγωνίζεται την κονιδιοφόρο ανάπτυξη. Αρχικός ρόλος της RGS
περιοχής της πρωτεϊνης FlbA στη σποριογένεση είναι να αποτρέψει την
ενεργοποίηση της FadA με την υποκίνηση της δραστηριότητας της GTPάσης. Η FlbA,
μετά από την ενεργοποίηση από Flug, προάγει άφυλη σποριογένεση με την
αδρανοποίηση της FadA-εξαρτώμενης σηματοδότηση ανάπτυξης. Αρχική μυκηλιακή
αύξηση οδηγείται από την ενεργοποίηση G-Alpha πρωτεϊνης FadA σε GTP-
συνδεδεμένη μορφή. Αυτή το μονοπάτι καταστέλλει την σποριογένεση μέχρι ο
μύκητας να αποκτήσει αναπτυξιακή ικανότητα. Η πρόοδος της σποριογένεσης
επηρεάζεται επίσης από BrlA-εξαρτώμενη επαγωγή από τις δραστηριότητες των
κινασών του κυτταρικού κύκλου, NIMX/CDC2 (Cell Division Control
Protein-2/Cyclm-Dependent Protein Kmase) και NIMA (Never in Mitosis/G2-Specific
Protein Kmase-NIMA). προαγωγή μορφογένεσης από την πολυπύρηνη, νηματοειδή μορφή
σε μια απύρηνη, μορφή βλάστησης [17,18]
Μεταγωγή σημάτων αύξησης μεσολαβημένη από την FadA περιλαμβάνει
την ενεργοποίησή από GDP-σε-GTP αλλαγή, πιθανώς αρχόμενη με την σύνδεση με έναν
παράγοντα αύξησης συνδεδεμένο σε έναν υποθετικό Gpr (με G πρωτεϊνη-συνδεδεμένο
υποδοχέα). Εκτός από FadA, ο μυκηλιακός πολλαπλασιασμός επίσης εν μέρει
ρυθμίζεται από SfaD (G-πρωτεϊνική-β υπομονάδα). Flug θετικά ρυθμίζει την
παραγωγή και την έκκριση ECF που συνδέεται σε έναν υποδοχέα της κυτταρικής
επιφάνειας, DsgA και προκαλεί άφυλη σποριογένεσης εξαρτώμενο μονοπάτι που
περιλαμβάνει δύο γεγονότα: κατ' αρχάς, ενεργοποίηση από FlbA από Flug για να
εμποδίσει την FadA-εξαρτώμενη σηματοδοτική αύξηση και μετά, ενεργοποίηση από
Flug της σποριογένεσης - συγκεκριμένων λειτουργιών εξαρτώμενες από τα προϊόντα
των FlbC, FlbD και BrIA γονιδίων [19].

Εικόνα 24 [16]
Κατά την διάρκεια της ενεργοποίησης, οι GPCRs αλληλεπιδρούν με
τις συγγενείς τους G-πρωτεϊνες. G-πρωτεϊνες είναι ετεροτριμερή συνδεμένα με την
εσωτερική επιφάνεια της πλασματικής μεμβράνης. Οι τρεις υπομονάδες είναι:
G-Alpha f G-Beta και G-Gamma. Όταν σηματοδοτούν, λειτουργούν στην ουσία σαν διμερή επειδή το σήμα
επικοινωνεί είτε μέσω της G-Alpha υπομονάδας ή του G-Beta-Gamma συμπλέγματος.
Αυτήν την περίοδο υπάρχουν 20 γνωστές G-Alpha , 6 G-Beta , και 11 G-Gamma
υπομονάδες. Βάσει της ομοιότητας ακολουθίας, οι G-Alpha υπομονάδες έχουν
διαιρεθεί σε τέσσερις οικογένειες: G-AlphaS, G-Alphal, G-AlphaQ, και G-Alpha
12/13. Αυτές οι G-Alpha υπομονάδες ρυθμίζουν τη δραστηριότητα διάφορων δεύτερων
αγγελιοφόρων συστημάτων. Στην ανενεργή κατάσταση, G-Alpha έχουν GDP στην
περιοχή σύνδεσης. Όταν μια ορμόνη ή άλλο προς σύνδεση μόριο συνδεθεί στην GPCR,
μια αλλοστερική αλλαγή λαμβάνει χώρα στον υποδοχέα. Αυτό προκαλεί μια
αλλοστερική αλλαγή στην G-Alpha αναγκάζοντας το GDP να φύγει και να
αντικατασταθεί από GTP. Το GTP ενεργοποιεί G-Alpha και το αναγκάζει να χωρίσει
από το G-Beta-Gamma (που παραμένει συνδεμένο ως διμερές) [20].

Εικόνα 25 [16]
Σύνδεση IL-1 στην επιφάνεια του υποδοχέα των κυττάρων
ενεργοποιεί μία G-πρωτεϊνη ευαίσθητη στην τοξίνη του κοκκύτη, που υποκινεί στη
συνέχεια AC (adenylate cyclase) δραστηριότητα και κατά συνέπεια αυξάνει το ενδοκυττάριο επίπεδο του cAMP
(Cyclic Adenosme Monophosphate). Το cAMP ενεργοποιεί cAMP-εξαρτώμενες
πρωτεϊνικές κινάσες που παρακινεί την ενεργοποίηση NF-kappaB; μια DNA
συνδεδεμένη πρωτεϊνη που διαδραματίζει έναν σημαντικό ρόλο στο μεταγραφικό
κανονισμό του HIV-LTR και του Kappa Ig γονιδίου σε προ-B-κύτταρα [21].
Η IL-1 είναι μια κεντρική προ-φλεγμονώδης κυτοκίνη κεντρικά
εμπλεκόμενη σε τοπικές και συστηματικές αποκρίσεις στο ανοσοποιητικό σύστημα
που οδηγούν σε χαρακτηριστικά συμπτώματα της φλεγμονής. Απορρυθμισμένη,
παρατεταμένη σύνθεση και απελευθέρωση της IL-1 σε χρόνιες φλεγμονώδης καταστάσεις
συμβάλλει σε πολλές ασθένειες, π.χ. ρευματοειδής αρθρίτιδα. Η IL-1 ακόμη
αυξάνει απελευθέρωση κορτικοστεροειδών προκαλώντας πυρετό και τρέμουλο.

Εικόνα 26 [16]
Το PACAP (Pituitary Adenylate Cyclase-Activating Polypeptide)
είναι μέλος της εκκριματίνης γλυκαγόνης -VIP (Vasoactive Intestinal Peptide)
οικογένειας πεπτιδίων και διανέμεται ευρέως στον εγκέφαλο και τα απομακρυσμένα
όργανα, ειδικότερα στο ενδοκρινές πάγκρεας, τις γονάδες, και τα αναπνευστικά
και ουρογεννητικά μέρη. Μέσα στο CNS, το PACAP χρησιμεύει ως ένας
νευροδιαβιβαστής, νευροορμόνη, νευροδιαμορφωτής, εκκριματαγωγός, νευροτροφικός
παράγοντας, νευροπροστατευτικό, και ghal συσκευή επίδρασης. Τα αποτελέσματα του
PACAP μεσολαβούνται μέσω τριών τύπων GPCR (G-Protem Coupled Receptors): VPAC1
και VPAC2 υποδοχείς (Type-II) δεσμεύουν PACAP και VIP με ίσες συγγένειες, ενώ
PACAPR (Type-I; PACAP υποδοχέας) εξειδικευμένα δεσμεύει PACAP με υψηλή
συγγένεια. PACAPR είναι ιδιαίτερα άφθονος στον εγκέφαλο και τον βλεννογόνο και
στους επινεφρίδιους αδένες ενώ VPAC υποδοχείς εκφράζονται κυρίως στον πνεύμονα,
το συκώτι, και στους όρχεις [22].
Το PACAP πρόδρομο μόριο υπάρχει με δύο βιολογικά ενεργές μορφές, PACAP27 και PACAP33, από τις όποιες η PACAP27 είναι μια N-τελική κουλουριασμένη μορφή
από PACAP38. Η PACAP ασκεί
μια σειρά από ενέργειες όπως στον παράγοντα
αύξησης που εξαρτάται από την πηγή και το αναπτυξιακό στάδιο των κυττάρων. Προωθεί
την επιβίωση και προκαλεί τη βλάστηση νευρίτη από κύτταρα νευροβλάστες. Τέτοια νευροτροφικά
αποτελέσματα μεσολαβούν μέσω των G-πρωτεϊνών (G-AlphaS και
G-AlphaQ) εξαρτώμενο AC (αδενυλ - κυκλάση) μονοπάτι μέσω PKA (πρωτεϊνική κινάση-A), MAP κινάσες (MAP3Ks, MAP2Ks), ERK1/2 (εξωκυττάριες με
σήματα-ρυθμιζόμενες κινάσες) ή CBP
(CREB-συνδεδεμένη πρωτεϊνη)
και CREB (CPE- συνδεδεμένη πρωτεϊνη) φωσφορυλίωση,
η οποία έχει σαν αποτέλεσμα την αυξανόμενη c -Fos μεσολάβηση στην έκφραση των γονιδίων.
c-Fos πρωτεϊνες
μπορούν επίσης να περιπλέξουν τα μέλη των CREB/ATF1
(Ενεργοποίησης μεταγραφικό παράγοντα-1) και τις παρόμοιες αλλά ευδιάκριτες ακολουθίες
που καλούνται CRE (cAMP Responsive Element), αντίστοιχα. Ενεργοποίηση
του PACAPR μέσω PACAP ακόμη οδηγεί στην ενεργοποίηση της PLC (Phosphohpase-C)-PIP2 (Phosphatidyl Inositol 4, S-Bisphosphate) εξαρτώμενης IP3 (Inositol
1, 4, 5-Trisphosphate) παραγωγής
μαζί με DAG (Diacylglycerol). IP3 δεσμεύει στον εσωκυττάριο
υποδοχέα (IP3R), ένα προσδέτη- περιορισμένο
κανάλι Ca2+ τοποθετημένο
σε ενδοπλασματικό δύκτιο, και ωθεί την απελευθέρωση Ca2+ από τα εσωτερικά τμήματα.
Στο βλεννογόνο αδένα, και οι δύο PKA (πρωτεϊνική κινάση-A) και PKC
(πρωτεϊνική κινάση-C) περιλαμβάνονται
στο PACAP-επαγωγικό μηχανισμό
εισόδου Ca2+.[23,24].
Η PACAP επίσης αυξάνει την έκφραση από τα γονίδια νευροπεπτιδίων
μέσω ξεχωριστών cAMP (Cyclic Adenosme 3', 5'-monophosphate) και Ca2+ - σηματοδοτικών
μονοπατιών.
Όπως άλλες υποφυσιοτροπικές νευροορμόνες, η PACAP είναι
παρούσα σε επιπλέον - υποθαλαμικούς νευρώνες όπως και στους πολυάριθμους περιφεριακούς
ιστούς. Σύμφωνα με τη διαδεδομένη διανομή της, η PACAP ασκεί τα πλειοτροπικά
αποτελέσματα συμπεριλαμβανομένης της διαμόρφωσης από την απελευθέρωση
νευροδιαβιβαστών, της αγγειοδιαστολής, της βρογχοδιαστολής, της αύξησης της
έκκρισης ινσουλίνης και ισταμίνης, όπως και την υποκίνηση του πολλαπλασιασμού των
κυττάρων και/ή διαφοροποίησης. Η PACAP έχει παρουσιαστεί ως τώρα να
ενεργεί ως μια ορμόνη, μια νευροορμόνη ένας νευροδιαβιβαστής, και ένας τροφικός
παράγοντας σε διάφορους ιστούς. Στο πάγκρεας, η PACAP είναι
εντοπισμένη να περιβάλει νεύρα τοιχώματα αγγείων, εξωκρινές παρέγχυμα και από
κοινού με τις ενδοκρινείς νήσους. Απελευθερώνεται από παρασυμπαθητικά νεύρα κατα
τη λήψη της τροφής και, με την αύξηση των επιπέδων του cAMP σε
παγκρεατικά β-κύτταρα. Η PACAP ενδυναμώνει
την από γλυκόζη - υποκινούμενη έκκριση ινσουλίνης [25].

Εικόνα 27 [16]
Η βιοενεργός S-1P (Sphingosme
1-Phosphate), ένας σφιγκολιπιδικός
μεταβολίτης βρέθηκε στους οργανισμούς τόσο διαφορετικός στα φυτά, στη ζύμη, στα
σκουλήκια, στις μύγες, και στα θηλαστικά, έχει συνδεθεί με ένα ευρύ φάσμα από βιολογικές
διαδικασίες, όπως της αύξησης των κυττάρων, της επιβίωσης, κ.λ.π. Τα κυτταρικά επίπεδα
της S-1P ελέγχονται
από το σχηματισμό της από το σφιγκόσωμα μέσω της δραστηριότητας του SphK, από την υποβάθμισή του από
S-1P λιάση και S-1P φωσφατάσες. Στη
βασική κατάσταση, υπάρχει ισορροπία μεταξύ της παραγωγής S-1P και του αποτελέσματος της υποβάθμισης σε
χαμηλά κυτταρικά επίπεδα της S-1P [26]
Το P SphK είναι ένα ιδιαίτερα συντηρημένο ένζυμο που ενεργοποιείται
από τα πολυάριθμα ερεθίσματα. Η S-1P αποσπά
ποικίλες βιολογικές απαντήσεις, όπως ο πολλαπλασιασμός ινοβλάστεων, απόσυρση
νευρίτη, σηματοδότηση ασβεστίου, ρύθμιση της απόπτωσης, μορφογενετική
διαφοροποίηση, επαγωγή του ενεργοποιητή της δραστηριότητας του παράγοντα
μεταγραφής της πρωτεϊνης-1, ρύθμιση των G-πρωτεϊνης-εξαρτώμενων cAMP (cyclic Adenosme-3',
S'-Monophosphate) επιπέδων, και MAPK j μιτογόνου- ενεργοποιημένης πρωτεϊνικής
κινάσης) δραστηριότητας. Οι καλύτερα γνωστές δράσεις της S-1P διεκπεραιώνονται μέσω των υποδοχέων της
πλασματικής μεμβράνης που συνδέονται με G-πρωτεϊνες. [27]
Παρόμοια με άλλους σημαντικούς μεσολαβητές φωσφολιπιδίων, η S-1P ασκεί διπλές ενέργειες
στα κύτταρα: ενεργεί εσωκυττάρια σαν δεύτερος αγγελιοφόρος και εξωκυττάρια σαν
προσδέτης για GPCRs (με
G πρωτεϊνες-
συνδεδεμένους υποδοχείς). Η S-1P είναι
έτσι προσδέτης για ειδικούς GPCRs που ήταν αρχικά γνωστοί όπως η EDG1 (Ενδοθηλίου Διαφοροποίησης Γονίδιο -1)
οικογένεια πρωτεϊνών αλλά μετονομάστηκε πρόσφατα SIPRs (SIP Receptors). Μέχρι σήμερα, πέντε
μέλη της S1PR οικογένειας
έχει κλωνοποιηθεί συμπεριλαμβανομένου των EDG1/S1P1, EDG5/S1P2, EDG3/S1P3, EDG6/S1P4, και EDG3/S1PS που δεσμεύουν και ενεργοποιούνται συγκεκριμένα από S-1P και διύδρο-S-lP (επίσης γνωστό σαν Σφιγκαμίνης 1- Φωσφορικό
άλας). S1P1 και SIPS συνδέεται κυρίως
σε G-Alphal, S1P2 μπορεί να συνδεθεί με όλες τις G-πρωτεϊνες, S1P3 συνδέεται με G-Alphal, G-AlphaQ και G-Alphal2/13 και S1P4 ενεργοποιεί G-Alphal και G-Alphal2 αλλά όχι G-AlphaS ή G-AlphaQ/11 σε απάντηση σε S-1P. Κατά
συνέπεια, η S-1P επιρεάζει
ευδιάκριτες βιολογικές διαδικασίες εξαρτώμενες από την σχετική έκφραση των SIPPs όπως
και των G-πρωτεϊνών [28].

Εικόνα 28 [16]
[1] Ζησοπούλου Στυλιανή, Ο
ρόλος των δεύτερων αγγελιοφόρων στη διαδικασία της µνήµης – µια προσπάθεια
κατανόησης των µοριακών µηχανισµών, Μεταπτυχιακό Πρόγραµµα Σπουδών στις
Βασικές Νευροεπιστήµες, Τµήµα Ιατρικής, Πανεπιστήµιο Κρήτης.
[2] http://www.drosophila.u-bordeaux.fr/these01/images/serpent.GIF
[3] Berg J., Tymoczko J., Stryer L., Βιοχημεία, Τόμος Ι, Πανεπιστημιακές Εκδόσεις Κρήτης, Ηράκλειο 2005,
σελ. 446-450.
[4] MARTIN G. LOW, DEPT. PHYSIOLOGY, ENDOCRINE SYSTEM: FALL2003
[5] http://www.vli-research.com/Products_and_Solutions/NMR_Standards/Protein_G/Structure_Model.php
[6] http://en.wikipedia.org/wiki/G_protein
[7] Alberts, Bray, Johnson, Lewis, Raff, Roberts,
Walter, (2000). Βασικές Αρχές
Κυτταρικής Βιολογίας, Εισαγωγή στην Μοριακή Βιολογία του Κυττάρου. Ιατρικές
Εκδόσεις Π.Χ. Πασχαλίδης, Αθήνα .σελ.587-589.
[8] Πλέσσας Σ.,Κανέλλος Ε., Φυσιολογία
του Ανθρώπου 1, Εκδόσεις Φάρμακον – Τύπος, Αθήνα 1997, σελ. 74-75
[9] Guyton A., Hall J., Φυσιολογία
του Ανθρώπου και Μηχανισμοί των νόσων, Επιστημονικές Εκδόσεις Παρισιανού
Α.Ε., Αθήνα 2001, σελ.430-432.
[10] http://mcb.med.uoc.gr/mysite/arxeia/bioa2.pdf
[11] http://www.braincampaign.org/media/greek/cchap3.pdf
[12] http://bio.physics.drexel.edu/pathways/neuroreceptorPathways.pdf
[13] Osorio D, Nilsson DE.,Visual pigments: trading noise for fast recovery, Curr. Biol. 2004
Dec 29;14{24):R1051-3
[14] Arshavsky
VY, Lamb TD, Pugh EN Jr., G proteins and
phototransduction, Annu, Rev. Physiol. 2002;64:153-87
[15] Ridge KD, Abdulaev NG, Sousa M, Palczewski K.,
Phototransduction: crystal clear, Trends
Biochem. Sci. 2003
Sep;28(9):479-87
[16] http://www.proteinlounge.com/pathway_search.asp?pname=g+protein
[17] Rosen S,
Yu JH, Adams TH.,The Aspergillus nidulans
sfaD gene encodes a G protein beta subunit that is required for normal growth
and repression of sporulation, EMBOJ. 1999 Get 15; 18(20):5592-600
[18] Yu JH,
Wieser J, Adams TH., The Aspergillus FlbA
RGS domain protein antagonizes G protein signaling to block proliferation and allow
development, EMBQ J. 1996 Qct 1;15(19):5184-90
[19] Hicks JK,
Yu JH, Keller NP, Adams TH., Aspergillus
sporulation and mycotoxin
production both require
inactivation of the FadA G alpha protein-dependent signaling pathway, EMBOJ.
1997 Aug 15;16(16):4916-23
[20] Ludwig MG, Vanek M, Guenni D, Gasser JA, Jones
CE, Junker U, Hofstetter H, Wolf RM, Seuwen K. Proton-sensing G-protein-coupled receptors, Nature. 2003 Sep 4;425{6953):93-3
[21] LeMaire V, Aussel C, Herrwann A, Launay JM, Ekmdjian
QG., Stimulation of alpha-(methylamino) isohutyric
acid uptake by interleukin-
[22] Kimura H,
Kawatani M, Ito E, Ishikawa K., PACAP
facilitate the nerve regeneration factors in the facial nerve injury, Regul
Pept, 2004 Dec 15; 123(l-3):135-8
[23] Zusev M,
Gozes I., Differential regulation
of activity-dependent neuroprotective protein
in rat astrocytes hy VIP and
PACAP, Regul Pept, 2004 Dec 15; 123(l-3):33-41
[24]
Falluel-Morel A, Aubert N, Vaudry D, Basille M, Fontaine M, Fournier A, Vaudry
H, Gonzalez BJ., Opposite regulation of
the mitochondrial apoptotic pathway hy C2-ceramide and PACAP through a
MAP-kinase-dependent mechanism in cerehellar granule cells, J Neurochem.
2004 Dec; 91{5):1231-43
[25] Sokolowska P, Dejda A, Nowak JZ., Neuroprotective role of PACAP, VIP, and PHI
in the central nervous system, Postepy Hig Med Dosw (Online). 2004 Nov 24;
58:416-27. Polish.
[26] Pitson SM,
Moretti PA, Zebol JR, Lynn HE, Xia P, Vadas MA, Wattenberg BW. Activation of sphingosine kinase 1 by
ERKl/2-mediated phosphorylation, EMBQ J, 2003 Oct 15; 22(20):5491-500
[27] Kluk MJ,
Hla T., Signaling of
sphingosine-1-phosphate via the SIP/EDG-family of G-protein-coupled receptors,
Biochim Biophys Acta, 2002 May 23; 1582(l-3):72-80. Review
[28] Spiegel S,
Kolesnick R., Sphingosine 1-phosphate as
a therapeutic agent, Leukemia. 2002 Sep; 16(9):1596-602. Review.
7. Ο ρόλος της χοληστερόλης στη δομή των κυτταρικών μεμβρανών.
Μηχανισμοί εμπλοκής της στην αθηρωμάτωση
Ο ρόλος της χοληστερόλης στη δομή των κυτταρικών μεμβρανών
Εισαγωγή
Τα στεροειδή αποτελούν μια ομάδα λιπιδίων, η δομή των οποίων
βασίζεται σε τέσσερις συνδεόμενους δακτυλίους άνθρακα. Τα πιο άφθονα στεροειδή
είναι οι στερόλες με πλέον χαρακτηριστικό εκπρόσωπο τη χοληστερόλη. Η
χοληστερόλη αποτελεί βασικό συστατικό των πλασματικών μεμβρανών στα ζωικά
κύτταρα, ενώ παρόμοιες στερόλες υπάρχουν και στην πλασματική μεμβράνη των
φυτικών κυττάρων. Στην ομάδα των στεροειδών ανήκουν και διάφορες ορμόνες των
ζωικών οργανισμών, όπως οι σεξουαλικές ορμόνες και οι ορμόνες των επινεφριδίων
που ρυθμίζουν την κυτταρική αύξηση και δράση.[1]
Στα περισσότερα ζωικά κύτταρα, τα λιπίδια αποτελούν το 30-50%
της πλασματικής μεμβράνης. Το ποσοστό αυτό μεταβάλλεται ανάλογα με τον
κυτταρικό τύπο. Στις μεμβράνες των ζωικών και των φυτικών κυττάρων υπάρχουν
τρεις κύριες τάξεις λιπιδίων: τα φωσφογλυκερίδια, τα σφιγγολιπίδια και οι
στερόλες.
α. Τα φωσφογλυκερίδια και ορισμένα σφιγγολιπίδια που περιέχουν
φωσφορικές ομάδες, ονομάζονται φωσφολιπίδια. Το κυριότερο χαρακτηριστικό των
φωσφολιπιδίων είναι ο αμφίτροπος χαρακτήρας που παρουσιάζουν. Το γνώρισμα αυτό
επιτρέπει τη δημιουργία λιπιδιακής διπλοστοιβάδας, η οποία αποτελεί το
κυριότερο δομικό συστατικό για την οργάνωση των κυτταρικών μεμβρανών. Λιπίδια
που έχουν συνδεθεί με μια υδατανθρακική ομάδα ονομάζονται γλυκολιπίδια.
β. Στα σφιγγολιπίδια, η γλυκερόλη έχει αντικατασταθεί από την
αμινική αλκοόλη σφιγγοσίνη. Όταν στα σφιγγολιπίδια συνδέεται υδατανθρακική
ομάδα, δημιουργούνται τα γλυκοσφιγγολιπίδια. Τα γλυκοσφιγγολιπίδια είναι
ιδιαιτέρως άφθονα στις πλασματικές μεμβράνες των νευρικών κυττάρων και των
κυττάρων του εγκεφάλου. Τα σφιγγολιπίδια συντελούν στη σταθεροποίηση της
μεμβράνης, αλλά διαδραματίζουν και άλλους ρόλους. Αποτελούν, ως
γλυκοσφιγγολιπίδια π.χ. σήματα αναγνώρισης της κυτταρικής επιφάνειας για τον
καθορισμό των ομάδων αίματος του συστήματος ΑΒΟ, ενώ μπορούν να συνδεθούν με
ορισμένους ιούς και τοξίνες, διευκολύνοντας έτσι την είσοδο τους μέσα στο
κυτταρόπλασμα. Σφάλματα στο μεταβολισμό των γλυκοσφιγγολιπιδίων προκαλούν
σοβαρές ασθένειες στον άνθρωπο (π.χ. το σύνδρομο Tay-Sachs). Στην περίπτωση
αυτή η αύξηση των γλυκοσφιγγολιπιδίων παρεμποδίζει τη λειτουργία των νευρικών
και των εγκεφαλικών κυττάρων με αποτέλεσμα την παράλυση και την πνευματική
καθυστέρηση των ατόμων.
γ. Η χοληστερόλη (Εικόνα 1) αποτελεί την κυριότερη στερόλη των
πλασματικών μεμβρανών. Η πλασματική μεμβράνη των ζωικών κυττάρων περιέχει σε
πολλές περιπτώσεις τόση χοληστερόλη όσο και φωσφολιπίδια. Χοληστερόλη υπάρχει
και στις ενδοκυτταρικές μεμβράνες, αλλά σε πολύ μικρά ποσοστά. Οι μεμβράνες των
φυτών περιέχουν πολύ μικρές ποσότητες χοληστερόλης αλλά μεγάλες ποσότητες
συγγενών στερολών που ονομάζονται φυτοστερόλες. Στα βακτήρια και στα
κυανοβακτήρια δεν υπάρχουν σχεδόν καθόλου στερόλες. Σε ορισμένους όμως
προκαρυωτικούς οργανισμούς έχει βρεθεί μια ομάδα μορίων που μοιάζουν με τις
στερόλες, τα οπανοειδή (hopanoids).[2]

Εικόνα
1 [2]
ΚΥΤΤΑΡΙΚΕΣ ΜΕΜΒΡΑΝΕΣ
Γενικά
Οι κυτταρικές μεμβράνες έχουν σαν κύρια αποστολή την οργάνωση
και τη διατήρηση του κυττάρου ως μιας ξεχωριστής οντότητας. Ταυτόχρονα
οργανώνουν και διατηρούν στο εσωτερικό του κυττάρου διακριτά μοριακά
μικροπεριβάλλοντα, σχηματίζοντας τα υποκυτταρικά οργανίδια, τα οποία όμως, όπως
θα αναφερθεί λίγο πιο κάτω, συνδέονται μεταξύ τους λειτουργικά αλλά και δομικά.
Η πλασματική μεμβράνη αποτελεί το σημείο συνάντησης δύο κόσμων (του
ενδοκυτταρικού και του εξωκυτταρικού) και αποτελείται από φωσφολιπίδια και
πρωτεΐνες, όπως ακριβώς συμβαίνει και με τις ενδοκυτταρικές μεμβράνες. Όλες οι
κυτταρικές μεμβράνες είναι δυναμικές ρευστές δομές μέσα στις οποίες οι
πρωτεΐνες έχουν την ικανότητα περιορισμένης μετακίνησης στο επίπεδο της
μεμβράνης. Η πλασματική μεμβράνη έχει μικρότερη ρευστότητα από τις
ενδοκυτταρικές μεμβράνες των κυτταρικών οργανιδίων. Σημαντική επίδραση στη
ρευστότητα, την ελαστικότητα αλλά και στη μηχανική στερεότητα των μεμβρανών
διαδραματίζει η χοληστερόλη. Λόγω της θέσης που παίρνει η χοληστερόλη μέσα στη
λιπιδιακή διπλοστοιβάδα θεωρείται το "αντιπηκτικό" των κυτταρικών
μεμβρανών.[3]
Λειτουργίες της
χοληστερόλης ως δομικού στοιχείου
Μεγάλα ποσά χοληστερόλης περιέχονται, τόσο στην κυτταρική
μεμβράνη όσο και στις μεμβράνες των ενδοκυττάριων οργανυλλίων όλων των
κυττάρων.
Για το σχηματισμό των μεμβρανών απαιτείται η διαθεσιμότητα ουσιών
που δεν είναι υδατοδιαλυτές. Κατά γενικό κανόνα, οι μόνες ουσίες στο σώμα που
δεν είναι υδατοδιαλυτές (εκτός από τα ανόργανα συστατικά των οστών), είναι τα
λιπίδια και ορισμένες πρωτεΐνες. Έτσι, η φυσική ακεραιότητα των κυττάρων σε
ολόκληρο το σώμα, στηρίζεται κυρίως στα φωσφολιπίδια, χοληστερόλη και ορισμένες
αδιάλυτες πρωτεΐνες. Οι πολικές μεταβολές, ιδιαίτερα των φωοφολιπιδίων, περιορίζουν
επίσης τη μεσεπιφανειακή τάση μεταξύ των μεμβρανών και του υγρού περιβάλλοντος.
Ένα άλλο γεγονός, δηλωτικό της σημασίας τηςχοληστερόλης για το
σχηματιομό των δομικών στοιχείων των κυττάρων είναι η βραδεία εναλλαγή της
στους περισσοτέρους ιστούς του σώματος, εκτός από το ήπαρ - ρυθμός εναλλαγής
που μετράται σε μήνες ή ακόμα και έτη. Για παράδειγμα, η λειτουργία της στα
εγκεφαλικά κύτταρα συσχετίζεται κυρίως με τις ιδιότητες αφθαρσίας της.[4]
Ρευστότητα των κυτταρικών
μεμβρανών
Οι λιπιδιακές διπλοστοιβάδες παρουσιάζουν το χαρακτηριστικό
φαινόμενο της μετάπτωσης φάσεων, δηλ. “λειώνουν” και “παγώνουν” πάνω ή κάτω από
μια συγκεκριμένη θερμοκρασία. Πάνω από τη θερμοκρασία της μετάπτωσης φάσεων η
λιπιδιακή διπλοστοιβάδα βρίσκεται σε μια υγρή κατάσταση. Όλες οι βιολογικές
μεμβράνες πρέπει να κρατηθούν σε μια θερμοκρασία πάνω από τη θερμοκρασία
μετάπτωσης φάσεων για να είναι λειτουργικές. Η μετάπτωση φάσεων της λιπιδιακής
διπλοστοιβάδας είναι αποτέλεσμα της μεταβολής της κινητικότητας των αλειφατικών
αλυσίδων που προκαλείται από τις αλλαγές της θερμοκρασίας. Η θερμοκρασία στην
οποία θα συμβεί η μετάπτωση φάσεων της λιπιδιακής διπλοστοιβάδος εξαρτάται
άμεσα από το μήκος και το βαθμό κορεσμού των αλειφατικών αλυσίδων. Γενικά, όσο
μεγαλύτερο είναι το μήκος των αλειφατικών αλυσίδων, τόσο υψηλότερη είναι η
θερμοκρασία στην οποία παρατηρείται η μετατροπή φάσεων. Τα μη κορεσμένα λιπαρά
οξέα σχηματίζουν κόμβους και βρίσκονται σε μια τυχαία, πιο ρευστή, διαμόρφωση
καθώς έχουν την τάση να σχηματίζουν λιγότερο σταθερούς δεσμούς van der Waals με
άλλα λιπίδια.
Λόγω της υγρής κατάστασης στην οποία βρίσκεται η λιπιδιακή
διπλοστοιβάδα, ένα φωσφολιπίδιο μπορεί να κινηθεί πλευρικά (φαινόμενο που
ονομάζεται πλευρική διάχυση) μέσα στη δική του μονοστοιβάδα. Ο συντελεστής
διάχυσης είναι μεγάλος, περίπου 10-8 cm2 /sec. Έτσι, ένα φωσφολιπίδιο μπορεί να
“ταξιδέψει” καθόλο το μήκος ενός μικρού κυττάρου (π.χ. ενός βακτηρίου) σε
λιγότερο από ένα δευτερόλεπτο. Για ένα τυπικό ζωικό κύτταρο ο χρόνος αυτός
αυξάνεται στα 20 δευτερόλεπτα. Η μετακίνηση όμως αυτή είναι πλευρική και
γίνεται μέσα στην ίδια λιπιδιακή μονοστοιβάδα. Πάντως, λόγω των πλευρικών
αλληλεπιδράσεων των φωσφολιπιδίων με άλλα βιολογικά μόρια (κυρίως πρωτεΐνες) η
απόσταση πλευρικής μετακίνησης περιορίζεται σημαντικά. Η μετακίνηση ενός μορίου
από τη μια λιπιδιακή μονοστοιβάδα στην άλλη, ονομάζεται flip-flop, είναι πολύ
πιο αργή και διαρκεί αρκετές ώρες. Όμως, στις μεμβράνες του ενδοπλασματικού
δικτύου η μετακίνηση αυτή είναι σχετικά γρήγορη διότι διευκολύνεται από ειδικές
πρωτεΐνες.
Η προσθήκη χοληστερόλης στις μεμβράνες επηρεάζει άμεσα τη
ρευστότητα των μεμβρανών. Σε ποσοστό πάνω από 20% και σε θερμοκρασίες στις
οποίες ζουν οι περισσότεροι οργανισμοί, η χοληστερόλη διατηρεί πάντα την υγρή
κατάσταση της λιπιδιακής διπλοστοιβάδος. Την ίδια στιγμή περιορίζει τη γρήγορη
μετακίνηση των αλειφατικών αλυσίδων και μειώνει τη ρευστότητα των μεμβρανών.
Έτσι, η χοληστερόλη δρα κατά δύο τρόπους: αυξάνει τη ρευστότητα των μεμβρανών
σε χαμηλές θερμοκρασίες και την ελαττώνει σε υψηλότερες. Για το λόγο αυτό η
χοληστερόλη χαρακτηρίζεται ως “πλαστικοποιητής” ή “αντιπηκτικό” των κυτταρικών
μεμβρανών. Οι ιδιότητες αυτές της χοληστερόλης είναι πολύ σημαντικές για την
πλασματική μεμβράνη, η οποία εκτίθεται άμεσα στο περιβάλλον, και για το λόγο
αυτό στην πλασματική μεμβράνη υπάρχουν μεγάλα ποσά χοληστερόλης. Στις
ενδοκυτταρικές μεμβράνες, όπως ήδη αναφέρθηκε νωρίτερα, τα ποσοστά της
χοληστερόλης είναι πολύ μικρότερα.[5]
Στα ζωικά κύτταρα η ρευστότητα των μεμβρανών τροποποιείται από
την παρουοία της στερόλης χοληστερόλη, η οποία απουσιάζει από τα φυτά. τους
ζυμομύκητες και τα βακτήρια. Τα μικρά και άκαμπτα μόρια της χοληστερόλης
βρίσκονται σε σημαντικά μεγάλες ποσότητες στην κυτταρική μεμβράνη, όπου
καλύπτουν τα κενά, που σχηματίζονται ανάμεσα σε γειτονικά μόρια φωσφολιπιδίων,
από τις κάμψεις των ακόρεστων υδρογονανθρακικών αλυσίδων (Εικόνα 2). Με αυτόν
τον τρόπο, η χοληστερόλη ενισχύει την ακαμψία της διπλοστιβάδας, καθιστώντας
την λιγότερο ρευστή και λιγότερο διαπερατή.[6]

Εικόνα 2 [6]
Η ρευστότητα των βιολογικών μεμβρανών (Εικόνα 3) δεν επηρεάζεται
μόνο από τους χημικούς παράγοντες οι οποίοι αναφέρθηκαν νωρίτερα. Επηρεάζεται
επίσης και από φυσικούς παράγοντες. Έτσι, εκτός από το μήκος των αλειφατικών
αλυσίδων, τον αριθμό των διπλών δεσμών, το ποσό της χοληστερόλης και τον αριθμό
των μεμβρανικών πρωτεϊνών (χημικοί παράγοντες), η μεμβρανική ρευστότητα
εξαρτάται επίσης από τη θερμοκρασία, την πίεση, το pH, το μεμβρανικό δυναμικό
και τη συγκέντρωση των ιόντων Ca2+ στο άμεσο μικροπεριβάλλον της
(φυσικοί παράγοντες) [5]

Εικόνα 3 Ρευστότητα πλασματικών μεμβρανών [5]
Επίδραση της αύξησης της χοληστερόλης
στη ρευστότητα των μεμβρανών και στη λειτουργία των κυττάρων στα ερυθροκύτταρα
του ανθρώπου.
Η χοληστερόλη και το φωσφολιπίδιο είναι τα δύο σημαντικά λιπίδια
της μεμβράνης των ερυθροκυττάρων. Η χοληστερόλη είναι αδιάλυτη στο ύδωρ αλλά
διαλυτοποιείται από τα φωσφολιπίδια και στις μεμβράνες και στις λιποπρωτεϊνες του
πλάσματος. Πολύ συχνα έχουμε, ανταλλαγές χοληστερόλης μεταξύ των μεμβρανών και
των λιποπρωτεϊνών. Ένα χώρισμα ισορροπίας καθιερώνεται βασισμένο στο ποσό
χοληστερόλης σχετικά με το φωσφολιπίδιο (C/PL) σε
αυτά τα δύο διαμερίσματα. Αυξήσεις στο C/PL στις μεμβράνες των ερυθροκυττάρων έχουν μελετηθεί κάτω από τρείς
συνθήκες: Κατ' αρχάς, αυθόρμητες αυξήσεις in vivo έχουν παρατηρηθεί σε ανώμαλα ερυθροκύτταρα
από ασθενείς με σοβαρή ασθένεια στο ήπαρ; δεύτερον, παρόμοιες αλλαγές ερυθροκυττάρων
in vivo έχουν
προκληθεί με την καθοδηγούμενη διατροφή σε χοληστερόλη – εμπλουτισμένες τροφές
στα τρωκτικά και τα σκυλιά; τρίτον, αυξήσεις στη χοληστερόλη των μεμβρανών έχουν
προκληθεί in vitro με τον εμπλουτισμό του C/PL του περιβάλλοντος των λιποπρωτεϊνών με χοληστερόλη - διασπορές
φωσφολιπιδίων (λιποσώματα) έχοντας C/PL μεγαλύτερο από 1.0. Σε κάθε περίπτωση, υπάρχει μια στενή σχέση
μεταξύ C/PL από
το περιβάλλον πλάσματος και C/PL από
μεμβράνη ερυθροκυττάρων. In vivo,
η C/PL αναλογία σε τυφλοπόντικα
σε μεμβράνες ερυθροκυττάρων κειμένονται από τιμές 0.09 - 1.0 σε τιμές που
προσεγγίζουν αλλά δεν φθάνουν 2.0. In vitro, αυτή η αναλογία πλησιάζει 3.0. Εμπλουτισμός χοληστερόλης των
μεμβρανών των ερυθροκυττάρων άμεσα επιδρά στη ρευστότητα των λιπιδίων των μεμβρανών,
όπως αξιολογείται από την περιστροφική διάχυση από υδροφοβικούς δείκτες φθορισμού
όπως το διφαινυλικό εξατριένιο (DPH).
Ένας στενός συσχετισμός υπάρχει μεταξύ αυξλησεων C/PL σε μεμράνες ερυθροκυττάρων και
μειώσεων στη ρευστότητα των μεμβρανών πάνω από το εύρος μεμβρανικών C/PL από 1.0 σε
2.0; εντούτοις, μικρή περαιτέρω αλλαγή στη ρευστότητα εμφανίζεται όταν C/PL της μεμβράνης
αυξάνεται σε 2.0 - 3.0. Εμπλουτισμός χοληστερόλης σε μεμβράνες ερυθροκυττάρων συνδέεται
με το μετασχηματισμό κυτταρικού περιβλήματος σε ένα που είναι περιττός και
διπλωμένος, και αυτό συνδέεται με μια μείωση διηθητικότητας των ερυθροκυττάρων in vitro. Κυκλοφορία in vivo παρουσία
της σπλήνας περαιτέρω τροποποιεί το κυτταρικό σχήμα σε μία ακανθωτή, ανώμαλη (spur) μορφή, και η επιβίωση των
ερυθροκυττάρων πλούσιων σε χοληστερόλη μειώνεται παρουσία της σπλήνας. Αν και η
ενεργός μεταφορά Na-K δεν
επηρεάζεται από τη χοληστερόλη εμπλουτισμός από ανθρώπινα ερυθροκύτταρα, διάφορα
μονοπάτια οδηγούμενων-μεσολαβημένων μεταφορών εμποδίζονται. Έχουμε καταδείξει αυτή
την επίδραση για την συνμεταφορά των Na και K και παρόμοια αποτελέσματα έχουν
επιτευχθεί από άλλους στις μελέτες της μεταφοράς οργανικού οξέος και τη
μεταφορά μικρών ουδέτερων μορίων όπως η ερυθριτόλη και η γλυκερίνη. Κατά συνέπεια,
C/PL μεμβράνης ερυθροκυττάρων
είναι ευαίσθητα σε C/PL από
το περιβάλλον πλάσματος. Αυξανόμενη C/PL μεμβράνης προκαλεί μια μείωση στη ρευστότητα των μεμβρανών, και
αυτές οι αλλαγές συνδέονται με μια μείωση της διαπερατότητας μεμβρανών, μια
διαστρέβλωση του περιβλήματος των κυττάρων και της διαπερατότητας και έναν
περιορισμό της επιβίωσης των ερυθροκυττάρων in vivo. [7]
Αρτηριοσκλήρωση
Από τις παθήσεις των αγγείων η μεγαλύτερη προσοχή, λόγω ίσως της
εμφανούς κλινικής σημασίας της, έχει αποδοθεί στην αρτηριοσκληρωτική
αγγειοπάθεια η οποία αναφέρεται με τον όρο αρτηριοσκλήρωση. Η αρτηριοσκλήρωση
περιλαμβάνει ομάδα διαταραχών οι οποίες ως κοινό χαρακτηριστικό έχουν την
πάχυνση και την απώλεια της ελαστικότητας του αρτηριακού τοιχώματος.
Τρεις οντότητες οι οποίες διαφέρουν μορφολογικά, περιλαμβάνονται
στον όρο αρτηριοσκλήρωση.
•Η αθηροσκλήρυνση, χαρακτηρίζεται από το σχηματισμό του
αθηρώματος στον έσω χιτώνα της αρτηρίας.
•Η αγγειίτιδα τύπου Monckeberg, χαρακτηρίζεται από την επασβέστωση του μέσου χιτώνα
των αρτηριών.
•Η αρτηριολοσκλήρυνση, η οποία διακρίνεται από την εναπόθεση
υαλίνης και την πάχυνση του τοιχώματος των μικρών αρτηριών και των αρτηριολίων.
Επειδή η αθηροσκλήρυνση είναι η πλέον κοινή και ίσως η με τη μεγαλύτερη
κλινική σημασία μορφή της αρτηριοσκλήρωσης και οι δύο όροι συνήθως
χρησιμοποιούνται χωρίς διάκριση εκτός και αν ειδικά προσδιορίζονται1. Το
έμφραγμα του μυοκαρδίου και τα οξέα εγκεφαλικά επεισόδια είναι οι πλέον
επικίνδυνες συνέπειες της νόσου καθώς επίσης η χρόνια ισχαιμική καρδιοπάθεια, η
γάγγραινα των κάτω άκρων, η απόφραξη της μεσεντερίου αρτηρίας και η ισχαιμική
εγκεφαλοπάθεια.
Η αθηροσκλήρυνση είναι εξελισσόμενη νόσος η οποία αρχίζει νωρίς
από την παιδική ηλικία αλλά οι κλινικές εκδηλώσεις παρουσιάζονται συνήθως κατά
τη μέση ηλικία ή αργότερα. Ως βασική μορφολογική αλλοίωση θεωρείται η
αθηρωματική πλάκα ή αθήρωμα. Σχηματίζεται στον έσω χιτώνα της αρτηρίας και αναπτύσσεται
αργά και αθόρυβα χωρίς κλινικά συμπτώματα επί σειρά ετών. Είναι ένα
περιγεγραμμένο μόρφωμα όπου διακρίνεται ένας πυρήνας λιπιδίων, κυρίως
χοληστερόλης, συνήθως σε συμπλεγματα με πρωτείνες και εστέρες χοληστερόλης ο
οποίος καλύπτεται από ινώδη μανδύα. Μεγαλώνοντας σε μέγεθος προοδευτικά
πα-ρεισδύει στον αυλό του αγγείου αλλά και στον υποκείμενο μέσο χιτώνα. Κατά
συνέπεια ο αυλός του αγγείου σμικρύνεται αλλά και το τοίχωμα εξασθενίζει. Ως
επιπλοκές της στοιχειώδους βλάβης μπορεί να θεωρηθούν η επασβέστωση, η
εξέλκωση, ο σχηματισμός θρόμβου ή ανευρύσματος.[8]

Εικόνα 4 [8]
Η υπερλιποπρωτεϊναιμία ή υπερλιπιδαιμία και κυρίως η
υπερχοληστερολοιμία θεωρείται ως ένας από τους σημαντικούς παράγοντες κινδύνου
για την αθηροσκλήρυνση. Αν και η υπερτριγλυκεριδαιμία δεν πρέπει να υποτιμάται
η υπερχοληστερολαιμία (αύξηση της συγκεντρώσεως στο πλάσμα των LDL, VLDL υπολειμμάτων) συνδέεται αιτιολογικά
με την πρόωρη εμφάνιση της στεφανιαίας νόσου. Η διασύνδεση μεταξύ
υπερχοληστερολαιμίας και αθηρογένεσης προκύπτει από ορισμένες διαπιστώσεις
όπως:
1. Το αθήρωμα είναι πλούσιο σε χοληστερόλη και εστέρες χοληστερόλης
που κυρίως προέρχονται από τις λιποπρωτείνες του αίματος.
2. Σε πειραματόζωα, δίαιτα πλούσια σε χοληστερόλη οδήγησε στην ανάπτυξη
αθηρωμάτων.
3. Γενετικές διαταραχές που προκαλούν σημαντική αύξηση της συγκεντρώσεως
της χοληστερόλης στο αίμα οδηγούν στην εμφάνιση πρόωρης αρτηριοσκληρωτικής
αγγειοπάθειας.
4. Σε πληθυσμούς όπου τα επίπεδα της χοληστερόλης στο αίμα είναι
υψηλά παρατηρείται μεγάλη θνησιμότητα από ισχαιμική καρδιοπάθεια.
5. Σημαντική ελάττωση της LDL χοληστερόλης συνεπάγεται (ως ένα βαθμό) υποστροφή της
αθηρωμα-τικής βλάβης. Πρόσφατες μελέτες, επιβεβαιωμένες από αγγειογραφικά
δεδομένα, έδειξαν ότι ελάττωση της συγκεντρώσεως της χοληστερόλης στο αίμα σε
υπερχοληοτερολαιμικούς πληθυσμούς οδήγησε σε υποστροφή της αθηρωματικής πλάκας
και σε σημαντική ελάττωση της καρδιαγγειακής θνητότητας. Ρυθμιστικό ρόλο στη συγκέντρωση
των λιποπρωτεϊνών και της χοληστερόλης στο πλάσμα παίζει το ήπαρ, Κατέχοντος
κεντρικό ρόλο στο μεταβολισμό της χοληστερόλης και των λιπαρών οξέων,
κατευθύνει την απόδοση τους στους περιφερικούς ιστούς. Χοληστερόλη και λιπαρά
οξέα συντίθενται στο ήπαρ και αποδίδονται στην κυκλοφορία υπό τη μορφή
λιποπρωτεϊνών. Η συγκέντρωση των τελευταίων στο πλάσμα, υπό "φυσιολογικές
συνθήκες", είναι αποτέλεσμα της ισορροπίας η οποία εγκαθίσταται ανάμεσα
στην ταχύτητα με την οποία εκκρίνομαι από το ήπαρ, παραλαμβάνονται από τους
ιστούς και επαναπροσλαμβάνονται από το ήπαρ.[9]
Χοληστερόλη
Η χοληστερόλη αποτελεί δομικό και λειτουργικό στοιχείο του
κυττάρου και η παροχή της προς τους ιστούς πρέπει να είναι συνεχής και
ικανοποιητική. Χοληοτερόλη παραλαμβάνεται με την τροφή (Εικόνα 5).

Εικόνα 5 [9]
Οι ανάγκες των κυττάρων σε χοληοτερόλη καλύπτονται από την παρεχόμενη
με την τροφή χοληστερόλη ή από de novo
σύνθεση. Παρ' ότι πρόκειται για εντελώς διάφορες διεργασίες, η μία ρυθμίζει την
άλλη. Η σύνθεση της χοληστερόλης είναι δυνατή από όλους τους ιστούς, Τα κύτταρα
όμως, εκτός των ηπατικών και του εντερικού επιθηλίου, παίρνουν χοληστερόλη από
το αίμα παρά συνθέτουν, ώστε το κύτταρο να εξοικονομεί ενέργεια και δομικούς
λίθους, αν και η κυτταρική σύνθεση της ποτέ δεν μηδενίζεται.
Η διακίνηση της χοληστερόλης στον οργανισμό γίνεται με τις
λιποπρωτεΐνες. Το ήπαρ θεωρείται η δεξαμενή της χοληστερόλης στον οργανισμό (Εικόνα
6). Ρυθμίζει δύο διεργασίες. Την ισορροπία της διακινήσεως της χοληστερόλης
μεταξύ των οργάνων, δηλαδή την ομοιόσταση της χοληστερόλης στον οργανισμό και
τη σταθερή κατάσταση της συγκεντρώσεως της LDL χοληοτερόλης οτο πλάσμα.[9]

Εικόνα 6 [9]
Η χοληστερόλη της ενδοηπατικής δεξαμενής προέρχεται:
1. Από τη χοληστερόλη της τροφής.Τα υπολείμματα των χυλομικρών
φέρνουν στο ήπαρ τηχοληστερόλη της τροφής ή τη χοληστερόλη που συντίθεται στο έντερο.
2. Από τη χοληστερόλη που συντίθεται στους εξωηπατικούς ιστούς
και έρχεται στο ήπαρ με τις HDL.
3. Από de novo
σύνθεση της χοληστερόλης στο ήπαρ.
Η χοληστερόλη εκκρίνεται από το ήπαρ:
1. Με τις λιποπρωτεϊνες ως VLDL ή ΗDL.
2. Ως ελεύθερη χοληστερόλη, αποβάλλεται με τη χολή.
3. Μετατρέπεται σε χολικά οξέα και εκκρίνεται με τη χολή.
Για να διατηρείται σταθερή η συγκέντρωση της ενδοηπατικής δεξαμενής
της χοληστερόλης (σταθερή κατάσταση} πρέπει η ταχύτητα με την οποία συντίθεται
η χοληστερόλη στο ήπαρ να ισούται με την ταχύτητα αποβολής της χοληστερόλης με
τη χολή, ως ελεύθερη χοληστερόλη και χολικά οξέα, αφού αφαιρεθεί η ταχύτητα με
την οποία αποδίδεται η χοληστερόλη στο ήπαρ από το έντερο (τροφή) και τους
εξωηπατικούς ιστούς (ΗDL).
Η ηπατική σύνθεση της χοληστερόλης καταστέλλεται όταν αυξάνει η απόδοση της από
το έντερο και αυξάνει όταν η αποβολή με τα κόπρανα επιταχύνεται.
Στα κύτταρα, ανάλογα με τη μεταβολική ιδιαιτερότητα του κάθε
ιστού, η χοληστερόλη έχει τη δυνατότητα να ακολουθήσει τρεις μεταβολικούς
δρόμους:
1. Να εστεροποιηθεί και να αποθηκευθεί. Οι σχηματιζόμενοι εστέρες
χοληστερόλης θα υδρολυθούν όταν το κύτταρο χρειάζεται ελεύθερη χοληστερόλη.
2. Να μετατραπεί σε χολικά οξέα.
3. Να χρησιμοποιηθεί ως υπόστρωμα για τις στεροειδείς ορμόνες ή
ως δομικό στοιχείο (μεμβράνες).
Η χοληστερόλη κατέχει και ρόλο ρυθμιστικού παράγοντα σε διεργασίες
που αφορούν τη μεταγραφή των γονιδίων, την αποικοδόμηση πρωτεϊνών ή τον έλεγχο
της ενζυμικής δραστικότητας.
Βιοσύνθεση χοληστερόλης
Υπόστρωμα για την de novo σύνθεση της χοληστερόλης αποτελεί το ακετυλο-συνένζυμο Α,
ακετυλο CοΑ, (Εικόνα
6). Το ακετυλο CοΑ
προέρχεται σχεδόν από όλες τις τροφές αφού είναι προϊόν καταβολισμού των
υδατανθράκων, των λιπαρών οξέων και πολλών αμινοξέων. Η βιοσύνθεση της
χοληστερόλης και η ρύθμιση που υφίσταται, αποτελούν έναν από τους νευραλγικούς
τομείς της έρευνας η οποία επικεντρώνεται κυρίως σε δύο σημεία:
1. Στη μελέτη των γονιδίων τα οποία ελέγχουν τα ένζυμα που
μετέχουν στον καταρράκτη της βιοσυνθετι-κής οδού της χοληστερόλης.
2. Στην ανάπτυξη αναστολέων με τους οποίους θα παρέχεται η δυνατότητα
να ρυθμίζεται η υπερχο-ληστερολαιμία.
Κοινός ρυθμιστικός μηχανισμός φαίνεται ότι ελέγχει την έκφραση, τουλάχιστον
στο στάδιο της μεταγραφής, των γονιδίων που ελέγχουν τα ένζυμα (Εικόνα 7) ΗΜGCοΑ συνθετάση
(3υδροξυ-3μεθυλογλουτα-ρυλο-συνένζυμοΑ συνθετάση), ΗΜGCοΑ αναγωγάση
(3υδροξυ-3με-θυλογλουταρυλο-συνένζυμοΑ αναγω-γάση), μεβαλονική κινάση,
ΡΡΡ-συνθετάση (φαρνεσυλοπυροφω-σφορικό συνθετάση) και τους LDL υποδοχείς.[9]

Εικόνα 7 [9]
Ως ένζυμο κλειδί στη βιοσύνθεση της χοληστερόλης παρουσιάζεται η
ΗΜGCοΑ αναγωγάση, η
δραστικότητα της οποίας ελέγχει και την ομοιόσταση της χοληστερόλης στον
οργανισμό. Η χρησιμοποίηση μιας τάξεως αναστολέων του ενζύμου, οι οποίοι
προέρχονται από μύκητες (λοβαατατίνη, σιμβαστατίνη, πρα-βαστατίνη) ως ισχυρών
αντιυπερχο-ληστερολαιμικών φαρμάκων συνηγορεί υπέρ αυτού. Η δραστικότητα της ΗΜGCοΑ αναγωγάσης εξαρτάται από
το ποσό της ενζυμικής πρωτεΐνης, de novo σύνθεση και αποικο-δόμηση, από τη
φωσφορυλίωση του ενζύμου, από τη γλουταθειόνη η οποία ενεργοποιεί το ένζυμο
μέσω του μηχανισμού της οξείδωσεως/αναγωγής των σουλφυδρίλικών ομάδων και από
την ενδοκυττάρια συγκέντρωση της χοληστερόλης.[9]
Υπάρχουν δύο μορφές του ενζύμου. Η φωσφορυλιωμένη μορφή (μη
δραστική μορφή) και η αποφωσφορυ-λιωμένη (δραστική μορφή). Η μία μορφή
μεταπίπτει στην άλλη (Εικόνα 8). Η φωσφορυλίωση γίνεται μέσω του μηχανισμού cΑΜΡ —> πρωτεϊνική κινάση,
ο οποίος ελέγχει τη δραστικότητα πολλών ενζυμικών συστημάτων και ενεργοποιείται
από τη γλουκαγόνη, ενώ η αποφωσφορυλίωση μέσω μιας ειδικής φωσφατάσης. η οποία ενεργοποιείται
από την ινσουλίνη. Δηλαδή η ινσουλίνη ευνοεί τη μετατροπή της μη δραστικής
μορφής του ενζύμου σε δραστική, ενώ η γλουκαγόνη το αντίθετο. Η χορήγηση της
τριϊωδοθυρονίνης αυξάνει τη δραστικότητα της ΗΜGCοΑ αναγωγάσης, ενώ της κορτιζάλης την
ελαττώνει.
Εκτός από ορμόνες (γλουκαγόνη) ο μηχανισμός cΑΜΡ à
πρωτεϊνική κινάση, ο οποίος στην προκειμένη περίπτωση παίζει προστατευτικό ρόλο
για το κύτταρο, ενεργοποιείται και από ενδοκυττάριους μεταβολίτες της χοληστερόλης,
των λιπαρών οξέων και από το λόγο της συγκεντρώσεως του ΑΜΡ/ΑΤΡ. Με την
ενεργοποίηση του μηχανισμού ελαττώνεται η δραστικότητα της ΗΜGCοΑ αναγωγάσης και ρυθμίζεται η
συγκέντρωση των μεταβολιτών της χοληστερόλης σε μη τοξικές για το κύτταρο
συγκεντρώσεις.[9]

Εικόνα 8 [9]
Η πρωτεϊνική κινάση, η οποία ενεργοποιείται από το cΑΜΡ, είναι υπεύθυνη και για
τη φωσφορυλίωση δύο άλλων ενζύμων, τα οποία μετέχουν στο μεταβολισμό των
λιπαρών οξέων και της χοληστερόλης μέσα στο κύτταρο: της ακετυλοCοΑ καρβοξυλάσης, η οποία
ρυθμίζει τη σύνθεση των λιπαρών οξέων και της κυτταρικής ορμονοευαίσθητης
λιπάσης/εστεράσης της χοληστερόλης, υπεύθυνη για την υδρόλυση των
τριγλυκεριδίων και των εστέρων της χοληστερόλης στο κυτταρόπλασμα (Εικόνα 8).
Αποτέλεσμα ο μεταβολισμός της χοληστερόλης να συντονίζεται με το μεταβολισμό
των λιπαρών οξέων. Η σύνθεση των λιπαρών οξέων και της χοληστερόλης επιβραδύνεται
όταν το κύτταρο χρειάζεται ΑΤΡ (ενέργεια).
Η χοληστερόλη επιδρά αρνητικά στη δραστικότητα της ΗΜGCοΑ αναγωγάσης (ανάδρομος
αναστολή), Ο μηχανισμός δεν ενεργοποιείται στα εντερικά κύτταρα. Μόνο η
χοληστερόλη η οποία εισέρχεται στο κύτταρο μέσω λιποπρωτεϊνικών υποδοχέων είναι
σε θέση να αναστείλλει τη δραστικότητα της ΗΜGCοΑ-αναγωγάσης. Στο ηπατικό κύτταρο η χοληστερόλη που εισέρχεται
μέσω υποδοχέων προέρχεται από δύο πηγές. Από τα υπολείμματα των χυλομικρών
(είναι η χοληστερόλη που προέρχεται από την τροφή) και από τις LDL. Υπάρχουν υποδοχείς στη
μεμβράνη του ηπατικού κυττάρου, ειδικοί για τις LDL και ειδικοί για τα υπολείμματα των
χυλομικρών, οι οποίοι αναγνωρίζουν τις λιποπρωτεΐνες, συνδέονται με αυτές, τις
εσωτερικεύουν και η χοληστερόλη που απελευθερώνεται μέσα στο κύτταρο αναστέλλει
τη δραστικότητα της ΗΜGCοΑ-αναγωγάσης.
Χοληστερόλη συντίθεται ακόμη και όταν αυτή παρέχεται με την τροφή.
Η νηστεία ελαττώνει τη σύνθεση της με την έννοια ότι αυξάνει η έκκριση της
γλουκαγόνης και περιορίζεται το διαθέσιμο ΑΤΡ και ΝΑDΡΗ, ενώ τα λιπαρά οξέα διεγείρουν τη σύνθεση
της στο ήπαρ. Τα χολικά οξέα αναστέλλουν επίσης τη σύνθεση της χοληστερόλης
στον εντερικό βλεννογόνο και το ήπαρ, πιθανόν γιατί ευνοούν την απορρόφηση της
από το έντερο (σχηματισμός μικύλλων. απορρόφηση χοληστερόλης της τροφής). Τα
οιστρογόνα αναστέλλουν την de
novo σύνθεση της.[9]

Εικόνα 9 [9]
Το μεγαλύτερο ποσοστό χοληστερίνης στον ανθρώπινο οργανισμό δεν
προσλαμβάνεται με την τροφή αλλα συντίθεται εσωτερικά. Η χοληστερίνη βρίσκεται
σε μεγαλύτερη συγκέντρωση σε ιστούς που είτε την παράγουν είτε έχουν πυκνές
μεμβράνες, για παράδειγμα στο συκώτι, τη σπονδυλική στήλη και τον εγκέφαλο, όπως επίσης και στα αθηρώματα. Η χοληστερίνη παίζει κεντρικό ρόλο σε πολλές
βιοχημικές διαδικασίες, αλλά είναι περισσότερο γνωστή για τη σχέση που υπάρχει
μεταξύ των καρδιοαγγειακών ασθενειών και τη μεταφορά
της από τις λιποπρωτεΐνες και τα υψηλά επίπεδα χοληστερίνης
στο αίμα. Οι ανησυχίες αυτές αφορούν τη λεγόμενη "κακή χοληστερίνη",
δηλαδή τη χαμηλής πυκνότητας λιποπρωτεΐνη LDL. Η "καλή χοληστερίνη"
έχει να κάνει με την υψηλής πυκνότητας λιποπρωτεΐνη HDL. Ο χαρακτηρισμός δηλαδή
εξαρτάται από τον τρόπο με τον οποίο η χοληστερίνη δεσμεύεται στις
λιποπρωτεΐνες, τα μόρια
που χρησιμοποιούνται στον οργανισμό για τη μεταφορά ουσιών. Η χοληστερίνη, όταν
υπάρχει στο αίμα σε υπερβολικές τιμές, εναποτίθεται στα τοιχώματα των αρτηριών
και προκαλεί αθηρωματοσκλήρυνση, με συνέπεια την εμφάνιση στεφανιαίας
νόσου που οδηγεί σε έμφραγμα του μυοκαρδίου.[10]
Η απουσία του υποδοχέα LDL οδηγεί
σε υπερχοληστερολαιμία και αθηροσκλήρωση
Τα αποτελέσματα των πρωτοποριακών μελετών των Βrown και Goldstein για την οικογενή οπερχοληστερολαιμία
αποκάλυψαν τη φυσιολογική σημασία του υποδοχέα LDL. Στη γενετική αυτή ανωμαλία, η οποία
οφείλεται σε μια μετάλλαξη σε έναν μοναδικό αυτοσωματικό γενετικό τόπο, η
συνολική συγκέντρωση της χοληστερόλης και της LDL στο πλάσμα είναι αξιοσημείωτα
αυξημένη. Στους ομοζυγώτες, το επίπεδο χοληστερόλης στο πλάσμα είναι συνήθως
680 mg/dl, συγκρινόμενο με τα 300 mg/dl των ετεροζυγωτών (τα αποτελέσματα
κλινικών προσδιορισμών συχνά εκφράζονται σε χιλιοστογραμμάρια ανά δέκατο του
λίτρου, το οποίο είναι ίσο με χιλιοστογραμμάρια ανά 100 χιλιοστόλιτρα). Μια
τιμή μικρότερη των 200 mg/dl θεωρείται ως επιθυμητή,
αλλά πολλοί άνθρωποι έχουν υψηλότερα επίπεδα. Στην οικογενή υπερχοληστερολαιμία.
η χοληστερόλη εναποτίθεται σι: διάφορους ιστούς λόγω της υψηλής συγκέντρωσης
της χοληστερόλης των LDL,
στο πλάσμα. Οζίδια χοληστερόλης, που ονομάζονται ξανθώματα, είναι εμφανή στο
δέρμα και στους τένοντες.[11]
Ξανθώματα, όμοια μ' αυτά πού παρουσιάζονται στην ιδιοπαθή
ύπερχοληστεριναιμία εμφανίζονται μερικές φορές διάχυτα χωρίς υπερχοληστεριναιμία
(Xanthoma disseminatum).
Πιθανώς να πρόκειται για αύξηση του δικτυοενδοθηλιακοϋ συστήματος (RES), πού συνοδεύεται, με
εναπόθεση χοληστερίνης ατά κύτταρα αυτά. Συνγγενής με τη νόσο αυτή φαίνεται να
είναι και ή ιστιοκύττωση Χ, καθώς καί ή νόσος των Hand-Schuller-Christian [12]
Η οξείδωση της περίσσειας των LDL του αίματος για να σχηματιστούν οξειδωμένες LDL. (οxLDL) έχει ιδιαίτερο ενδιαφέρον. Οι
οξειδωμένες LDL,
προσλαμβάνονται από τα κύτταρα του ανοσοποιητικού συστήματος, που ονομάζονται μακμοφάγα.
για να σχηματιστούν τα αφρώδη κύτταρα. Τα αφρώδη αυτά κύτταρα παγιδεύονται στο
τοίχωμα των αιμοφόρων αγγείων και συμβάλλουν στον σχηματισμό των
αθηροσκληρωτικών πλακών οι οποίες προξενούν στένωση των αρτηριών και οδηγούν σε
καρδιακές προσβολές (Εικόνα 10). Στην πραγματικότητα, οι περισσότεροι
ομοζυγώτες πεθαίνουν κατά την παιδική ηλικία τους από στεφανιαία νόσο. Η
ασθένεια στους ετεροζυγώτες (1 σε 500 άτομα) έχει μια ενδιάμεση και πιο
μεταβλητή κλινική πορεία. Μια εστεράση του ορού η οποία αποικοδομεί οξειδωμένα
λίπη βρέθηκε συνδεδεμένη με τις HDL.
Πιθανώς, η συνδεδεμένη με ΗDL
πρωτεΐνη καταστρέφει τις οξειδωμένες LDL, και αυτό εξηγεί την ικανότητα των ΗDL να προστατεύουν από τη στεφανιαία
νόσο.[11]
Η μοριακή βλάβη στις περισσότερες περιπτώσεις της οικογενούς
υπερχοληστερολαιμϊας είναι η απουσία ή η ανεπάρκεια λειτουργικών υποδοχέων LDL. Έχουν αναγνωριστεί
μεταλλάξεις υποδοχέων που διακόπτουν κάθε ένα από τα στάδια της ενδοκυτταρικής
πορείας. Οι ομοζυγώτες δεν έχουν σχεδόν καθόλου λειτουργικούς υποδοχείς LDL, ενώ οι ετεροζυγώτες
έχουν περίπου μισούς από τον φυσιολογικό αριθμό. Συνεπώς. διαταράσσεται η
είσοδος των LDL στο
ήπαρ και σε άλλα κύτταρα, οδηγώντας σε αύξηση των επιπέδων των LDL, στο πλάσμα. Επιπλέον,
στα κύτταρα του ήπατος εισέρχονται λιγότερες LDL, διότι η είσοδος των LDL διεκπεραιώνεται από τους υποδοχείς LDL. Συνεπώς, στην οικογενή
υπερχοληστερολαιμία οι LDL
παραμένουν στο αίμα περισσότερο χρόνο, και περισσότερες από αυτές μετατρέπονται
σε LDL από ό,τι θα συνέβαινε
σε φυσιολογικά άτομα. Όλες οι επιβλαβείς συνέπειες της απουσίας ή της
ανεπάρκειας των υποδοχέων LDL
μπορούν να αποδοθούν στα αυξημένα επίπεδα της χοληστερόλης των LDL στο αίμα.[11]

Εικόνα 10 [11]
Έχει αναπτυχθεί μια νέα θεωρία σχηματισμού των αθηρωματικών
πλακών (αθηρωγένεση), μέσα από την οποία δίνεται και η βιοχημική εξήγηση της
προστατευτικής δράσης που ασκεί η Μεσογειακή δίαιτα έναντι των καρδιοπαθειών. Η
θεωρία αυτή, μέσα από μια νέα προσέγγιση στο θέμα, ενοποιεί τις υπάρχουσες
θεωρίες της φλεγμονής, της οξείδωσης και της κατακράτησης. Υποδεικνύει σαν
αίτιο για την αθηρωμάτωση και την αρτηριοσκλήρυνση το φλεγμονώδη παράγοντα που
είναι υπεύθυνος για την πρόκληση της αθηρωμάτωσης (ο οποίος είναι ο Παράγοντας
Ενεργοποίησης των Αιμοπεταλίων, Platelet-Activating Factor, PAF) και
συμπληρώνει την υπάρχουσα γνώση, ώστε να είναι δυνατή η εξήγηση των σχετικών
πειραματικών δεδομένων της διεθνούς βιβλιογραφίας, χωρίς τα κενά που
παρουσίαζαν οι μέχρι σήμερα αποδεκτές θεωρίες. Το μόριο του PAF ανακαλύφθηκε
και διαλευκάνθηκε η δομή του το 1979 από τον Κ.Α.Δημόπουλο.[13]
Αξίζει να αναφερθεί ότι κάθε 4 χρόνια γίνεται Παγκόσμιο Συνέδριο
με αποκλειστικό και μόνο θέμα τον PAF. Ο προτεινόμενος βιοχημικός μηχανισμός
σχηματισμού αθηρωματικών πλακών, συνδυάζει νέα πειραματικά δεδομένα με τα
υπάρχοντα πειραματικά αποτελέσματα της διεθνούς σχετικής βιβλιογραφίας. Η
γενικευμένη αυτή θεωρία που προέκυψε από το συνδυασμό των παραπάνω ερευνητικών
δεδομένων, εξηγεί επίσης – με βιοχημικό τρόπο – τη γνωστή στατιστική και
επιδημιολογική παρατήρηση ότι η Μεσογειακή δίαιτα προστατεύει από το σχηματισμό
αθηρωματικών πλακών, την αρτηριο-σκλήρυνση και τις καρδιαγγειακές παθήσεις. [14]

Ο προτεινόμενος μηχανισμός είναι ο εξής: Η οξείδωση της LDL (Low
Density Lipoprotein, της λιποπρωτεΐνης που είναι πλούσια σε χοληστερόλη), είναι
μια διεργασία που λαμβάνει χώρα στο αίμα του ανθρώπου και εξαρτάται από
διάφορους παράγοντες όπως τη διατροφή (αντιοξειδωτικά στη τροφή), τον τρόπο
ζωής (κάπνισμα, άσκηση) κ.λπ. Κατά την διαδικασία αυτή παράγεται ανεξέλεγκτα
PAF, ο οποίο απομονώθηκε και πιστοποιήθηκε με βιολογικές δοκιμασίες και με
χημικές μελέτες.[15]
Τα επίπεδα του PAF στον οργανισμό βρίσκονται πάντα κάτω από
αυστηρό έλεγχο με τη βοήθεια ρυθμιστικών μηχανισμών. Όταν όμως τα επίπεδα του
PAF αυξάνονται ανεξέλεγκτα από την οξείδωση της LDL ή για παθολογικούς λόγους
(π.χ. διάφορες ασθένειες), τότε ο PAF - πλην των άλλων - προκαλεί τοπική
φλεγμονώδη αντίδραση στο αγγείο, με αποτέλεσμα την καταστροφή του ενδοθηλίου
(που καλύπτει το εσωτερικό του αγγείου) και αύξηση της διαπερατότητας αυτού,
οπότε εισέρχονται στον υπενδοθηλιακό χώρο κύτταρα και οξειδωμένη LDL,
σχηματίζονται τα "αφρώδη κύτταρα" (τα οποία είναι το χαρακτηριστικό
εύρημα του πρώτου σταδίου της ανάπτυξης της αθηρωματικής πλάκας) και
προκαλείται υπερπλασία των λείων μυϊκών κυττάρων. Όλες οι παραπάνω επιμέρους
διεργασίες αποτελούν γνωστές βιολογικές ιδιότητες του PAF. Τα αφρώδη κύτταρα
μαζί με τα αιμοπετάλια, τα λεία μυϊκά κύτταρα, καθώς επίσης λιποειδή
(χοληστερόλη) και άλλα συστατικά του αίματος σχηματίζουν ένα σύμπλεγμα που
αποτελεί την αθηρωματική πλάκα.[16]
Χοληστερόλη, αθηρωμάτωση και στεφανιαία νόσος στο 24ο Πανελλήνιο
Καρδιολογικό Συνέδριο
Επιτακτική ανάγκη αποτελεί η θεραπευτική αντιμετώπιση της
υπερλιπιδαιμίας, καθώς τα τελευταία χρόνια αναδεικνύεται ολοένα και περισσότερο
ο καταστροφικός ρόλος της χοληστερόλης στη δημιουργία αθηρωμάτωσης και,
συνεπώς, στεφανιαίας νόσου.
Γενικά η αθηρωμάτωση είναι μία γενικευμένη και εκφυλιστική νόσος
ενώ συχνά υπάρχουν πολλαπλές εντοπίσεις της νόσου. Όταν κάποιος πάσχει από την
αθηρωματώδη νόσο οι αρτηρίες του στενεύουν επειδή αναπτύσσονται αθηρωματώσεις
πλάκες, οι ποίες περιέχουν λιποειδή πυρήνα , λιπίδια , άλατα ασβεστίου ,
αιμοπετάλια κ.α. Δηλαδή στην αρχή έχουμε την καταστροφή του ενδοθηλίου έπειτα
του μυϊκού χιτώνα και συνεχίζεται η καταστροφή μέχρι τις εσωτερικότερα κείμενες
στιβάδες του αρτηριακού τοιχώματος. Μετά έχουμε την συσσώρευση των λιπιδίων
στον λιποειδή πυρήνα.
Μάλιστα, τα νεότερα επιστημονικά δεδομένα δείχνουν ότι για την
αποτελεσματικότερη μείωση των επιπέδων χοληστερόλης στο αίμα επιβάλλεται η
χορήγηση συνδυασμού φαρμάκων. Στο συμπέρασμα αυτό κατέληξαν οι κορυφαίοι
Καρδιολόγοι της χώρας που πήραν μέρος στο 24ο Πανελλήνιο Καρδιολογικό Συνέδριο,
που πραγματοποιήθηκε στη Ρόδο. Όπως ανέφεραν οι ειδικοί, είναι πλέον γνωστό σε
όλους ότι τα αυξημένα επίπεδα χοληστερόλης που οδηγούν σε αθηροσκλήρωση
αποτελούν έναν από τους κύριους παράγοντες κινδύνου ανάπτυξης στεφανιαίας
νόσου. Και η στεφανιαία νόσος, με τη σειρά της, είναι η κυρίαρχη αιτία θανάτου
τόσο στις αναπτυγμένες, όσο και στις αναπτυσσόμενες χώρες. Έτσι, σύμφωνα με
επιδημιολογικές μελέτες:
- Η στεφανιαία νόσος ευθύνεται για το 1/3 των θανάτων
παγκοσμίως.
- Η στεφανιαία νόσος προσβάλλει πάνω από 17 εκατομμύρια άτομα το
χρόνο, δηλαδή έξι φορές περισσότερα άτομα από τον ιό HIV του ΑΙDS.
- Το 80% των θανάτων από στεφανιαία νόσο εμφανίζεται στις πτωχές
και μετρίου εισοδήματος χώρες.
- Στις χώρες της ανατολικής Μεσογείου το ποσοστό θανάτων από
στεφανιαία νόσο κυμαίνεται από 25-45%.
Το πιο ανησυχητικό, όμως, είναι ότι παρά τις υπάρχουσες
αποτελεσματικές υπολιπιδαιμικές θεραπείες, η αυξημένη χοληστερόλη παραμένει ο
βασικός παράγοντας κινδύνου για καρδιαγγειακή νόσο και θάνατο. Πρόσφατα
στατιστικά στοιχεία από την Ευρώπη και τις ΗΠΑ δείχνουν ότι περίπου οι μισοί
ασθενείς που έλαβαν υπολιπιδαιμική θεραπεία (και ακόμη περισσότεροι στις ομάδες
υψηλού κινδύνου) δεν φθάνουν στα επιθυμητά αποτελέσματα. Όπως ανέφεραν οι
ομιλητές, η χρήση στατινών βρήκε άριστη εφαρμογή, καθώς τα φάρμακα αυτά, όπως
αποδείχθηκε από πολυάριθμες πληθυσμιακές μελέτες, μειώνουν αποτελεσματικά τα
καρδιαγγειακά επεισόδια, ενώ παράλληλα γίνονται καλώς ανεκτά χωρίς αξιόλογες
παρενέργειες. Παρόλα αυτά, ένας μεγάλος αριθμός υπερλιπιδαιμικών ασθενών δεν
επιτυγχάνει τους στόχους μείωσης της χοληστερόλης. Έτσι λοιπόν, αρκετές μορφές
υπερλιπιδαιμίας χρειάζονται συνδυασμό υπολιπιδαιμικής θεραπείας, τόνισαν οι
ειδικοί, οπότε προκύπτει σαφώς η ανάγκη για την εισαγωγή νέων κατηγοριών
φαρμάκων, τα οποία, σε συνδυασμό κυρίως με τις στατίνες, θα μας δώσουν τα
επιθυμητά αποτελέσματα μείωσης της χοληστερόλης και επίτευξης των στόχων της
υπολιπιδαιμικής αγωγής, χωρίς παράλληλα να εμφανίζονται παρενέργειες.
Η χοληστερόλη εισέρχεται στην κυκλοφορία του αίματος μέσω δύο
οδών: α) παραγωγή της χοληστερόλης από το ήπαρ (ηπατικός και εξωηπατικός ιστός)
και β) απορρόφηση της χοληστερόλης από το έντερο. Η χοληστερόλη που βρίσκεται
στο έντερο προέρχεται από την τροφή και τη χολή, με τη χοληστερόλη που
προέρχεται από τη χολή να αποτελεί την κύρια οδό συνεισφοράς. Περίπου το 50%
της εντερικής χοληστερόλης απορροφάται από το έντερο και επανακυκλοφορεί στον
οργανισμό, ενώ το υπόλοιπο απεκκρίνεται μέσω των κοπράνων. Σύμφωνα με τους
επιστήμονες, πρόσφατες κλινικές μελέτες έχουν δείξει ότι μια νέα ουσία, η
εζετιμίμπη, μειώνει ουσιαστικά την "κακή" χοληστερόλη (LDL) όταν
συγχορηγείται στη θεραπεία με στατίνες. Η εζετιμίμπη είναι το πρώτο φάρμακο
μιας νέας κατηγορίας, των αναστολέων απορρόφησης της χοληστερόλης. Η
πρωτοποριακή αυτή ουσία δρα με ένα μοναδικό τρόπο, εμποδίζοντας την απορρόφηση
της χοληστερόλης από το έντερο που βρίσκεται στην τροφή ή που προέρχεται από τα
χολικά οξέα, ενώ εμποδίζει, επίσης, την απορρόφηση από το έντερο των
παραγόμενων στερολών. Έτσι, ο συνδυασμός της νέας ουσίας με μια στατίνη
προσφέρει διπλή μείωση των επιπέδων χοληστερόλης στο αίμα, τόσο σε ό,τι αφορά την
απορρόφησή της από το έντερο, όσο και από τη σύνθεσή της στο ήπαρ (στατίνη). "Η
συνδυασμένη θεραπεία φαίνεται να αποτελεί το μέλλον της ρύθμισης των
λιπιδίων", δήλωσε ο Γάλλος Καθηγητής M. Farnier, από το Point Medical
Centre, της Ντιζόν της Γαλλίας, "καθώς τα μέχρι στιγμής δεδομένα δείχνουν
ότι η συγχορήγηση εζετιμίμπης με μια στατίνη αυξάνει την πιθανότητα ρύθμισης
των ασθενών στα επιθυμητά επίπεδα χοληστερόλης (μείωση έως και 61%) στην LDL-C,
βελτιώνοντας ταυτόχρονα και τις άλλες λιπιδαιμικές παραμέτρους (μείωση
τριγλυκεριδίων έως και 33% και αύξηση της καλής HDL χοληστερόλης έως και
9%)". Τέλος, τα εντυπωσιακά αυτά αποτελέσματα, επιτυγχάνονται με ένα
άριστο προφίλ ασφάλειας. [17]
Πώς αναπτύσσεται η αρτηροσκλήρωση
Το τοίχωμα μιας αρτηρίας αποτελείται από διάφορα στρώματα. Η
εσωτερική επένδυση ή το εσωτερικό στρώμα (ενδοθήλιο) είναι συνήθως ομαλή και
συνεχής. Η αρτηριοσκλήρωση αρχίζει όταν τραυματίζεται το ενδοθήλιο.(Εικόνα 11)


Εικόνα 11 [18]
Κατόπιν ορισμένα λευκοκύτταρα του αίματος αποκαλούμενα μονοκύτταρα
ενεργοποιούνται και κινούνται από το αίμα και μέσω του τραυματισμένου
ενδοθηλίου μιας αρτηρίας στο τοίχωμα αυτής. Μέσα στο τοίχωμα μετασχηματίζονται
σε αφρώδη κύτταρα, τα οποία είναι κύτταρα που συλλέγουν τα λιπαρά υλικά, κυρίως
χοληστερόλη. Ταυτόχρονα, τα λεία μυικά κύτταρα κινούνται από το μέσο χιτώνα
προς το ενδοθήλιο και εκεί πολλαπλασιάζονται. Επίσης συνδετικός και ελαστικός
ιστός συσσωρεύεται κάτω από το ενδοθήλιο, όπως επίσης και συντρίμμια κυττάρων,
κρύσταλλοι χοληστερόλης και ασβέστιο. Αυτή η συσσώρευση των αφρωδών κυττάρων,
των λείων μυικών κυττάρων, και άλλων υλικών διαμορφώνει μια ετερόκλητη
συσσώρευση αποκαλούμενη αθήρωμα ή αθηρωσκληρυντική πλάκα. Καθώς η πλάκα
μεγαλώνει από τη συνεχή εναπόθεση των ανωτέρω υλικών, παχύνεται και καταλαμβάνει
το εσωτερικό της αρτηρίας. Αυτό δημιουργεί τοπικά στένωση της αρτηρίας που
εμποδίζει την ομαλή ροή του αίματος.
Το χαρακτηριστικό γνώρισμα της αθηροσκλήρωσης είναι η συσσώρευση
χοληστερόλης στο αρτηριακό τοίχωμα. Η μελέτη της χοληστερόλης στο αρτηριακό τοίχωμα
έχει μακρά προϊστορία και ανακαλύφθηκε αρχικά από τον Vogel το 1843. Ο Γερμανός
παθολογοανατόμος Rudolf Virchow, η μεγαλύτερη μορφή στην ιστορία της
παθολογοανατομίας έδειξε ιδιαίτερο ενδιαφέρον για την αθηροσκλήρωση. Το 1852,
δημοσίευσε μία μονογραφία στην οποία υποστήριζε ότι οι βλάβες ήταν το
αποτέλεσμα συσσώρευσης συστατικών του πλάσματος στον έσω χιτώνα. Ο Adolf
Windaus, ένας βιοχημικός στερολών και κάτοχος του Βραβείου Nobel, απέδειξε το
1910, ότι τεράστιες ποσότητες χοληστερόλης ευρίσκονται σε ανθρώπινες
αθηροσκληρωτικές πλάκες.
Η συσσώρευση χοληστερόλης στον αρτηριακό έσω χιτώνα αρχίζει με
την στρατολόγηση μονοκυττάρων από το αίμα. Δια μέσου μορίων συγκόλλησης τα
μονοκύτταρα εισδύουν στον έσω χιτώνα, όπου υφίστανται διαφοροποίηση σε
μακροφάγα. Τα μακροφάγα είναι εφοδιασμένα με τους ονομαζόμενους υποδοχείς
αποκάθαρσης, οι οποίοι συνδέονται και εσωτερικοποιούν τα μόρια της LDL,
ιδιαίτερα τα μόρια της οξειδωμένης LDL. Τα μακροφάγα φορτίζονται με χοληστερόλη
και μετατρέπονται σε αφρώδη κύτταρα. Η συσσώρευση των αφρωδών κυττάρων στον έσω
χιτώνα αποτελεί ένα χαρακτηριστικό γνώρισμα της πλάκας. Τα κύτταρα αυτά
ενδέχεται να υποστούν κυτταρικό θάνατο και ρήξη, διεργασίες με τις οποίες η
εξωκυτταρική χοληστερόλη συσσωρεύετε στην πλάκα.
Οι αθηροσκληρωτικές βλάβες αναπτύσσονται στον έσω χιτώνα. (Εικόνα
12) Η πρωιμότερη βλάβη είναι η ονομαζόμενη λιπώδης γράμμωση, που εμφανίζεται
στην παιδική ηλικία και αποτελείται κυρίως από φορτισμένα με χοληστερόλη
μακροφάγα. Οι προχωρημένες αθηροσκληρωτικές βλάβες ονομάζονται ινώδεις πλάκες.
Η εστεροποιημένη και η ελεύθερη χοληστερόλη είναι τα επικρατούντα λιπίδια. Μία
ινώδης κάψα, που περιέχει λεία μυϊκά κύτταρα, μακροφάγα και Τ-λεμφοκύτταρα
καλύπτει την πλάκα. Οι ινώδεις πλάκες προβάλλουν προς τον αυλό και μπορεί να παρακωλύουν
την ροή αίματος.

Εικόνα 12 [18]
Μία σταθερή πλάκα μπορεί να εξελιχθεί σε ασταθή, ευάλωτη πλάκα.
Η ευάλωτη πλάκα είναι επιρρεπής σε ρήξη και μπορεί να αποτελεί την θέση
σχηματισμού θρόμβου. Οι ευάλωτες πλάκες έχουν, συγκριτικά, λεπτότερες ινώδεις
κάψες, αυξημένες ποσότητες ενζύμων αποδόμησης της θεμέλιας ουσίας και μεγάλους,
πλούσιους σε λιπίδια, πυρήνες.[18]
Αύξηση της υψηλής πυκνότητας χοληστερόλης λιποπρωτεϊνών (HDL-C) είναι μια
ελπιδοφόρος στρατηγική στην προσπάθεια να αποτραπεί μια καρδιαγγειακή πάθηση, και αναστολείς της μεταφορικής πρωτεϊνης του εστέρα
χοληστερόλης (CETP) έχουν
αναπτυχθεί για να ολοκληρώσουν αυτό. Τα πρώτα αποτελέσματα είναι ενθαρρυντικά, και, στην
πραγματικότητα, στα κουνέλια, η παρεμπόδιση της CETP μειώνει την αθηροσκλήρυνση. Επειδή ανθρώπινα στοιχεία
σχετικά με τη μείωση από
το atheroma burden απαιτήστε περισσότερο
χρόνο, οι
βιοχημικοί μηχανισμοί που κρύβονται κάτω από την υποθετική αθηροπροστασία των αναστολέων
της CETP είναι αυτήν την περίοδο διάσπαρτοι, και διάφορα μονοπάτια έχουν προκύψει. Πρώτο, η παρεμπόδιση της CETP αυξάνει την HDL-C και μειώνει τα
επίπεδα της χαμηλής - πυκνότητας χοληστερόλη λιποπρωτεϊνών (LDL-C) ανάλογα με την δραστηριότητα
της CETP μεταφοράς λιπιδίων και το ρόλος του στις
αντίστροφες μεταφορές χοληστερόλης (RCT). Αυτό συμπίπτει με υποθετικές ευεργετικές αυξήσεις στο μέγεθος της HDL και της LDL. Εντούτοις,
πολλές πτυχές σχετικά με τον αντίκτυπο της παρεμπόδισης της CETP στο RCT μονοπάτι παραμένει
αόριστο, ειδικότερα
εάν το πρώτο βήμα σχετικά με την εκροή χοληστερόλης από τους απομακρυσμένους
ιστούς σε HDL επηρεάζεται. Επιπλέον, η σχετικότητα του «καθαριστή» υποδοχέα BI και συνεπώς ο
κεντρικός ρόλος της HDL στην ανθρώπινη RCT είναι ακόμα ασαφής. Δεύτερο, η παρεμπόδιση της CETP παρουσιάστηκε πρόσφατα για να αυξήσει τα αντιοξειδωτικά ένζυμα συνδεμένα
με HDL, στη συνέχεια συνδεμένα με τη μειωμένη οξείδωση της LDL. Η αθηροπροστασία στον
άνδρα αναμένεται αυτήν την περίοδο με βάση τη βελτίωση αυτών των βιοχημικών
παραμέτρων γνωστών
στην επιρροή της αθηροσκλήρυνσης, αλλά τελική
επιβεβαίωση σχετικά με τον αντίκτυπο της παρεμπόδισης της CETP στην
καρδιαγγειακή έκβαση θα πρέπει να προέλθει από την αξιολόγηση στις κλινικές
δοκιμές και σημεία.[19]
Χαμηλά επίπεδα πλάσματος HDL χοληστερόλης είναι ένας ανεξάρτητος παράγοντας κινδύνου για
αρτηριοσκληρυντική καρδιαγγειακή πάθηση. Κατά τη διάρκεια των προηγούμενων ετών,
η μελέτη της HDL έχει υποκινηθεί από την ανακάλυψη των νέων γονιδίων και
πρωτεϊνών, οι οποίες έχουν παράσχει νέες ιδέες στους μοριακούς και κυτταρικούς
μηχανισμούς που περιλαμβάνουν το μεταβολισμό της HDL. Επιπλέον, πρόσφατες κλινικές
μελέτες που μεταχειρίζονται χαμηλά HDL σαν αρχικό στόχο υψηλού κινδύνου στους καρδιαγγειακούς
ασθενείς ήταν πολύ ενθαρρυντικές. Επιπλέον, νέα φάρμακα για την αύξηση της HDL χοληστερόλης είναι υπό
ανάπτυξη. Αυτό το άρθρο αναθεωρεί την πρόσφατη πρόοδο HDL τομέας και οι σημαντικές επιπτώσεις
του for the pathophysiology
και επεξεργασία atherosclerosis. Στο εγγύς μέλλον, αναμένουμε ότι τα νέα
φάρμακα με τα συγκεκριμένα και ευεργετικά αποτελέσματα στο μεταβολισμό HDL και
το σχετικό καρδιαγγειακό κίνδυνο πρέπει να βελτιώσουν την τρέχουσα προσέγγιση
σε αυτήν την ασθένεια με το υψηλό φορτίο στα συστήματα και την κοινωνία υγείας.[20]
Πρόσφατες κλινικές μελέτες έχουν αποκαλύψει ότι τα αυξανόμενα επίπεδα
σε τριγλικερίδια (TG) στον
ορό, συσχετίζεται πολύ με την αθηροσκλήρυνση, ανεξάρτητα από τα επίπεδα στον
ορό υψηλής πυκνότητας λιποπρωτεϊνης (HDL) και χαμηλής πυκνότητας λιποπρωτεϊνης (LDL). Μεταξύ των σε τριγλικερίδια-πλούσιων
λιποπρωτεϊνών (TRLs), οι
υπόλοιπες λιποπρωτεϊνες (RLPs)
θεωρούνται ότι να είναι αθερογενικές και ένας ανεξάρτητος στεφανιαίος
παράγοντας κινδύνου. Μονοκύτταρα καλλιεργημένα παρουσία RLPs αύξησαν την
προσκόλλησή τους στα αγγειακά ενδοθηλιακά κύτταρα. Ο ελλοχεύον περιληφθείς
μηχανισμός ενεργοποίησης της RhoA, (ένα μέλος των μικρών δεσμευτικών πρωτεϊνών
GTP), έχει σαν συνέπεια την ενεργοποίηση της εστιακής προσκόλλησης κινάσης
(FAK) και s1-ιντεγκρίνης. Είναι επίσης γνωστό ότι τα RLPs εισέρχονται στα
τοιχώματα των αγγείων. Σε μια άλλη μελέτη, αποδεικνύεται ότι τα RLPs προκαλούν
τον πολλαπλασιασμό των μυϊκών κυττάρων (SMC), ανεξάρτητα από οξειδωτική πίεση. Πρόσφατα, προσδιορίστηκαν οι
μοριακοί μηχανισμοί, στους όποιους τα RLPs από υπερτριγλυκεριδεμικούς ασθενείς υποκινούν
τον πολλαπλασιασμό SMC μέσω του επιδερμικών διαδραστικών υποδοχέων του παράγοντα
αύξησης (EGF) και της διασποράς του ηπαρίνης-δεσμευτικού EGF-ομοιάζοντα παράγοντα
αύξησης (HB-EGF). Πιό πρόσφατα, απεδείχθη ότι ο apoB48 υποδοχέας περιλήφθηκε σε RLP- προκληθέντα σχηματισμό αφρωδών
κυττάρων στα μακροφάγα.[21]
[1] http://www-jcb.bio.auth.gr/mor_biol/introduction/texts/intro10.htm
[2] http://www-jcb.bio.auth.gr/mor_biol/membranes/frames/membranes18.htm
[3] http://www-jcb.bio.auth.gr/mor_biol/membranes/texts/membranes1.htm
[4] Guyton A., Hall J., Φυσιολογία
του Ανθρώπου και Μηχανισμοί των νόσων, Επιστημονικές Εκδόσεις Παρισιανού
Α.Ε., Αθήνα 2001, σελ.664
[5] http://www-jcb.bio.auth.gr/mor_biol/membranes/frames/membranes15.htm
[6] Alberts, Bray, Johnson, Lewis, Raff, Roberts,
Walter, (2000). Βασικές Αρχές
Κυτταρικής Βιολογίας, Εισαγωγή στην Μοριακή Βιολογία του Κυττάρου. Ιατρικές
Εκδόσεις Π.Χ. Πασχαλίδης, Αθήνα .σελ.416
[7] Cooper RA.,
Influence of increased membrane cholesterol
on membrane fluidity and cell function in human red blood cells, PMID:
723275 1978;8(4):413-30.
[8] Διονυσίου-Αστερίου Α., Αθηροσκλήρυνση Βιοχημική Προσέγγιση,
Ιατρικές εκδόσεις Π.Χ.Πασχαλίδη, Αθήνα 1997, σελ. 1-2
[9] Διονυσίου-Αστερίου Α., Αθηροσκλήρυνση Βιοχημική Προσέγγιση,
Ιατρικές εκδόσεις Π.Χ.Πασχαλίδη, Αθήνα 1997, σελ. 35-41
[10] http://el.wikipedia.org/wiki/%CE%A7%CE%BF%CE%BB%CE%B7%CF%83%CF%84%CE%B5%CF%81%CE%AF%CE%BD%CE%B7
[11] Berg J., Tymoczko J., Stryer L., Βιοχημεία, Τόμος ΙΙ, Πανεπιστημιακές Εκδόσεις Κρήτης, Ηράκλειο
2005, σελ. 824
[12] Karlson P., Gerok W., Groβ W., Κλινική Παθολογική Βιοχημεία, Ιατρικές
εκδόσεις Λίτσας, Αθήνα 1993, σελ.51
[13]
C.A.Demopoulos, R.N.Pinckard and D.J.Hanahan, Platelet-Activating Factor. Evidence for
1-0-alkyl-2-acetyl-sn-glyceryl-3-phosphoryl- choline as the active component.
(A new class of lipid chemical mediators). J. Biol. Chem. (1979) 254, 9355
[14] C.A.Demopoulos,
H.C.Karantonis and S.Antonopoulou, Platelet
activating factor- a molecular link between atherosclerosis theories. Eur.
J. Lipid Sci. Technol. (2003) 150, 705.
[15] T.A.Liapikos, S.Antonopoulou, S.-A.Karabina, D.C.Tsoukatos,
C.A.Demopoulos and A.D.Tselepis, Platelet-Activating
Factor formation during oxidative modification of low-dencity lipoprotein when PAF-acetylhydrolase
has been inactivated. Biochim. Biophys. Acta (1994) 1212, 353
[16] http://www.chem.uoa.gr/Research/PAF_mechanism.htm
[17] http://www.iatrikionline.gr
[18] http://www.incardiology.gr/pathiseis_lipidia/lipidia_plaka.htm
[19] Klerkx AH, El Harchaoui K, van der
[20] Laris Mdel R, Arteaga A, Cuevas A, Rigotti
A., HDL cholesterol: a new target in the
treatment of lipid disorders and atherosclerosis?, Facultad de Medicina,
Pontificia Universidad Catolica de Chile, Santiago, Chile, Rev Med Chil. 2005
Jul;133(7):823-32. Epub 2005 Aug 26. Links, PMID: 16341390
[21] Kawakami A, Yoshida M., Remnant lipoproteins and atherogenesis, Department of Geriatrics and
Vascular Medicine, Graduate School of Medicine, Tokyo Medical and Dental University,
1-5-45 Yushima D809, Bunkyo-ku, Tokyo, Japan, J Atheroscler Thromb. 2005;12(2):73-6 , PMID:
15942116
Οι στεροειδείς ορμόνες είναι στεροειδή που ενεργούν όπως οι
ορμόνες. Οι στεροειδείς ορμόνες των θηλαστικών μπορούν να ομαδοποιηθούν σε
πέντε ομάδες με βάση τους υποδοχείς στους οποίους δεσμεύονται: γλυκοκορτικοειδή,
μεταλλοκορτικοειδή, ανδρογόνα, οιστρογόνα, και προγεστερόνες.(Εικόνα 1) Τα
παράγωγα της Βιταμίνης D
είναι το έκτο πολύ σχετικό ορμονικό σύσημα με ομόλογους υποδοχείς, αν και
τεχνικά είναι στερόλες παρά στεροειδή. [1]

Εικόνα 1 [2]

Εικόνα 2 [3]

Εικόνα 3 [3]
·
Μη κωδικοποιημένες από γονίδια, αλλά προερχόμενες
από τη χοληστερόλη μέσω ενζυματικών αντιδράσεων.
·
Η χοληστερόλη μετατρέπεται στο πρεγνενολόνη. Η πρεγνενολόνη
κινείται μεταξύ των μιτοχονδρίων και του ER και είναι πρόδρομος σε όλα τα
στεροειδή.
·
Τα στεροειδή είναι λιπόφιλα μόρια που διασχίζουν
ελεύθερα τις μεμβράνες.
·
Τα στεροειδή δεν αποθηκεύονται στους ενδοκρινείς
αδένες αλλά απελευθερώνεται καθώς παράγονται.
·
Ταξιδεύουν στο αίμα και συνδέονται με στεροειδές
- δεσμευτικές σφαιρίνες (SBGs)
[3]


Εικόνα 4 [4]


Εικόνα 5 [4]
Οι φυσικές στεροειδείς ορμόνες συντίθενται γενικά από χοληστερόλη
στις γονάδες και στους
επινεφρίδιους αδένες. Αυτές οι μορφές ορμονών είναι λιπίδια. Μπορούν να διαπεράσουν
την κυτταρική μεμβράνη αρκετά εύκολα και να τοποθετηθεί δεξιά στους πυρήνες. Οι
στεροειδείς ορμόνες μεταφέρονται γενικά στο αίμα συνδεδεμένες σε συγκεκριμένες
μεταφορικές πρωτεϊνες όπως η δεσμευτική σφαιρίνη των φυλετικών ορμονών ή η
κορτικοστεροειδής δεσμευτική σφαιρίνη. Περαιτέρω μετατροπές και καταβολισμοί εμφανίζονται
στο συκώτι, άλλους περιφεριακούς ιστούς, και στους ιστούς στόχους.
Επειδή τα στεροειδή και οι στερόλες είναι λιποδιαλυτές ουσίες, μπορούν
να διαχυθούν αρκετά ελεύθερα από το αίμα μέσω της κυτταρικής μεμβράνης και στο κυτταρόπλασμα
των κυττάρων στόχων. Στο κυτταρόπλασμα το στεροειδές μπορούν ή δεν μπορούν να υποβληθούν
σε ενζυμική τροποποίηση όπως η μείωση, η υδροξυλίωση, ή η αρωματοποίηση. Στο
κυτταρόπλασμα, τα στεροειδή δεσμεύονται σε συγκεκριμένους υποδοχείς, μεγάλες
μεταλλοπρωτεϊνες. Επάνω στη στεροειδή σύνδεση, πολλά είδη στεροειδούς υποδοχέα διμερίζονται:
δύο υπομονάδες υποδοχέα ενώνονται μαζί για να διαμορφώσουν μια λειτουργική DNA-συνδεδεμένη μονάδα
που μπορεί να εισαχθεί στον πυρήνα των κυττάρων. Σε μερικά από τα γνωστά συστήματα
ορμονών, ο υποδοχέας συνδέεται με μια θερμικού σόκ πρωτεϊνη που απελευθερώνεται
με την σύνδεση του προσδέτη , της ορμόνης. Μιά φορά στον πυρήνα, το σύμπλεγμα του
στεροειδούς – προσδέτη συνδέεται σε ειδικές DNA ακολουθίες και
προκαλεί τη μεταγραφή γονιδίων στόχων. [1]
Εικόνα 6 [1]
 Εικόνα 7 [2]
Εικόνα 7 [2]
Στεροειδή που γίνονται από τη χοληστερόλη
Κύριες φυσικές ανθρώπινες στεροειδείς ορμόνες
·
Γλυκοκορτικοειδή
o
κορτιζόλη
·
Μεταλλοκορτικοειδή
o
αλδοστερόνη
·
Στεροειδή φύλου
o
ανδρογόνα
§
τεστοστερόνη
§
δευδροεπιανδροστερόνη (DHEA)
§
δευδροεπιανδροστερόνης θεϊικό άλας (DHEAS)
§
ανδροστενεδιόνη
§
διυδροτεστοστερόνη (DHT)
o οιστρογόνα
§ εστραδιόλη
§ εστρόνη
§ εστριόλη
o προγεσταγόνα
§ προγεστερόνη
Η κύρια ορμόνη
στερόλης:
·
Βιταμίνης D παράγωγα
o Καλσιτριόλη
[1]
Φλοιός των επινεφριδίων
Ο φλοιός αποτελείται από µεγάλα πολυεδρικά κύτταρα πλούσια σε λίπη,
τα οποία είναι τοποθετηµένα σε τρεις ζώνες (εικόνα 8 ): (1) Η εξωτερική
σπειροειδής, εκκρίνει ορµόνες που ελέγχουν την ισορροπία των ηλεκτρολυτών και
του νερού, τα αλατοκορτικοστεροειδή.(2) Η ενδιάµεση ζώνη, η στηλιδωτή, εκκρίνει
γλυκορτικοστεροειδή, δηλαδή ορµόνες που ελέγχουν τον µεταβολισµό των υδατανθράκων.
(3) Τα κύτταρα της εσωτερικής ζώνης, της δικτυωτής, εκκρίνουν κυρίως ανδρογόνα
αλλά και µικρές ποσότητες γλυκορτικοστε-ροειδών.[5]

Εικόνα 8 [5]
Έκκριση των γλυκοκορτικοστεροειδών
Το κυριότερο γλυκοκορτικοστεροειδές που εκκρίνεται στον άνθρωπο είναι
η κορτιζόλη. Η κορτιζόλη εκκρίνεται µε έναν ηµερήσιο ρυθµό. Παρόλα αυτά η
έκκρισή της αυξάνεται από παράγοντες που προκαλούν stress. Με τον όρο αυτό
εννοούµε καταστάσεις βλαβερές ή δυναµικά βλαβερές για τον οργανισµό, όπως για
παράδειγµα ακραίες τιµές θερµοκρασίας, τραύµατα, λοιµώξεις, στέρηση τροφής,
παρατεταµένη µυϊκή δραστηριότητα ή ακόµη και ψυχολογική ανησυχία. Όλοι οι παραπάνω
παράγοντες διεγείρουν την έκκριση της κορτιζόλης από τον φλοιό των
επινεφριδίων. Η έκκριση της κορτιζόλης ελέγχεται από έναν τυπικό µηχανισµό ανάδρασης
µέσω της κορτικοτρόπου ορµόνης (ACTH) της αδενοϋπόφυσης, που µε τη σειρά της
ελέγχεται από τον υποθάλαµο µέσω του υποθαλαµικού παράγοντα. [5]

Εικόνα 9 [2]

Εικόνα 10 [2]
Φυσιολογικές δράσεις της κορτιζόλης
Η κορτιζόλη είναι µια σηµαντική µεταβολική ορµόνη απαραίτητη για
την επιβίωση του οργανισµού κάτω από καταστάσεις stress. Η κύρια επίδραση της
κορτιζόλης είναι η γλυκονεογένεση, δηλαδή ο σχηµατισµός της γλυκόζης από λίπη
και πρωτεΐνες. Έτσι, η κορτιζόλη διεγείρει όλα τα στάδια αυτής της διαδικασίας:
κινητοποίηση των λιπαρών οξέων από τον λιπώδη ιστό, κινητοποίηση και
καταβολισµό των πρωτεϊνών και ενεργοποίηση των ενζύµων που συµµετέχουν.[5]
Αλατοκορτικοστεροειδή
Η κύρια λειτουργία των αλατοκορτικοστεροειδών είναι ο έλεγχος
των ηλεκτρολυτών στο πλάσµα και κυρίως των ιόντων νατρίου και καλίου. Η
αλδοστερόνη είναι το πιο ενεργό αλατοκορτικοστεροειδές και η κύρια φυσιολογική
της δράση είναι η µείωση της απέκκρισης του νατρίου από το σώµα. Η ορµόνη
επιδρά στα νεφρικά σωληνάρια, όπου διεγείρει την επαναρρόφηση του νατρίου. Η
έκκριση της αλδοστερόνης διεγείρεται από πολλούς παράγοντες: αυξηµένα επίπεδα
καλίου στο πλάσµα, χαµηλά επίπεδα νατρίου, χαµηλή πίεση και µικρός όγκος
αίµατος.[5]
Συνθετικά στεροειδή και
στερόλες
Ποικίλα συνθετικά στεροειδή και στερόλες έχουν επίσης σχεδιαστεί.
Τα περισσότερα είναι στεροειδή αλλά μερικά είναι μη-στεροειδή μόρια που μπορούν
να αλληλεπιδράσουν με τους υποδοχείς των στεροειδών λόγω μιας ομοιότητας στη
μορφή. Μερικά συνθετικά στεροειδή είναι πιό αδύνατα, κάποια πολύ ισχυρότερα, από
τα φυσικά στεροειδή ανάλογα με τους υποδοχείς που ενεργοποιούν.
Μερικά παραδείγματα συνθετικών στεροειδών ορμονών:
§
γλυκοκορτικοειδή: prednisone, dexamethasone, triamcinolone
§
μεταλλοκορτικοειδή: fludrocortisone
§
βιταμίνη D: dihydrotachysterol
§ ανδρογόνα:
oxandrolone, decadurabolin (επίσης γνωστά
ως αναβολικά στεροειδή)
§
οιστρογόνα: diethylstilbestrol (DES)
§
προγεστίνες: norethindrone, medroxyprogesterone acetate [1]
Οι στεροειδείς ορμόνες έχουν αποτελέσει αντικείμενο πολλών
ερευνών λόγω της ευεργετικής τους επίδρασης στο νευρικό σύστημα, καθώς και σε
πλήθος άλλων ιστών και συστημάτων. Η μελέτη της δράσης των στεροειδών στους
διάφορους κυτταρικούς τύπους προϋποθέτει την κατανόηση του μηχανισμού δράσης
τους εντός του κυττάρου. H παρούσα έρευνα στοχεύει να προσφέρει γνώση σχετικά
με τους μηχανισμούς δράσης της οιστραδιόλης και της τεστοστερόνης σε νευρικά
κύτταρα. Σκοπό δεν αποτελεί όμως μόνον η διαλεύκανση κάποιων βασικών μηχανισμών
δράσης αυτών των ορμονών, αλλά και η συγκριτική μελέτη της επίδρασής τους στην
κυτταρική επιβίωση και απόπτωση. Αρχικά μελετήθηκε ο μηχανισμός δράσης της
οιστραδιόλης στα κύτταρα φαιοχρωμοκυττώματος του μυελού των των επινεφριδίων
της σειράς PC12, τα οποία προέρχονται από τη νευρική ακρολοφία. Τα κύτταρα αυτά
βρέθηκε ότι εκφράζουν μικρές ποσότητες ενδοκυττάριου υποδοχέα οιστρογόνων, ενώ
δεν εκφράζουν ενδοκυττάριους υποδοχείς ανδρογόνων και προγεστερόνης. Η
οιστραδιόλη προστατεύει τα κύτταρα PC12 από την προκαλούμενη από έλλειψη ορρού
απόπτωση, δράση, η οποία διεξάγεται μέσω της ενεργοποίησης ενός ή περισσοτέρων
ειδικών για αυτήν μεμβρανικών υποδοχέων, οι οποίοι μάλιστα είναι διαφορετικοί
από τον αντίστοιχο ενδοκυττάριο υποδοχέα της οιστραδιόλης. Tην ενεργοποίηση
αυτών των μεμβρανικών υποδοχέων, ακολουθεί η ενεργοποίηση ενός καταρράκτη
μετάδοσης δευτέρων μηνυμάτων, όπως η αύξηση της ενδοκυττάριας συγκέντρωσης
ιόντων ασβεστίου και του κυκλικού ΑΜΡ. Η οιστραδιόλη επάγει την ενεργοποίηση
της συνθάσης του νιτρικού οξειδίου μέσω των πρωτεϊνών ΡΙ3Κ και Akt, την
ενεργοποίηση της πρωτεΐνης Src και των ΜΑΡ κινασών κι ενεργοποιεί τελικά τους
μεταγραφικούς παράγοντες CREB και NFκΒ, οι οποίοι αυξάνοντας τα επίπεδα των
αντιαποπτωτικών πρωτεϊνών (π.χ. Bcl-2) και ελαττώνοντας τις προ-αποπτωτικές
πρωτεΐνες (π.χ. Bax) τελικά επάγουν την αναστολή της απόπτωσης. Αντιθέτως, η
τεστοστερόνη επιδρά αρνητικά στην επιβίωση των κυττάρων PC12, επάγοντας την
απόπτωση. Η τεστοστερόνη επίσης προσδένεται σε ειδικές μεμβρανικές θέσεις
δέσμευσης, η λειτουργικότητα των οποίων καταδεικνύεται από την επαγωγή της
αύξησης των ενδοκυττάριων επιπέδων ιόντων ασβεστίου. Ως εκ τούτου, η αναλογία
μεμβρανικών θέσεων δέσμευσης οιστραδιόλης και τεστοστερόνης στα κύτταρα
φαιοχρωμοκυττώματος πιθανότατα να παίζει σημαντικό ρυθμιστικό ρόλο στην
επιβίωση και τον κυτταρικό θάνατο των κυττάρων του μυελού των επινεφριδίων.
Μάλιστα η έκφραση των μεμβρανικών θέσεων δέσμευσης τεστοστερόνης δείχνει να
εξαρτάται από τη νευρική διαφοροποίηση των κυττάρων PC12, εφόσον στα νευρικού
τύπου κύτταρα PC12 ελαχιστοποιείται η παρουσία τους. Το φαινόμενο της αντίθετης
δράσης στεροειδών ορμονών διαπιστώθηκε και σε έναν επιπλέον κυτταρικό τύπο, στα
επιθηλιακά καρκινικά κύτταρα μαστού της σειράς Τ47D. Σε αυτά τα κύτταρα, τα
οποία επίσης βρέθηκε να εκφράζουν μεμβρανικούς υποδοχείς οιστρογόνων και
ανδρογόνων, η οιστραδιόλη επάγει μέσω των μεμβρανικών υποδοχέων την προστασία
των κυττάρων κατά της επαγόμενης από έλλειψη ορρού απόπτωσης, ενώ η
τεστοστερόνη οδηγεί τα κύτταρα σε απόπτωση. Επομένως, η αναλογία του αριθμού
οιστρογονικών ή ανδρογονικών μεμβρανικών υποδοχέων πιθανότατα να ελέγχει την
επιβίωση των καρκινικών κυττάρων κι ως εκ τούτου την επιθετικότητα του όγκου.
Πράγματι, βρέθηκε ότι η παρουσία μεμβρανικών οιστρογονικών υποδοχέων είναι
μεγαλύτερη σε επιθετικούς όγκους του μαστού. Επιπρόσθετα, εξετάσθηκε η ύπαρξη
μεμβρανικών θέσεων δέσμευσης στα κύτταρα της σειράς PC12 μίας επιπλέον
στεροειδούς ορμόνης, της δεϋδροεπιανδροστερόνης (DHEA), η οποία είναι γνωστή
για την ευεργετική της δράση στη λειτουργία του νευρικού συστήματος. Η
λειτουργικότητα των εν λόγω μεμβρανικών θέσεων δέσμευσης αποδείχθηκε με την
ακόλουθη γρήγορη αύξηση των επιπέδων κυκλικού cAMP, την ενεργοποίηση της
πρωτεΐνης Src και άλλων σηματοδοτικών μηχανισμών που καταλήγουν στην αναστολή
της προκαλούμενης από έλλειψη ορρού κυτταρικής απόπτωσης. Η DHEA συμπερασματικά
εμφανίζει ανάλογη δράση με την οιστραδιόλη και αντίθετη δράση από την
τεστοστερόνη, η οποία βρέθηκε ότι ανταγωνίζεται τις δράσεις της, συνδεόμενη
στον ίδιο μεμβρανικό υποδοχέα. Εν κατακλείδι, η δράση των στεροειδών μέσω
μεμβρανικών υποδοχέων αφορά πολύπλοκους μηχανισμούς, που οδηγούν σε επαγωγή ή
ελάττωση της κυτταρικής επιβίωσης, ανάλογα με τη στεροειδή ορμόνη και τον υπό
εξέταση κυτταρικό τύπο. Ως εκ τούτου, η αύξηση και η επιβίωση των κυττάρων
ρυθμίζεται από την αναλογία των στεροειδών ορμονών στο μικροπεριβάλλον των
κυττάρων, καθώς και του αριθμού τόσο των κλασικών ενδοκυττάριων όσο και των
μεμβρανικών υποδοχέων των στεροειδών ορμονών. Επομένως, η διαλεύκανση του
μηχανισμού δράσης των στεροειδών ορμονών μπορεί να αποτελέσει τη βάση για την
κατανόηση του ρόλου των σε εκφυλιστικές ασθένειες διαφόρων ιστών και
συστημάτων, καθώς και στον καρκίνο. [6]
§ Τύπου
I υποδοχέας
o Υποδοχέας
φυλετικών ορμονών (φυλετικές ορμόνες)
o Υποδοχέας
ανδρογόνων
o Υποδοχέας
οιστρογόνων
o Υποδοχέας
προγεστερόνης
o Υποδοχέας
γλυκοκορτικοειδών (γλυκοκορτικοειδή)
o Υποδοχέας
αλατοκορτικοειδών (αλατοκορτικοειδή)
§ Τύπου
II υποδοχέας
o Υποδοχέας
βιταμίνης A ( βιταμίνη A)
o Υποδοχέας
βιταμίνης D ( βιταμίνη D)
o Υποδοχέας
ρετινοειδών
o Υποδοχέας
θυροειδών ορμονών
§ Ορφανός
υποδοχέας [7]

Εικόνα 11 [8]
Οι υποδοχείς των στεροειδών ορμονών μοιράζονται μια κοινή δομή
από τέσσερις μονάδες που είναι λειτουργικά ομόλογες, αποκαλούμενες "domains":

Εικόνα 12 [3]
1. Μεταβλητή
περιοχή: ξεκινα με το N-τελικό
άκρο και είναι η πιό μεταβλητή περιοχή μεταξύ των διαφορετικών υποδοχέων.
2. DNA περιοχή
σύνδεσης: Αυτή εντοπίζεται κεντρικά ιδιαίτερα συντηρημένη DNA περιοχή
σύνδεσης (DBD) αποτελείται
από δύο μη - επαναλαμβανόμενα σφαιρικά μοτίβα (PDB: 1HCQ) όπου ο ψευδάργυρος συντονίζεται με
τέσσερες κυστεϊνες και μη ιστιδίνης κατάλοιπα. Η δευτεροταγής και τριτοταγής δομή
τους είναι ευδιάκριτες από αυτά τα κλασικά δάχτυλα ψευδάργυρου. Αυτή η περιοχή
ελέγχει ποιο γονίδιο θα ενεργοποιηθεί. Στο DNA αλληλεπιδρά με στοιχείο απόκρισης ορμονών (HRE).
3.
Περιοχή περιστροφών: This area controls the movement of
the receptor to the nucleus.
4.
Περιοχή σύνδεσης ορμόνης: Συγκρατημένα συντηρημένη
συνδεδεμένη με προσδέτη περιοχή (LBD) μπορεί να περιλάβει το πυρηνικό σήμα εντοπισμού, αμινοξικών ακολουθιών
ικανών συνοδών και μέρη διμερισμού των διεπαφών. Τέτοιοι υποδοχείς συσχετίζονται
πολύ με συνοδούς (ονομαζόμενες θερμικού σόκ πρωτεϊνες hsp90 και hsp56), που απαιτούνται για
να διατηρήσουν την ανενεργό τους (αλλά δεκτική) κυτταροπλασματική διαμόρφωση. Στο
τέλος αυτής της περιοχής είναι το C-τελικό άκρο. Το τελικό άκρο συνδέει το μόριο στο ζευγάρι του
στο ομοδιμερές ή το ετεροδιμερές. Μπορεί να έχει επιπτώσεις στο μέγεθος της
απόκρισης.
Μόνο τύπου I υποδοχείς έχουν πρωτεϊνες θερμικού σόκ (hsp) συνδεμένες με τον ανενεργό υποδοχέα
που θα απελευθερωθεί όταν ο υποδοχέας αλληλεπιδρά με τον προσδέτη. Τύπου I υποδοχείς
μπορούν να βρεθούν μέσα σε ομοδιμερείς ή ετεροδιμερείς μορφές. Τύπου II υποδοχείς
δεν έχουν hsp, και σε
αντίθεση με τον κλασσικό τύπο I υποδοχέα βρίσκονται στον πυρήνα των κυττάρων.
Υπάρχουν κάποια στοιχεία ότι ορισμένοι υποδοχείς στεροειδών ορμονών
μπορούν να επεκταθούν μέσω των λιπιδίων των διεπίπεδων μεμβρανών στην επιφάνεια
των κυττάρων και είναι σε θέση να αλληλεπιδράσουν με τις ορμόνες που παραμένουν
έξω από τα κύτταρα. [9]
Υποδοχείς στεροειδών ορμονών μπορούν επίσης να λειτουργήσουν έξω
από τον πυρήνα και να ζευγαρώσουν με τις κυτταροπλασματικές πρωτεϊνες μεταγωγής
σημάτων όπως η PI3k και
η Akt κινάση.
[10]
Τα ελεύθερα (δηλαδή αποδεσμευμένα) στεροειδή εισέρχονται στο
κυτταρόπλασμα και αλληλεπιδρούν με τον υποδοχέα τους. Σε αυτήν την διαδικασία θερμικού
σοκ η πρωτεϊνη χωρίζεται, και το ενεργοποιημένο σύμπλεγμα υποδοχέα προσδέτη μεταφέρεται
στον πυρήνα. Μετά από την σύνδεση με τον προσδέτη (στεροειδής ορμόνηοι
στεροειδείς υποδοχείς συχνά σχηματίζουν διμερή. Στον πυρήνα οι προσδέτες δρούν
όπως οι παράγοντες μεταγραφής, οι αυξητικοί παράγοντες ή καταστέλλοντας τη
μεταγραφή από συγκεκριμένα γονίδια με τη δράση τους επάνω στο DNA. Κατά συνέπεια παράγεται το αγγελιοφόρο
m RNA που βγαίνει από τον
πυρήνα και αλληλεπιδρά με τα ριβοσώματα. Εκεί, μετά από τη μετάφραση του
γενετικού μηνύματος, παράγονται συγκεκριμένες πρωτεϊνες. Αυτές οι συγκεκριμένες
πρωτεϊνες εκτελούν έναν βιολογικό ρόλο.

Εικόνα 13 Υποδοχείς για
στεροειδείς ορμόνες (a)
Κάθε πυρηνική πρωτεϊνη ορμονικού υποδοχέα έχει μια περιοχή σύνδεσης προσδέτη, που
συνδέεται στο ορμονικό μόριο, και μια DMA-περιοχή σύνδεσης, που συνδέεται στο στοιχείο απόκρισης της
ορμόνης του DMA. (b) Η σύνδεση της ορμόνης προκαλεί
τον διμερισμό του υποδοχέα σε μισές περιοχές ενός στοιχείου απόκρισης της
ορμόνης. Αυτό υποκινεί τη γενετική μεταγραφή (σύνθεση του RNA).[11]
Τύπου II υποδοχείς βρίσκονται στον πυρήνα. Κατά συνέπεια περνούν οι προσδέτες
τους μέσω της κυτταρικής μεμβράνης και του κυτταροπλάσματος και εισέρχονται στον
πυρήνα, όπου ενεργοποίούν τον υποδοχέα χωρίς απελευθέρωση hsp. Ο ενεργοποιημένος υποδοχέας αλληλεπιδρά
με το στοιχείο απόκρισης των ορμονών, και η διαδικασία μεταγραφής κινείται όπως
με τον τύπο I υποδοχέων. [7]

Εικόνα 14 [8]
Τα στοιχεία απόκρισης σε υποδοχείς ορμονών (HRE) για τη στεροειδή
ορμόνη είναι αλληλουχίες DNA με δομή ζεύγους παλινδρομικών ή διαδοχικών αλληλουχιών
συχνά χωρισμένων από τρία νουκλεοτίδια. Αυτά τα στοιχεία μοιάζουν το ένα με το
άλλο στο μήκος τους και τη ρύθμιση αλλά διαφέρουν στις ακολουθίες τους.
Ένα δεδομένο σύμπλεγμα ορμόνης -υποδοχέα είναι δυνατόν να
προκαλέσει μια αλλαγή στην ρύθμιση της έκφρασης του γονιδίου και εξαρτάται από
τη συγκεκριμένη ακολουθία των HRE, την απόσταση των HRE από το
γονίδιο και τον αριθμό των HRE η επιρροή του γονιδίου. [12]
Η βιολογική απόκριση επηρεάζεται από το ποσό των διαθέσιμων ορμονών,
τον διαθέσιμο αριθμό των υποδοχέων δεκτών, το ποσοστό διαχωρισμού του συμπλέγματος
ορμόνης-υποδοχέα με τη συγκεκριμένη περιοχή του DNA, και την αναπλήρωση του αριθμού
των υποδοχέων.[7]

Εικόνα 15 [8]
Οι υποδοχείς των στεροειδών ορμονών είναι πρωτεϊνες που έχουν
μια περιοχή συνδέσεων για κάθε ιδιαίτερο στεροειδές μόριο. Τα στοιχεία απόκρισής
τους είναι DNA ακολουθίες που δεσμεύονται από το συγκρότημα του στεροειδούς
που δεσμεύεται στον υποδοχέα του. Το στοιχείο απόκρισης είναι μέρος του
υποκινητή ενός γονιδίου. Η δέσμευση από το υποδοχέα ενεργοποιεί ή καταστέλλει, εάν
χρειαστεί, τον γονιδιακό έλεγχο μέσω του υποκινητή. Μέσω αυτού του μηχανισμού οι
στεροειδείς ορμόνες ενεργοποιούν ή καταστέλλουν τα γονίδια.
![]()
Εικόνα 16 Οι μισές περιοχές τακτοποιούνται σαν κατευθείαν
επαναλήψεις [8]

Εικόνα 17 [13]
Αυτή η εικόνα παρουσιάζει στερεοσκοπική άποψη των στοιχείων απόκρισης
σε γλυκοκορτικοειδή (στη διπλή έλικα του DNA φαίνονται με κίτρινο στα αριστερά από κάθε πάνελ) με τον υποδοχέα
γλυκοκορτικοειδών (ένα πρωτεϊνικό ομοδιμερές, στη δεξιά περιοχή κάθε πάνελ)
συνδεδεμένο σ’ αυτά.
Η ακολουθία DNA
του στοιχείου απόκρισης σε γλυκοκορτικοειδή είναι:
5' AGAACAnnnTGTTCT
3'
3' TCTTGTnnnACAAGA
5' όπου n οποιοδήποτε νουκλεοτίδιο.
Ο γλυκοκορτικοειδής υποδοχέας, όπως όλοι οι στεροειδείς υποδοχείς
ορμονών, είναι ένας παράγοντας μεταγραφής δάχτυλων ψευδάργυρου;
τα άτομα ψευδάργυρου είναι οι τέσσερις κίτρινες σφαίρες. Κάθε ένας είναι
συνδεμένος με τέσσερες κυστεϊνες (παρουσιασμένες με σκούρο πράσινο).
Για να «ανοίξει» μια στεροειδής ορμόνη τη μεταγραφή γονιδίων, ο υποδοχέας
της πρέπει να:
§
συνδεθεί στην ορμόνη
§ συνδεθεί
σε ένα δεύτερο αντίγραφο του εαυτού του για να σχηματίσει ομοδιμερές
§ βρεθεί
στον πυρήνα, κινούμενος από το κυτταρόπλασμα αν χρειαστεί
§ συνδεθεί
στα στοιχεία απόκρισής του
§ ενεργοποιήσει
άλλους παράγοντες μεταγραφής για να αρχίσει
τη μεταγραφή
Κάθε μια από αυτές τις λειτουργίες εξαρτάται από μια συγκεκριμένη
περιοχή της πρωτεϊνης (π.χ., τα δάχτυλα ψευδάργυρου για τη δέσμευση DNA). Οι μεταλλαγές σε
οποιαδήποτε περιοχή μπορούν να ανατρέψουν τη λειτουργία εκείνης της περιοχής
χωρίς απαραιτήτως να παρέμβει στις λειτουργίες άλλου υποδοχέα. [13]
Οπτικά στοιχεία της σύνδεσης των ορμονών

Εικόνα 18 [13]
Αυτό το αυτοραδιογράφημα παρουσιάζει ενδομήτρια κύτταρα από τη
μήτρα σε ένα ινδικό χοιρίδιο 15 λεπτά μετά από μια έγχυση ραδιενεργού
προγεστερόνης. Η ραδιενέργεια έχει συγκεντρωθεί μέσα στους πυρήνες των κυττάρων
του ενδομήτριου όπως παρουσιάζεται από τους σκούρους κόκκους superimposed στις εικόνες των πυρήνων. Η
ίδια επίδραση φαίνεται όταν ραδιενεργά οιστρογόνα χρησιμοποιούνται. Τα κύτταρα
του ενδομητρίου είναι κύτταρα στόχων και για την προγεστερόνη και για τα
οιστρογόνα, κατά την προετοιμασία της μήτρας για πιθανή εγκυμοσύνη.
Κύτταρα μη-στόχοι (π.χ.. κύτταρα συκωτιού ή λεμφοκύτταρα) δεν
παρουσιάζουν καμία συσσώρευση από θηλυκές φυλετικές ορμόνες. Αν και το DNA τους περιέχει τα στοιχεία
ανταπόκρισης, τα κύτταρά τους δεν
χρειάζονται τους πρωτεϊνικούς υποδοχείς.[13]
Οι πρωτεϊνες δακτυλίου - ψευδάργυρου που λειτουργούν σαν
υποδοχείς για γλυκοκορτικοειδή και προγεστερόνη είναι μέλη μιας μεγάλης
οικογένειας παρόμοιων πρωτεϊνών που λειτουργούν σαν υποδοχείς για ποικίλα
μικρά, υδρόφοβα μόρια. Αυτές
περιλαμβάνουν:
§
άλλες
στεροειδείς ορμόνες όπως
o
η
μεταλλοκορτικοειδής αλδοστερόνη
o
τα
οιστρογόνα
§
η
θυρεοειδής ορμόνη , T3
§ η
καλσιτριόλη, η ενεργός μορφή της βιταμίνης D

§ ρετινοειδή:
βιταμίνη A (ρετινόλη)
και οι συγγενείς της
o
ρετινάλη
o ρετινοϊκό
οξύ (tretinoin — επίσης
διαθέσιμος ως φάρμακο Retin-A); και το ισομερές του
o isotretinoin (πωλείται σαν Accutane για τη θεραπεία της
ακμής).
§ λιπαρά
οξέα. Αυτά δεσμεύουν τα μέλη μιας υπεροικογένειας αποκαλούμενης «υπεροξυσωμάτων
- πολλαπλασιαστικοί - ενεργοποιημένοι υποδοχείς» (PPARs). Πήραν το όνομά τους από την
αρχική ανακάλυψή τους ως υποδοχείς για τα φάρμακα που αυξάνουν τον αριθμό και
το μέγεθος των υπεροξυσωμάτων στα κύτταρα.
Σε κάθε περίπτωση, οι υποδοχείς αποτελούνται από τουλάχιστον
τρεις λειτουργικές περιοχές η domains.
Από το N-τελικό στο C-τελικό άκρο, αυτές είναι:
§ μια
περιοχή που απαιτείται για τον υποδοχέα που θα ενεργοποιήσει τους γονιδιακούς
υποκινητές που ελέγχονται από domain
δακτυλίου ψευδαργύρου απαραίτητα για τη σύνδεση του DNA.
§ domain αρμόδια για τη δέσμευση
μιας ειδικής ορμόνης όπως και η δεύτερη μονάδα διμερούς.[13]
![]()
Εικόνα 19 [8]
Πυρηνική οικογένεια υποδοχέων
Είναι μεγάλη αλλά όχι
πανταχού παρούσα:
§ Τα
θηλαστικά έχουν ~50-60 γονίδια
§ μύγες
21
§ σκουλήκια
270 (!!!)
§ φυτά
0
§ ζύμη
0
§ Μόνο
μια χούφτα φυσιολογικών προσδετών έχουν προσδιοριστεί,
§ (παρά
πολλά γονίδια, τα σκουλήκια στερούνται οποιοδήποτε γνωστό βασισμένο σε λιπίδια
ενδοκρινές σύστημα)
Πυρηνική οικογένεια υποδοχέων (στεροειδείς)
§ Οι
στεροειδείς υποδοχείς ορμονών είναι μέρος της υπεροικογένειας από τους
πυρηνικούς υποδοχείς που περιέχει πάνω από 30 μέλη.
§ Όλα
τα μέλη έχουν συντηρήσει τις περιοχές της υψηλής ομολογίας
§ Η
περιοχή σύνδεσης της ορμόνης 90% ομόλογος
§ 10%
απολογισμοί διαφοράς για την ιδιομορφία
§ DNA περιοχή
σύνδεσης που περιέχει δάχτυλα ψευδάργυρου
§ Οι
υποδοχείς βρίσκονται περιπλεγμένοι με πρωτεϊνες θερμικού σόκ (HSP)
§ Μη
κατειλημμένος υποδοχέας που κρατιέται σε ανενεργό διαμόρφωση από HSP
§ Προσδέτη
σύνδεση με απελευθερώσεις HSP και εκθέσεις DNA περιοχών σύνδεσης
§ Το
σύμπλεγμα υποδοχέα ορμονών μετά δεσμεύεται στα στοιχεία απόκρισης στο γονίδιο και
επιτρέπει στη μεταγραφή να γίνει. [8]

Εικόνα 20 [8]
Η DNA-δεσμευτική περιοχή του υποδοχέα περιέχει δύο σέτ από
τέσσερα κυστεϊνικά κατάλοιπα, και κάθε σύνολο σχηματίζει χηλική ένωση με ένα
ιον ψευδαργύρου, σχηματίζοντας βρόχους γνωστοι σαν "δάκτυλοι ψευδαργύρου".
Ένα μέρος του πρώτου δάκτυλου ψευδαργύρου αλληλεπιδρά άμεσα με
τις νουκλεοτίδες στη μεγάλη αύλακα του TRE DNA, ενώ τα κατάλοιπα στο δεύτερο δάχτυλο αλληλεπιδρούν με τις
νουκλεοτίδες στην μικρή αύλακα του TRE.
Κατά συνέπεια, τα δάχτυλα ψευδάργυρου δημιουργούν την εξειδίκευση στη δέσμευση των TREs. [8]

Εικόνα 21 [8]
Με την εμφάνιση της μοριακής βιολογίας, και την αυξανόμενη ικανότητά
μας να κλωνοποιούμε γονίδια που κωδικοποιούν συγκεκριμένες κατηγορίες πρωτεϊνών,
οι ερευνητές άρχισαν να προσδιορίζουν τα γονίδια που κωδικοποιούν τις πρωτεϊνες
που ήταν σαφώς νέα μέλη από τις συγκεκριμένες κατηγορίες από τους υποδοχείς
ορμονών, χωρίς να δεσμεύουν γνωστές κατηγορίες ορμονών. Αυτοί οι υποδοχείς
έγιναν γνωστοί ως ορφανοί υποδοχείς.[8]
Πώς βρίσκεται ένας
προσδέτης για έναν ορφανό υποδοχέα:
§ Εκμετάλλευση
της μορφωματικής δομής για να ανταλλαγούν οι περιοχές
§ Δοκιμή
σε παροδικές επιμολύνσεις
§ Κατάδειξη
φυσικών συνδέσεων
§ Κατάδειξη
παρουσίας προσδέτη και υποδοχέα στο ίδιο κύτταρο (στις κατάλληλες συγκεντρώσεις)
§ Εύρεση
γονιδίων στόχων και κατάδειξη προσδέτη και υποδοχέα
§ εξαρτώμενη
ρύθμιση in vivo
[8]
Οι στεροειδείς ορμόνες προκαλούν τις αλλαγές μέσα σε ένα κύτταρο
αφού πρώτα περάσουν μέσω της κυτταρικής μεμβράνης των κυττάρων στόχων. Οι
στεροειδείς ορμόνες, αντίθετα από τις μη-στεροειδείς ορμόνες, μπορούν να το κάνουν
αυτό επειδή είναι λιποδιαλυτές. Οι κυτταρικές μεμβράνες αποτελούνται από μια
φωσφολιπιδική διπλοστιβάδα που αποτρέπει τα λιπο - αδιάλυτα μόρια από τη
διάχυση στο κύτταρο.[14]

Εικόνα 22 [15]
Ο μηχανισμός δράσης των στεροειδών ορμονών μπορεί να συνοψιστεί
ως εξής:
1. Πέρασμα
των στεροειδών ορμονών μέσω της κυτταρικής μεμβράνης του κυττάρου στόχου.
2. Η
στεροειδής ορμόνη συνδέεται με έναν συγκεκριμένο υποδοχέα στο κυτταρόπλασμα.
3. Ο
συνδεδεμένος υποδοχέας της στεροειδούς ορμόνης ταξιδεύει στον πυρήνα και
δεσμεύεται σε έναν άλλο συγκεκριμένο υποδοχέα στη χρωματίνη.
4.
Το σύμπλεγμα στεροειδούς ορμόνης - υποδοχέα προκαλεί
την παραγωγή μορίων αγγελιοφόρου RNA (mRNA),
που κωδικεύουν για την παραγωγή των πρωτεϊνών. [14]

Εικόνα 23 [8]

Εικόνα 24 Τρόπος δράσης στεροειδών ορμονών [16]



Εικόνα 25 [8]
Οι αναβολικές στεροειδείς ορμόνες είναι συνθετικές ουσίες που
συσχετίζεται με τις αρσενικές φυλετικές ορμόνες. Έχουν τον ίδιο μηχανισμό
δράσης μέσα στο σώμα. Οι αναβολικές στεροειδείς ορμόνες υποκινούν την παραγωγή
της πρωτεϊνης που χρησιμοποιείται για να χτίσει τους μύες. Οδηγούν επίσης σε αύξηση
της παραγωγής της τεστοστερόνης. Η τεστοστερόνη είναι ορμόνη αρμόδια για την ανάπτυξη
των αρσενικών αναπαραγωγικών οργάνων και των αρσενικών δευτερογενών
χαρακτηριστικών του φύλου. Η τεστοστερόνη είναι επίσης κρίσιμη στην ανάπτυξη
της αδύνατης μάζας των μυών. Οι αναβολικές στεροειδείς ορμόνες προωθούν επίσης
την απελευθέρωση της αυξητικής ορμόνης που υποκινεί την αύξηση, ειδικά την σκελετική
αύξηση. Η κατάχρηση των αναβολικών στεροειδών ορμονών αναστατώνει την κανονική
παραγωγή των ορμονών στο σώμα. Υπάρχουν διάφορες αρνητικές συνέπειες της υγείας
που συνδέονται με την κατάχρηση αναβολικών στεροειδών. Μερικές από αυτές περιλαμβάνουν
τη στειρότητα, απώλεια των μαλιών, ανάπτυξη στήθους στα αρσενικά, καρδιακές
προσβολές, και όγκοι του συκωτιού.[14]
Η δυνατότητα των οιστρογόνων και των ανδρογόνων στην υποκίνηση
της αύξησης διαφόρων ενδοκρινών καρκίνων τεκμηριώνεται καλά και αρκετές ενδοκρινής
θεραπείες χρησιμοποιούνται ευρέως για να μειώσουν τη διαθεσιμότητα των ορμονών
ή για να εμποδίσουν τη δράση τους. Αυτές περιλαμβάνουν μη στεροειδικές ορμόνες ανταγωνιστές όπως tamoxifen και flutamide, στεροειδεικές ενώσεις που
περιλαμβάνουν ICI 182780 και cyproterone
οξικό άλας, και οι δύο στεροειδικοί και μη στεροειδικοί αρωματικοί ανασταλτικοί
παράγοντες. Αν και έχουμε μάθει πολλά περίπου ο μοριακός μηχανισμός από τη
δράση των στεροειδών ορμονών, είναι ακόμα ασαφής ο τρόπος με τον οποίο οι ορμόνες
υποκινούν τον πολλαπλασιασμό των καρκινικών κυττάρων και οι ανταγωνιστές
ορμόνες λειτουργούν. Εν μέρει αυτό είναι ένα αποτέλεσμα της δυνατότητας της
εστραδιόλης και της τεστοστερόνης στη ρύθμιση της έκφρασης πολλών πρωτεϊνών που
εμπλέκονται στον έλεγχο του πολλαπλασιασμού του κυττάρου καθιστώντας δύσκολο το
να προσδιοριστούν οι κρίσιμοι στόχοι. Μερικοί από αυτούς τους στόχους είναι
παράγοντες αύξησης και/ή υποδοχείς τους που υποδεικνύουν ότι τα μιτογενετικά
αποτελέσματα των στεροειδών μπορούν να μεσολαβηθούν από έμμεσους μηχανισμούς
αυτοκρινείς ή παρακρινείς. Εναλλακτικά από τα στεροειδή ρυθμίζεται η έκφραση
ορισμένων κυκλινών ή αναστολέων κινασών και μπορούν να ελέγξουν άμεσα την
πρόοδο του κυτταρικού κύκλου. Μια πρόσφατη εργασία υποδεικνύει αυτό αρκετά καλά
για το γονίδιο της κυκλίνης D1,
με την ίδια την κυκλίνη D1
να μπορεί να είναι ένας κρίσιμος στόχος αλλά και οι τελικές πρωτεϊνες θα
μπορούσαν επίσης να είναι σημαντικές σε διαφορετικές κατηγορίες όγκων.
Ο προσδιορισμός των γονιδίων στόχων για τις στεροειδείς ορμόνες
περιπλέκεται περαιτέρω από την παρατήρηση ότι η σηματοδότηση υποδοχέων
διασταυρώνεται με την σηματοδότηση άλλων μονοπατιών. Θεωρήθηκε αυτή η
σηματοδότηση από υποδοχείς ήταν σχετικά απλή σε σχέση με τα περισσότερα άλλα
σηματοδοτικά μονοπάτια, όπου ο ίδιος ο υποδοχέας είναι ένας παράγοντας
μεταγραφής. Είναι τώρα σαφές εντούτοις, ότι οι παράγοντες αύξησης,
νευροδιαβιβαστές και άλλες ορμόνες είναι σε θέση να διαμορφώσουν τη
δραστηριότητα των υποδοχέων στεροειδών ορμονών. Αυτό σημαίνει ότι αλλαγές στη
δραστηριότητα των υποδοχέων και η έκφραση των μεμονωμένων γονιδίων στόχων
παίρνουν μέρος στον κυτταρικό πολλαπλασιασμό και καθορίζεται όχι μόνο από τα
ορμονικά σήματα αλλά και από αλλαγές σε άλλα σηματοδοτικά μονοπάτια, που
πραγματοποιούνται αναμφισβήτητα κατά τη διάρκεια της εξέλιξης του καρκίνου του
στήθους και του προστάτη. Υποδοχείς είναι επίσης ικανοί για ρύθμιση της
δραστηριότητας διάφορων άλλων παραγόντων μεταγραφής, είτε άμεσα είτε έμμεσα,
και με αυτόν τον τρόπο διαμορφώνουν τη δυνατότητα άλλων σηματοδοτικών
μονοπατιών ελέγχου της μεταγραφής γονιδίων.
Αν και ο ακριβής ρόλος των στεροειδών ορμονών στον
πολλαπλασιασμό των κυττάρων είναι ακόμα λάθος καθορισμένος, τεράστια πρόοδος
έχει σημειωθεί στη διευκρίνιση του ρόλου των ορμονών στην ενεργοποίηση
υποδοχέων και τον μηχανισμό από τον οποίο ανταγωνιστές ορμόνες εμποδίζουν αυτήν
την δραστηριότητα. Ειδικά δύο πρόσφατες πρόοδοι έχουν γίνει που παρέχουν νέες
ιδέες στη δράση στεροειδή ορμονών και τη λειτουργία πυρηνικών υποδοχέων γενικά.
Αρχικά, πρότυπα για την τρισδιάστατη δομή από τη δεσμευτική περιοχή διαφόρων
υποδοχέων έχουν προσδιοριστεί και αφετέρου, νέες πρωτεϊνες έχουν προσδιοριστεί
που αλληλεπιδρούν με τους υποδοχείς κατά τρόπο συνδεόμενο - εξαρτώμενο και
μπορεί να διαδραματίσουν έναν ρόλο στη μεταγραφή γονιδίων. Αυτές οι εξελίξεις
βοηθούν στο να παρέχουν μια καλύτερη κατανόηση του μηχανισμού της δράσης και
των αγωνιστών και τους ανταγωνιστών ορμονών και των συνδέσεων μεταξύ των
πυρηνικών υποδοχέων και άλλων σηματοδοτικών μονοπατιών.[17]
Η έρευνα στρέφεται προς τους μοριακούς μηχανισμούς με τους
οποίους η βιταμίνη D, τα φυλετικά στεροειδή, και άλλες συστεμικές ορμόνες
ρυθμίζουν την παραγωγή καθώς επίσης και την κυτταρική δραστηριότητα της
οστεο-διαμόρφωσης οστεοβλαστών και οστεο - επαναπορρόφηση οστεοκλαστών. Αυτοί
οι δύο τύποι κυττάρων ενεργούν στο συντονισμό και τη διατήρηση της σκελετικής
ακεραιότητας και για να παρέχουν στους σπονδυλωτούς οργανισμούς τα μέταλλα όπως
το ασβέστιο και ο φώσφορος, και οι συντονισμένες και ισορροπημένες ενέργειές
τους είναι ουσιαστικές σε αυτές τις διαδικασίες. Επιδιώκουμε μια λεπτομερή
κατανόηση του λειτουργικού ρόλου κάθε μια από αυτές τις ορμόνες στην κανονική
σκελετική βιολογία καθώς επίσης και του ενδεχομένως θεραπευτικού ρόλου τους σε
ασθένειες όπως η αρθρίτιδα, η οστεοπόρωση, και οι οστεολυτικές ασθένειες που
συνδέονται με το μεταστατικό καρκίνο του στήθος και τον προστατικό καρκίνο. [18]
Ένας μακροπρόθεσμος τομέας ενδιαφέροντος ήταν η δράση της
βιταμίνης D Είναι γνωστό ότι διαδραματίζει έναν σημαντικό ρόλο στη σκελετική
ομοιόσταση, που λειτουργεί και για να υποκινήσει το σχηματισμό οστών καθώς
επίσης και την επαναπορρόφηση των οστών. Αυτές οι δράσεις μεσολαβούν από έναν
συγκεκριμένο υποδοχέα που είναι εντοπισμένος στον πυρήνα των κυττάρων στόχων
και που λειτουργεί ως παράγοντας μεταγραφής μετά από την ενεργοποίηση από την
ορμονική βιταμίνη D προσδέτη. Η έρευνά οδήγησε στη μοριακή κλωνοποίηση αυτών
των παραγόντων και τη διευκρίνιση της ρύθμισής της και το μηχανισμό της δράσης
της. Οι τρέχουσες μελέτες επιδιώκουν να επεκτείνουν τη γνώση για το πώς
λειτουργούν αυτά τα σημαντικά μόρια των υποδοχέων για να ρυθμίσουν τη μεταγραφή
και για να προσδιορίσουν τα ρυθμιστικά γονίδια της βιταμίνης D που μεσολαβούν
στη λειτουργία των οστεοβλαστών και των οστεοκλαστών. [18]
Ένας πιό πρόσφατος τομέας ενδιαφέροντος είναι στις μοριακές δράσεις
των φυλετικών στεροειδών. Εκτός από τους αναπαραγωγικούς ρόλους τους, το
οιστρογόνο και το ανδρογόνο ασκούν προστατευτικές δραστηριότητες στα οστά. Κατά
συνέπεια, η απώλεια αυτών των ορμονών κατά τη διάρκεια της διαδικασίας γήρανσης
ή μετά από την εμμηνόπαυση οδηγεί σε μια δραματική απώλεια μετάλλων στα οστά
και έναν αυξανόμενο κίνδυνο σπασίματος. Και τα οιστρογόνα και τα ανδρογόνα
λειτουργούν μέσω των πυρηνικών υποδοχέων τους για να περιορίσουν την παραγωγή
των οστικών οστεοκλαστών επαναπορρόφησης μέσω μιας άμεσης δράσης που
καταστέλλει την διαφοροποίηση των οστεοκλαστών. Οι τρέχουσες μελέτες στρέφονται
στην κατανόηση και αυτής της κυτταρικής διαδικασίας διαφοροποίησης καθώς επίσης
και των μοριακών μηχανισμών που χρησιμοποιούνται από το οιστρογόνο για να
εμποδίσουν αυτό το σημαντικό γεγονός. Αυτές οι μελέτες περιλαμβάνουν τη χρήση των
DNA microarrays για να προσδιορίσουν τα ρυθμιστικά γονίδια που συμμετέχουν στη
διαδικασία διαφοροποίησης. Οι μελέτες είναι πιθανό να οδηγήσουν σε μια καλύτερη
κατανόηση των μονοπατιών που ρυθμίζουν τον σχηματισμό οστεοκλαστών και στον
προσδιορισμό των νέων οιστρογενικών ειδών με μεγαλύτερες προστατευτικές
ιδιότητες οστών.[18]

Εικόνα 26 [18]
Εικόνα Αριστερή εικόνα
(20X):Μεγάλοι οστεοκλάστες(έντονα βέλη) διαμορφώνεται in vitro από μικροσκοπικά
μονοπύρηνα κύτταρα προδρόμων (διακεκκομένο βέλος). Δεξιά εικόνα(10X): Σκοτεινή
κοκκιώδης επαπορρόφηση οστών ακολουθίες/κοιλώματα που δημιουργούνται από
λειτουργικούς οστεοκλάστες που φαίνονται στην αριστερή εικόνα. [17]
Οι φυλετικές στεροειδείς ορμόνες – οιστρογόνα, προγεστερόνες και
ανδρογόνα - διαδραματίζουν έναν κεντρικό ρόλο στην ανάπτυξη και την κανονική
φυσιολογία του στήθους, του προστάτη, των ωοθηκών και της μήτρας. Παίζουν
επίσης σημαντικό ρόλο στην ανάπτυξη και την πρόοδο των καρκίνων αυτών των
οργάνων, που αποτελούν ~30% όλων των
πρόσφατα διαγνωσθέντων καρκίνων. Δεδομένου ότι η απώλεια των κανονικών ελέγχων
του πολλαπλασιασμού είναι μια από τις σφραγίδες του καρκίνου, στόχος είναι να
αναπτυχθεί μια καλύτερη κατανόηση για το πώς οι φυλετικές στεροειδείς ορμόνες,
οι υποδοχείς τους και τα σηματοδοτικά μονοπάτια περιλαμβάνονται στον κανονικό
έλεγχο του πολλαπλασιασμού των κυττάρων και της διαφοροποίησης, πώς αυτοί οι
μηχανισμοί χάνονται στον καρκίνο και πώς αυτά τα μονοπάτια μπορούν να
χειριστούν για να θεραπευτεί και να προληφθεί ο καρκίνος του μαστού.[19]
Το ερευνητικό ενδιαφέρον
είναι στραμμένο στην κατανόηση του μοριακού μηχανισμού με τον οποίο οι
στεροειδείς ορμόνες ρυθμίζουν την έκφραση των γονιδίων κατά τη διάρκεια της
κανονικής και κακοήθους αύξησης και εξέλιξης των κυττάρων. Στην ρύθμιση της
έκφρασης των γονιδίων από τις στεροειδείς ορμόνες μεσολαβούν οι συγκεκριμένοι
ενδοκυτταρικοί υποδοχείς. Οι στεροειδείς υποδοχείς ανήκουν σε μια μεγάλη
οικογένεια προσδετών - προκληθέντων παραγόντων μεταγραφής. Οι συνενεργοποιητές
(όπως τα SRC-1, CBP, p/CAF and TIF2) είναι σημαντικοί για τους στεροειδείς υποδοχείς
για να επιτύχουν την πλήρη μεταγραφική ενεργοποίηση γονιδίων.
Συνενεργοποιητής
![]()
Εικόνα 27 [20]
Συγκαταστολέας
![]()
Εικόνα 28[20]
SRC-1: Στεροειδής υποδοχέας συνενεργοποιητής-1
1. 160 Kda; 1440 aa.
2. Σε ένα σύστημα
δοκιμής αναφοράς, ενισχυμένης διενεργοποίησης (5-10X) από υποδοχείς.
3. Περιέχει 3 μεταβιβάσιμες
περιοχές ενεργοποίησης.
4. Ανταγωνιστής RU486 καταργεί η δυνατότητα
της SRC-1 να
αλληλεπιδράσει και να συνεπιδράσει με PR.
5. Επίσης λέγονται
NcoA-1.
6. LXXLL δομή
που αλληλεπιδρά με NRs
(AF-2 περιοχή).
7. SRC-3 (AIB-1) ενισχύεται σε πολλές περιπτώσεις
από τον καρκίνο του μαστού. Προσελκύουν CBP και PCAF. [8]
Η αλληλεπίδραση με τα συστατικά των γενικών μηχανησμών
μεταγραφής - συμπεριλαμβανομένου των TFIIB, TFIID συμπλεγμάτων, και μέλη του
συμπλέγματος της RNA πολυμεράσης - μπορεί να παρέχει το μηχανισμό από τον οποίο
οι στεροειδείς υποδοχείς επιτυγχάνουν την ιδιομορφία που απαιτείται για την
έκφραση των διαφορετικών δικτύων γονιδίων στους ιστούς στόχων. Ο προστατικός
αδένας ανταποκρίνεται ιδιαίτερα στις φυλετικές στεροειδείς ορμόνες και έτσι
είναι ένα ελκυστικό βιολογικό πρότυπο για να διευκρινίσει τη μοριακή βάση της
δράσης των στεροειδών ορμονών. Οι μελέτες εστιάζουν στις αλληλεπιδράσεις των υποδοχέων
των στεροειδών ορμονών με τα συστατικά των γενικών μηχανισμών μεταγραφής,
συμπεριλαμβανομένων των συνενεργοποιητών ή/και των πρωτεϊνών προσαρμοστών που
είναι σχετικές με την έκφραση γονιδίων στόχων στον προστατικό αδένα. Αυτές οι
μελέτες είναι κλινικής σχετικότητας επειδή η δυσλειτουργία των στεροειδών
ορμονών συνδέεται με την παθολογική πρόοδο διάφορων ασθενειών,
συμπεριλαμβανομένου του καρκίνου του προστάτη.[21]
[1] http://en.wikipedia.org/wiki/Steroid_hormone
[2] Martin G. Low, Dept. Physiology, Endocrine System:
Fall 2003
[3] Janice
Dodd, Ph.D., Endocrinology &
Metabolism, Molecular Endocrinology, Department of Physiology
[4] http://mercury.bio.uaf.edu/courses/biol310/Endocrine%20lecture%201.ppt
[5] Λάζου Αντιγόνη, Φυσιολογία.
Τόµος B', Θεµατική Ενότητα ΓENETIKH, ΕΛΛΗΝΙΚΟ ΑΝΟΙΚΤΟ ΠΑΝΕΠΙΣΤΗΜΙΟ, Σχολή
Θετικών Επιστηµών και Τεχνολογίας, ΠATPA 2001, σελ. 109-111
[6] http://dlib.libh.uoc.gr/Dienst/UI/2.0/Describe/uch.med.phd/2005alexaki?Language=English
[7] http://en.wikipedia.org/wiki/Steroid_hormone_receptor
[9] Luconi M, Francavilla F, Porazzi I, Macerola B, Forti G, Baldi E. Human spermatozoa as a model for studying
membrane receptors mediating rapid nongenomic effects of progesterone and
estrogens. Steroids 2004;69:553-9. PMID 15288769.
[10] Aquila S, Sisci D, Gentile M, Middea E, Catalano S, Carpino A, Rago V, Ando
S. Estrogen receptor (ER)alpha and ER
beta are both expressed in human ejaculated spermatozoa: evidence of their
direct interaction with phosphatidylinositol-3-OH kinase/Akt pathway. J
Clin Endocrinol Metab 2004;89:1443-51. PMID 15001646.
[11] Fox Human Physiology, The Mc Graw
Hill, 8th Ed., 2003, p.293
[12] David L. Nelson, Michael M. Cox. Lehninger
Principles of Biochemistry, Third Edition. W.H. Freeman & Company; 3rd
Bk&CD edition (May 1, 2000). ISBN 1-57259-931-6
[13] http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/S/SteroidREs.html
[14] http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/S/SteroidREs.html
[15] Mader S. Sylvia, Understanding Human
Anatomy and Physiology, The Mc Graw Hill, 2004, p.201
[16] Despopoulos, Color Atlas of
Physiology, Thiem 2003, p.291
[17] R White
and M G Parker, Molecular mechanisms of
steroid hormone action, Molecular Endocrinology Laboratory, Imperial Cancer
Research Fund, 44 Lincoln's Inn Fields, London WC2A 3PX, UK , Endocrine-Related
Cancer DOI: 5 (1) 1-14 10.1677/erc.0.0050001
[18] http://www.biochem.wisc.edu/faculty/pike/
[19] http://www.garvan.org.au/content.aspx?mid=3&iid=365
[20] Annu. Rev. Physiol. 2004.
66:315–60
[21] http://apodaca2.dept-med.pitt.edu/CBP_SURP/Pages/Onate.html
Η µνήµη θα µπορούσε να ορισθεί ως η διαδικασία κατά την οποία η
γνώση κωδικοποιείται, αποθηκεύεται και στη συνέχεια ανακαλείται. Η αποθήκευση
της µνήµης δεν γίνεται σε ένα συγκεκριµένο τµήµα ή περιοχή του εγκεφάλου.
Υπάρχουν πολλοί διαφορετικοί τύποι µνήµης και για κάθε τύπο διαφορετική περιοχή
του εγκεφάλου είναι σηµαντική για την αποθήκευσή της. Αδρά θα µπορούσαµε να
ταξινοµήσουµε τη µνήµη σε Πρόσφατη Μνήµη (Short-term memory) και Μακροχρόνια
Μνήµη (Long-term memory).[α]
ΜΝΗΜΗ: η
διατήρηση σχέσεων μεταξύ ερεθισμάτων και συμπεριφορών, πράξεων και επακόλουθων
στον χρόνο.
Αποθήκευση εσωτερικών (νοητών) παραστάσεων δράσεων και
αντιδράσεων στο χρόνο.
ΒΡΑΧΥΠΡΟΘΕΣΜΗ ΜΝΗΜΗ:
ανεξάρτητη μεταγραφής και μετάφρασης εξαρτάται απο διαρκή δραστηριότητα
κινασών, ή διατήρηση φωσφορηλιώσεων / αποφωσφορυλιώσεων.
ΧΡΟΝΙΚΗ ΔΙΑΡΚΕΙΑ: λεπτά-δεκάδες λεπτών
ΜΝΗΜΗ ΜΕΣΗΣ ΔΙΑΡΚΕΙΑΣ:
εξαρτάται απο μετάφραση και όχι απο μεταγραφή.
Προυπάρχοντα μετάγραφα. μετάφραση σε συνάψεις.
ΧΡΟΝΙΚΗ ΔΙΑΡΚΕΙΑ: δεκάδες λεπτών-ώρες
ΜΑΚΡΟΠΡΟΘΕΣΜΗ ΜΝΗΜΗ:
εξαρτάται από μεταγραφή και μετάφραση νεων μετάγραφων
ΧΡΟΝΙΚΗ ΔΙΑΡΚΕΙΑ: ώρες-χρόνια
ΕΔΡΑΙΩΣΗ/ΜΟΝΙΜΟΠΟΙΗΣΗ/ΕΜΠΕΔΩΣΗ
(CONSOLIDATION):
η διαδικασία(ιες) «σταθεροποίησης» νέων εμπειριών και σχέσεων
(Μάθηση) σε «μορφή» προς αποθήκευση.
ΑΝΑΚΛΗΣΗ (RETRIEVAL):
η διαδικασία(ιες) χρήσης μνήμης στην
συμπεριφορά. ανεξάρτητη(?), εξαρτημένη.
ΕΠΑΝΕΔΡΑΙΩΣΗ
(RECONSOLIDATION) : η διαδικασία(ιες) «ενδυνάμωσης» εδραιωμένης μνήμης
μετά από ανάκληση. επανάληψη διαδικασίας μάθησης και εδραίωσης.
ΛΗΘΗ (FORGETTING):
ενεργή (?) διαδικασία(ιες) φθοράς ισχύος μη
επανεδραιούμενων νοητών παραστάσεων με πάροδο χρόνου.
ΑΠΟΣΒΕΣΗ/ΕΞΑΛΕΙΨΗ
(EXTINCTION): ενεργή αντικατάσταση μιας νοητής παράστασης/σχέσης
ερεθισμάτων με άλλη.
Απώλεια προβλεψιμότητας αντίδρασης σε σχέση με συγκεκριμένο ερέθισμα.
«ξε-μάθημα» [στ]
 [στ]
[στ]
 [στ]
[στ]
Short-term μνήμη Η έννοια Short-term memory
δηλώνει ένα χρονικά περιορισµένο σύστηµα µνήµης όπου τα µνηµονικά στοιχεία
χάνονται αυθόρµητα µέσα σε δευτερόλεπτα, δηλαδή έχει περιορισµένη χωρητικότητα.
Ειδική µορφή και επέκταση της Short-term μνήμη αποτελεί η Working Μνήμη η οποία
διαφέρει στα εξής: 1) θεωρείται ότι εµπεριέχει έναν αριθµό υποσυστηµάτων και 2)
δίνεται ιδιαίτερη έµφαση στο λειτουργικό της ρόλο σε άλλες νοητικές διεργασίες
(όπως µάθηση, διαλογισµός, κατανόηση) αλλά και στη Long-term μνήμη όπως θα
δούµε παρακάτω. Τρία είναι τα υποσυστήµατα που θεωρείται ότι συνθέτουν τη
Working Μνήμη. Ένα σύστηµα ελέγχου της προσοχής (ή κεντρικό εκτελεστικό-central
executive) το οποίο επικεντρώνει την προσοχή σε συγκεκριµένα γεγονότα στο
περιβάλλον. Θεωρείται ότι βρίσκεται στον προµετωπιαίο λοβό και έχει
περιορισµένη χωρητικότητα. Το σύστηµα ελέγχου της προσοχής ρυθµίζει τη ροή των
πληροφοριών προς δύο επαναληπτικά συστήµατα που θεωρείται ότι διατηρούν την
µνήµη για προσωρινή χρήση: το articulatory loop για τη γλώσσα και το
visuospatial sketch pad για τις εικόνες και τη δράση. Οι πληροφορίες που
επεξεργάζονται σε κάθε ένα από αυτά τα επαναληπτικά συστήµατα Working Μνήμη έχουν
την ικανότητα να µετατρέπονται σε Long-term memory. Τα δύο επαναληπτικά
συστήµατα πιστεύεται ότι βρίσκονται σε διαφορετικές περιοχές του οπίσθιου
συνειρµικού φλοιού (posterior association cortices).
Long-term memory H
Long-term memory µπορεί να διακριθεί σε implicit memory ( ή nondeclarative
memory-µη δηλωτική µνήµη) και σε explicit memory (ή declarative memoryδηλωτική
µνήµη) (Εικ. 1).[α]

Εικόνα 1 Ταξινόµηση της Long-term
memory [α]
Α. Implicit Memory Η implicit μνήμη αναφέρεται σε πληροφορίες
σχετικά µε το πώς γίνεται κάτι, µια µνήµη που ανακαλείται ασυνείδητα. Είναι
αρκετά άκαµπτη και στενά συνδεδεµένη µε το αρχικό ερέθισµα που προκάλεσε τη
µάθηση. Η implicit memory τυπικά εµπλέκεται µε εκµάθηση αντανακλαστικών
κινήσεων ή αντιληπτικών δεξιοτήτων. Η µνήµη αυτή αποκτάται αργά, µε πολλαπλή
επανάληψη και εκφράζεται κυρίως µε πράξεις παρά µε λόγο. ∆ιαφορετικοί τύποι της
implicit memory αποκτούνται µέσα από διαφορετικές διαδικασίες µάθησης και
αποθηκεύονται σε διαφορετικές περιοχές του εγκεφάλου. Πειραµατικά δεδοµένα
χωρίζουν την implicit memory σε µη σχετιζόµενη (nonassociative memory) και σε
σχετιζόµενη µνήµη (associative memory). Στην
nonassociative μνήμη το υποκείµενο µαθαίνει τις ιδιότητες ενός
ερεθίσµατος και στην καθηµερινή ζωή δύο τύποι αυτής είναι συχνοί: το
Habituation (µείωση της απάντησης όταν το ερέθισµα επαναλαµβάνεται συνεχώς και
το Sensitization (αυξηµένη αντίδραση σε µια ποικιλία ερεθισµάτων µετά από την
εφαρµογή ενός επώδυνου ερεθίσµατος). Στην associative memory το υποκείµενο
µαθαίνει τη σχέση µεταξύ δύο ερεθισµάτων ή µεταξύ ενός ερεθίσµατος και µιας
συµπεριφοράς. Και εδώ διακρίνονται δύο τύποι: Classical conditioning (µάθησης
της σχέσης µεταξύ δύο ερεθισµάτων) και Operant conditioning (µάθηση της σχέσης
µεταξύ µιας συµπεριφοράς και των αποτελεσµάτων αυτής). [α]
Β. Explicit Memory Η
explicit memory αναφέρεται σε πραγµατική γνώση ανθρώπων, χώρου και πραγµάτων
και στο τι τα γεγονότα αυτά σηµαίνουν. Ανακαλείται µε εσκεµµένη, συνειδητή,
προσπάθεια. Η explicit memory είναι πάρα πολύ ευέλικτη και εµπεριέχει το
συνδυασµό πολλαπλών στοιχείων και πληροφοριών. Η explicit μνήμη µπορεί να
διακριθεί περαιτέρω σε episodic (µια µνήµη για γεγονότα και προσωπικές
εµπειρίες) και σε semantic (µια µνήµη για δεδοµένα). Η explicit μνήμη περιλαµβάνει
µια ειδική ανατοµική περιοχή στο µέσο κροταφικό λοβό καθώς και έναν σχηµατισµό
στο βάθος αυτού, τον ιππόκαµπο. (Εικ. 2) [α]

Eικόνα 2 Ανατοµία της
explicit memory. Ο ιππόκαµπος και οι λοιπές περιοχές του εγκεφάλου που εµπλέκονται
στην explicit memory [α]
Αναλυτικότερα, η γνώση που αποθηκεύεται ως explicit memory
αρχικώς σχηµατίζεται µέσω διαδικασιών σε µία ή περισσότερες από τις τρεις
πολυδύναµες συνειρµικές φλοιϊκές περιοχές (προµετωπιαίο, µεταιχµιακό και
βρεγµατο-ινιακοκροταφικό φλοιό) όπου συνθέτονται οπτικές, ακουστικές και
σωµατικές πληροφορίες. Στη συνέχεια η πληροφορία µεταβιβάζεται στον ενδορρινικό
φλοιό. Από εκεί διανέµεται η πληροφορία σε διάφορες φλοιϊκές περιοχές, όπου
ανάλογα µε το είδος της πληροφορίας γίνεται η επεξεργασία της, για να
επιστρέψει και πάλι πίσω στον ενδορρινικό φλοιό. Τελικά η πληροφορία καταλήγει
εκεί όπου αρχικά δηµιουργήθηκε, στις πολυδύναµες συνειρµικές περιοχές του
νεοφλοιού όπου και αποθηκεύεται (Εικ. 3).

Εικόνα 3 [α]
Μπορούµε εν κατακλείδι να πούµε ότι δεν υπάρχει µια µόνο µνήµη
ούτε ένα συγκεκριµένο µέρος του εγκεφάλου που να λειτουργεί ως αποθήκη µνήµης.
Κάθε κοµµάτι πληροφορίας/ γνώσης έχει πολλαπλές αντιπροσωπεύσεις στον εγκέφαλο,
κάθε µια από τις οποίες αντιστοιχεί σε διαφορετική έννοια και µπορεί να
προσεγγιστεί ανεξάρτητα (από οπτικά, λεκτικά ή αισθητικά ερεθίσµατα). Η
explicit μνήμη, όπως και η implicit, έχει µια short term φάση που δεν απαιτεί
πρωτεϊνοσύνθεση και µια long term φάση που απαιτεί τη σύνθεση νέων πρωτεϊνών
και αυτό αναπαριστάται και στο µοριακό επίπεδο, όπως θα δούµε παρακάτω. Τόσο η
episodic memory όσο και η semantic memory είναι το αποτέλεσµα τουλάχιστον
τεσσάρων σχετιζόµενων αλλά ανεξάρτητων διαδικασιών: της κωδικοποίησης
(encoding) που αναφέρεται στη διαδικασία µε την οποία οι πρόσφατες πληροφορίες
επεξεργάζονται. Για να επιµείνει µια µνήµη θα πρέπει να γίνει σωστή
κωδικοποίηση. Αυτό επιτυγχάνεται µε το να συνδυάζεται νοηµατικά και συστηµατικά
η πληροφορία µε γνώσεις που είναι ήδη ισχυρά εδραιωµένες, του συσχετισµού
(consolidation) που αναφέρεται στη διαδικασία εκείνη κατά την οποία οι
προσφάτως αποθηκευµένες και ακόµη ευαίσθητες πληροφορίες, αλλάζουν για να
γίνουν πιο σταθερές στην µακροχρόνια αποθήκευση. Εµπλέκει την έκφραση γονιδίων
και τη σύνθεση νέων πρωτεϊνών , της αποθήκευσης (storage) που αναφέρεται στο
µηχανισµό και στις θέσεις που κρατείται η µνήµη µέσα στο χρόνο και της
ανάκλησης (retrieval)που αναφέρεται στη διαδικασία ανάκλησης και χρήσης των
αποθηκευµένων πληροφοριών. [α]
Ιππόκαµπος και Long-term ενδυνάμωση Στα θηλαστικά ένας
σηµαντικός παράγοντας για την αποθήκευση της explicit μνήμη είναι ο ιππόκαµπος.
Στους ανθρώπους η λειτουργική απεικόνιση του εγκεφάλου δείχνει ότι ο ιππόκαµπος
ενεργοποιείται κατά τη διάρκεια συγκεκριµένων µνηµονικών διαδικασιών και ότι
βλάβη του ιππόκαµπου έχει ως αποτέλεσµα την αδυναµία σχηµατισµού συγκεκριµένων
τύπων νέας µνήµης. Αν και πολλές άλλες περιοχές του εγκεφάλου εµπλέκονται στις
πολύπλοκες διαδικασίες του σχηµατισµού, αποθήκευσης και ανάκλησης της µνήµης,
οι παρατηρήσεις έχουν στρέψει σήµερα την έρευνα στον συγκεκριµένο αυτό τύπο
συναπτικής πλαστικότητας του ιππόκαµπου. (Εικόνα 4) [ι]

Εικόνα 4 [ι]
Όπως αποδείχθηκε στον ιππόκαµπο υπάρχουν τρεις οδοί: 1)
perforant pathway το οποίο προβάλλει από τον ενδορρινικό φλοιό στα κοκκώδη
κύτταρα της οδοντωτής έλικας 2) mossy fiber pathway το οποίο περιλαµβάνει τους
νευράξονες των κοκκωδών κυττάρων οι οποίοι προβάλλουν στα πυραµοειδή κύτταρα
της CA3 περιοχής του ιππόκαµπου και 3) Schaffer collateral pathway το οποίο
αποτελείται από τις διεγερτικές ίνες των πυραµοειδών κυττάρων της CA3 περιοχής
και καταλήγει στα πυραµοειδή κύτταρα της CA1 περιοχής (Εικ. 5). [ι]

Εικ. 5 LTP. Αύξηση
του εύρους των διεγερτικών µετασυναπτικών δυναµικών µετά από µια σειρά
ερεθισµάτων υψηλής συχνότητας και παραγωγή του LTP. [ι]
Το 1973 οι Timothy Bliss και Terje Lomo ανακάλυψαν ότι µια
σύντοµη, υψηλής συχνότητας σειρά ερεθισµάτων (tetanus), σε οποιοδήποτε από
αυτές τις τρεις συναπτικές οδούς, αυξάνει το εύρος των διεγερτικών
µετασυναπτικών δυναµικών (excitatory postsynaptic potentials-EPSPs) στους
νευρώνες-στόχους του ιππόκαµπου (Εικ. 5) προκαλώντας µεταβολές της συναπτικής
πλαστικότητας. Η διευκόλυνση αυτή της νευρωνικής µεταβίβασης ονοµάζεται
long-term potentiation (LTP). [ι]
Όπως συµβαίνει µε την αποθήκευση της µνήµης, και το LTP έχει
φάσεις. Ένα µεµονωµένο ερέθισµα παράγει ένα βραχυχρόνιο LTP, που ονοµάζεται
πρώιµο LTP (early LTP), διαρκεί 1-3 ώρες και δεν απαιτεί τη σύνθεση νέων
πρωτεϊνών. Τέσσερα ή περισσότερα ερεθίσµατα προκαλούν µια πιο επίµονη φάση του
LTP, που ονοµάζεται όψιµο LTP (late LTP), διαρκεί τουλάχιστον 24 ώρες και
απαιτεί τη σύνθεση νέων πρωτεϊνών. Οι µηχανισµοί που παράγουν το early LTP δεν
είναι οι ίδιοι στις τρεις οδούς, ενώ οι µηχανισµοί του late LTP φαίνεται να
είναι οι ίδιοι [ι]
Οι ιδιότητες του LTP στην
οδό του Schaffer collateral
Ιδιαίτερα το LTP στην οδό του Schaffer collateral έχει
συγκεκριµένες ιδιότητες που το καθιστούν έναν ελκυστικό νευρωνικό µηχανισµό για
τη µελέτη της διαδικασίας αποθήκευσης της µνήµης. Πρώτων, για την πρόκληση του
LTP στην οδό του Schaffer collateral απαιτείται ενεργοποίηση πολλών µαζί αξόνων
που κατευθύνονται προς τη CA1 περιοχή, ένα χαρακτηριστικό που καλείται
cooperativity (συνεργικότητα). ∆εύτερον, στην οδό αυτή απαιτείται ταυτόχρονη
πυροδότηση τόσο του προσυναπτικού όσο και του µετασυναπτικού νευρώνα για να
επιτευχθεί επαρκής αποπόλωση (depolarization) του µετασυναπτικού νευρώνα. Εάν
ένα µόνο ερέθισµα στην οδό του Schaffer collateral, που φυσιολογικά δεν θα
προκαλούσε την έκλυση LTP, συνδυάζεται µε ισχυρή αποπόλωση του µετασυναπτικού
CA1 κυττάρου µέσα σε µικρό χρονικό διάστηµα της τάξης των 100ms, το µέγεθος του
EPSP αυξάνεται και παράγεται το LTP. Το τελευταίο χαρακτηριστικό συνάδει µε τον
κανόνα του Hebb που διατυπώθηκε το 1949 και σύµφωνα µε τον οποίο: « Όταν ο
άξονας ενός κυττάρου Α…διεγείρει ένα κύτταρο Β και επανειληµµένως ή συνεχώς
παίρνει µέρος στην ενεργοποίησή του, µια αυξητική διεργασία ή µια µεταβολική
αλλαγή λαµβάνει χώρα στο ένα ή και στα δύο κύτταρα ώστε η ικανότητα του Α
κυττάρου να διεγείρει το Β κύτταρο να αυξάνεται». Τέλος, το LTP έχει την
ικανότητα της ειδικότητας του εισερχόµενου ερεθίσµατος: Όταν το LTP παράγεται
από τη διέγερση µιας σύναψης, δεν εµφανίζεται σε άλλες ανενεργές συνάψεις που
είναι σε επαφή µε τον ίδιο νευρώνα. Μπορούµε λοιπόν να πούµε ότι το LTP
ενεργοποιεί αυστηρά συνάψεις παρά κύτταρα. Το χαρακτηριστικό αυτό του LTP είναι
σύµφωνο µε τη συµµετοχή του στο σχηµατισµό της µνήµης. Εάν η διέγερση µιας
σύναψης οδηγούσε στη µεταβολή του δυναµικού και άλλων απενεργοποιηµένων συνάψεων,
θα ήταν δύσκολο να αυξηθεί επιλεκτικά το συναπτικό δυναµικό συγκεκριµένων
συνάψεων, όπως αυτό απαιτείται για το σχηµατισµό της µνήµης. [ι]

Εικόνα 6 [στ]
Οι µοριακοί µηχανισµοί της µνήµης αποδείχθηκε ότι διατηρούνται
στην πορεία της εξέλιξης και ότι ακόµη και οι πιο πολύπλοκες µορφές µνήµης και
µάθησης εξαρτώνται από µηχανισµούς που συναντάµε στις απλές µορφές. Οι
µηχανισµοί αυτοί συµβάλλουν στην ατοµικότητα µε το να µεταβάλλουν τις νευρικές
συνάψεις στον εγκέφαλό µας. Σε κάθε είδος µνήµης εµπλέκονται διαφορετικοί
µοριακοί µηχανισµοί, µε τα συστήµατα των δευτέρων αγγελιοφόρων να παίζουν
πρωταγωνιστικό ρόλο. Έχει πλέον αποδειχθεί ότι στη διαδικασία της µνήµης
εµπλέκονται διάφορα συστήµατα νευροµεταβιβαστών τα οποία λειτουργούν µέσω της
ενεργοποίησης συστηµάτων δεύτερων αγγελιοφόρων µε τελικό στόχο την πλαστικότητα
των συνάψεων. Τα πιο καλά µελετηµένα συστήµατα νευροµεταβιβαστών είναι αυτά της
σεροτονίνης και του γλουταµικού οξέος, µε τα οποία και θα ασχοληθούµε. Στη
συνέχεια θα παρουσιάσουµε αναλυτικά τα τελευταία ερευνητικά δεδοµένα που
προκύπτουν για τους µοριακούς µηχανισµούς-και ιδιαίτερα για τα συστήµατα των
δευτέρων αγγελιοφόρων-που χαρακτηρίζουν κάθε ένα από τα προαναφερόµενα µοντέλα
µνήµης σε διάφορους υπό µελέτη οργανισµούς. [α]
Οι µέθοδοι που χρησιµοποιούνται για τη µελέτη των µοριακών
µηχανισµών της µνήµης είναι ποικίλοι. Το φυλογενετικό εύρος των οργανισµών που
χρησιµοποιούνται είναι µεγάλο και περιλαµβάνει ασπόνδυλα, όπως το γιγάντιο
καλαµάρι Aplysia, αλλά και θηλαστικά, κυρίως επίµυες. Συµπεριφορικές µελέτες,
µοριακές τεχνικές, διαγονιδιακοί οργανισµοί αλλά και συνδυασµός όλων των
παραπάνω είναι τα όπλα της σύγχρονης επιστήµης για τη µελέτη των µνηµονικών
µηχανισµών. Στην παρούσα µελέτη θα περιγράψουµε ενδεικτικά χαρακτηριστικές
ερευνητικές προσεγγίσεις, καθώς ο όγκος των δεδοµένων είναι απαγορευτικός για
µία προς µία παρουσίαση των τεχνικών. [α]
Εφαρµογή της τεχνικής του
Morris Water Maze
Η κεντρική χορήγηση γαλανίνης εµποδίζει τη δηµιουργία χωρικής µνήµης
Η Γαλανίνη είναι ένα νευροπεπτίδιο που αναστέλλει την
απελευθέρωση διαφόρων νευροµεταβιβαστών, όπως της σεροτονίνης, του γλουταµικού
οξέος, της νοραδρεναλίνης και της ακετυλοχολίνης. Αναστέλλει επίσης την
ενεργοποίηση των ενδοκυττάριων δεύτερων αγγελιοφόρων, όπως τη δράση της
αδενυλικής κυκλάσης και την υδρόλυση της φωσφατιδυλινοσιτόλη (PIP2) και παράγει
µνηµονικά ελλείµµατα. Για τους λόγους αυτούς η γαλανίνη χρησιµοποείται για τη
διερεύνηση της συµµετοχής των νευροµεtαβιβαστών αυτών καθώς και της εµπλοκής
του cAMP στη διαδικασία της µνήµης. Με τα παρακάτω πειράµατα ερευνάται ποια
ακριβώς φάση της µνήµης αναστέλλει η γαλανίνη στο Morris Water maze καθώς και
ποιοι µηχανισµοί εµπλέκονται.
Στην πρώτη σειρά πειραµάτων αξιολογείται η δράση της γαλανίνης
στις διαδικασίες του encoding, consolidation και storage/retrieval. Η γαλανίνη
χορηγήθηκε σε Sprague-Dawley rats σε διαφορετικές χρονικές στιγµές πριν και
µετά τη δοκιµασία στη Morris Water maze σε κάθε µέρα της δοκιµασίας. Οι
χρονικές στιγµές επιλέχθηκαν µε βάση προηγούµενα πειραµατικά δεδοµένα. Για τον
έλεγχο του encoding τα χρονικές στιγµές χορήγησης της γαλανίνης ήταν 5 λεπτά
πριν τη δοκιµασία και 1 λεπτό µετά. Για τον έλεγχο του consolidation οι
χρονικές στιγµές ήταν 30 λεπτά και 3 ώρες µετά τη δοκιµασία. Η χρονική στιγµή
που επιλέχθηκε ως ευαίσθητη για το storage/retrieval ήταν 18 ώρες µετά τη
δοκιµασία. Ο χρόνος ηµίσειας ζωής της γαλανίνης in vivo είναι περίπου 100
λεπτά, αρκετά µεγάλος για την ολοκλήρωση της δοκιµασίας Morris Water maze και
αρκετά µικρός για να αποφευχθούν επιπλοκές από τη δράση του φαρµάκου µεταξύ των
χρονικών στιγµών και της µέρας της δοκιµασίας. [α]
Στη δεύτερη σειρά πειραµάτων ελέγχεται ένας πιθανός µηχανισµός
µε τον οποίο η γαλανίνη επηρεάζει το consolidation. Είναι γνωστό ότι η γαλανίνη
αναστέλλει τη δράση της αδενυλικής κυκλάσης στον εγκέφαλο των επίµυων. Εάν η
γαλανίνη επηρεάζει το consolidation µέσω της µείωσης της δράσης της αδενυλικής
κυκλάσης, τότε ένας µη-εκλεκτικός ενεργοποιητής της αδενυλικής κυκλάσης, όπως η
forskolin θα πρέπει να αυξάνει τα επίπεδα του cAMP και µάλιστα σε τέτοιο
επίπεδο που να ανταγωνίζεται τη δράση της γαλανίνης στη δοκιµασία του Morris
Water maze. Ένα ανενεργές ανάλογο της forskolin, η di-deoxyforskolin
χρησιµοποιήθηκε ως αρνητικό control.
Ζώα Χρησιµοποιήθηκαν 183 Sprague-Dawley αρσενικοί επίµυες, µε
βάρος 250-350 gr κατά τη στιγµή του πειράµατος, σε κατάλληλες συνθήκες
διαβίωσης (θερµοκρασία: 22±1ο C, 12:12 κύκλο ηµέρας/νύχτας, ελεύθερη
πρόσβαση σε τροφή-νερό).
Τοποθέτηση κάνουλας
Όλα τα ζώα αναισθητοποιήθηκαν µε ξυλαζίνη (10 mg/kg)-κεταµίνη
(100 mg/kg) και µια κάνουλα από ατσάλι µήκους
∆οκιµασία Morris Water Η δοκιµασία του Morris Water
πραγµατοποιήθηκε σε µια κυκλική δεξαµενή µε διάµετρο

Εικόνα 7 [α]
Χορήγηση φαρµάκων Η γαλανίνη διαλύθηκε σε φυσιολογικό ορό σε
συγκέντρωση 3 nmol/3µl. Η forskolin και το ανενεργές ανάλογό της διαλύθηκαν σε
DMSO+φυσιολογικό ορό σε συγκεντρώσεις 240 µmol/3µl και 242 µmol/3µl αντιστοίχως.
Στα vehicle χρησιµοποιήθηκε ο ίδιος φυσιολογικός ορός. Τα φάρµακα χορηγήθηκαν
µε µικροενέσεις στα ζώα µε τη χρήση ειδικής διάταξης που προσαρµόστηκε στην
κάνουλα που είχε προηγουµένως τοποθετηθεί. Η έγχυση των 3 µl του φαρµάκου έγινε
σε 1.5 λεπτά, µε µεσοδιάστηµα 10 δευτερολέπτων µεταξύ κάθε 1 µl, και
επιπρόσθετη καθυστέρηση 1 λεπτού πριν την αφαίρεση της συσκευής χορήγησης.
1ο Πείραµα Η γαλανίνη
ή ο ορός χορηγήθηκαν πριν ή µετά από τις δοκιµασίες εκπαίδευσης κάθε µέρα σε
ένα από τα πέντε χρονικά σηµεία: Α. 5 λεπτά πριν την τοποθέτηση στην πισίνα, Β.
1 λεπτό µετά την απόσυρση από την πισίνα, Γ. 30 λεπτά µετά την απόσυρση από την
πισίνα, ∆. 3 ώρες µετά την απόσυρση από την πισίνα, Ε. 18 ώρες µετά την
απόσυρση από την πισίνα. Για κάθε χρονικό σηµείο χρησιµοποιήθηκαν 11 ζώα ως
vehicle και σε 11 ζώα χορηγήθηκε η γαλανίνη. Κάθε ζώο χρησιµοποιήθηκε µόνο για
ένα χρονικό σηµείο και για ένα είδος χορηγούµενης ουσίας (γαλανίνη ή
φυσιολογικό ορό). Στα ζώα όλων των οµάδων χορηγήθηκε γαλανίνη ή ορός για 5 διαδοχικές
ηµέρες (Πίνακας 1).
2ο Πείραµα Η forskolin
και η δι-δέοξυforskolin χορηγήθηκαν σε δύο οµάδες ζώων. Η πρώτη οµάδα
αποτελούνταν από ζώα που έλαβαν Α. µόνο ορό (vehicle), Β. µόνο forskolin, Γ.
µόνο di-deoxyforskolin 15 λεπτά πριν τοποθετηθούν στην πισίνα. Στη δεύτερη
οµάδα των ζώων χορηγήθηκαν Α. 3% DMSO vehicle (15 λεπτά πριν την τοποθέτηση
στην πισίνα)+ορό (30 λεπτά µετά την απόσυρση από την πισίνα), Β. 3% DMSO
vehicle (15 λεπτά πριν την τοποθέτηση στην πισίνα)+γαλανίνη (30 λεπτά µετά την
απόσυρση από την πισίνα), Γ. di-deoxyforskolin (15 λεπτά πριν την τοποθέτηση
στην πισίνα)+γαλανίνη (30 λεπτά µετά την απόσυρση από την πισίνα), ∆. forskolin
(15 λεπτά πριν την τοποθέτηση στην πισίνα)+γαλανίνη (30 λεπτά µετά την απόσυρση
από την πισίνα). [α]
Πίνακας 1. Οι
χρονικές στιγµές χορήγησης γαλανίνης και ορού
|
Οµάδα (11 ζώα) |
Γαλανίνη |
Φάση µνήµης |
Vehicle (φυσιολογικός ορός) |
|
Οµάδα Α |
5min πριν την τοποθέτηση στην
πισίνα |
encoding |
5min πριν την τοποθέτηση στην
πισίνα |
|
Οµάδα Β |
1min µετά την απόσυρση από
την πισίνα |
encoding |
1min µετά την απόσυρση από
την πισίνα |
|
Οµάδα Γ |
30min µετά την απόσυρση από
την πισίνα |
consolidation |
30min µετά την απόσυρση από
την πισίνα |
|
Οµάδα ∆ |
3h µετά την απόσυρση από την
πισίνα |
consolidation |
3h µετά την απόσυρση από την
πισίνα |
|
Οµάδα Ε |
18h µετά την απόσυρση από την
πισίνα |
Storage/retri eval |
18h µετά την απόσυρση από την
πισίνα |
Συµπεριφορική δοκιµασία Τα ζώα µεταφέρονται ένα κάθε φορά στο
δωµάτιο µε τη δεξαµενή, στους εσωτερικούς τοίχους του οποίου υπάρχουν µεγάλα
γεωµετρικά σχήµατα που λειτουργούν ως χωρικά σηµεία αναγνώρισης (spatial cues).
Η εκπαίδευση για την ανεύρεση της κρυµµένης πλατφόρµας περιλαµβάνει τέσσερις
δοκιµασίες / ηµέρα. Η εκπαίδευση γίνεται ως εξής: Ο επίµυς τοποθετείται στο
κέντρο ενός τυχαία επιλεγµένου τεταρτηµορίου, εκτός από αυτό που περιέχει την
πλατφόρµα, και αφήνεται να κολυµπήσει ελεύθερα έως ότου φτάσει στην κρυµµένη
πλατφόρµα και ακουµπήσει πάνω της µε τις µπροστινές πατούσες του. Εάν το ζώο
δεν εντοπίσει την πλατφόρµα µετά από 60 δευτερόλεπτα, τοποθετείται στην
πλατφόρµα από τον πειραµατιστή. Το ζώο αφήνεται στην πλατφόρµα για 15
δευτερόλεπτα για να µπορέσει να προσανατολισθεί µε βάση τα εξωγενή χωρικά
σηµεία αναγνώρισης και τη θέση της κρυµµένης πλατφόρµας. Μετά τα 15
δευτερόλεπτα, το ζώο µεταφέρεται εκτός πισίνας και τοποθετείται κάτω από µια
ζεστή πηγή. Η δοκιµασία της εκπαίδευσης επαναλαµβάνεται µε πανοµοιότυπο τρόπο
άλλες τρεις φορές την ίδια µέρα (σύνολο 4 δοκιµασίες εκπαίδευσης/ηµέρα) και µε
µεσοδιάστηµα 15 δευτερολέπτων. Το κριτήριο για τη λήξη της δοκιµασίας
εκπαίδευσης είναι όταν η οµάδα των ζώων, στα οποία χορηγείται φυσιολογικός ορός
5 λεπτά πριν τη δοκιµασία, χρειάζονται κατά µέσο όρο και στις τέσσερις
δοκιµασίες µιας ηµέρας ≤10 δευτερόλεπτα για να εντοπίσουν την κρυµµένη
πλατφόρµα. Η τοποθεσία της πλατφόρµας παραµένει η ίδια σε κάθε ζώο σε όλη τη
διάρκεια της εκπαίδευσης. Η τοποθεσία της πλατφόρµας ήταν διαφορετική για κάθε
ζώο για να αποκλειστεί το ενδεχόµενο οµαδικής απόδοσης. Η πειραµατική δοκιµασία
(probe trial) πραγµατοποιείται 3,5-4,5 ώρες µετά από την ολοκλήρωση της
δοκιµασίας εκπαίδευσης και του τελευταίου ζώου. Οι επίµυες τοποθετούνται στην
πισίνα κατά τον ίδιο τρόπο όπως και κατά την εκπαίδευση, αλλά η πλατφόρµα
διαφυγής λείπει. Η µια και µοναδική πειραµατική δοκιµασία διαρκεί 60
δευτερόλεπτα. Στη συνέχεια το ζώο επιστρέφει στο κλουβί του. ∆ύο ηµέρες µετά
την πειραµατική διαδικασία, µια εµφανής πλατφόρµα τοποθετείται στην πισίνα αντί
της κρυµµένης. Για τις επόµενες δύο ηµέρες διεξάγονται κάθε µέρα τέσσερις
δοκιµασίες µε τον ίδιο τρόπο όπως και πριν, µε τη διαφορά ότι η πλατφόρµα είναι
εµφανής και η θέση της αλλάζει σε κάθε δοκιµασία. Τα δεδοµένα που αξιολογούνται
σε κάθε δοκιµασία εκπαίδευσης (training trial) είναι: 1) το χρονικό διάστηµα
που µεσολαβεί µέχρι να βρούνε τα ζώα την πλατφόρµα, 2) η ταχύτητα µε την οποία
κολυµπούν και 3) ο προσανατολισµός τους. Στην probe δοκιµασία αξιολογούνται
ακόµη 1) ο χρόνος που τα ζώα πέρασαν σε κάθε τεταρτηµόριο της δεξαµενής, 2)
πόσες φορές η πορεία των ζώων διασταυρώθηκε µε την προηγούµενη θέση της
πλατφόρµας.
Στατιστική ανάλυση Τα δεδοµένα που προέκυψαν από τις δοκιµασίες
εκπαίδευσης µε την κρυµµένη αλλά και την εµφανή πισίνα αναλύονται µε RMANOVA.
Τα δεδοµένα από την πειραµατική δοκιµασία αναλύονται µε ANOVA.
Ιστολογική Ανάλυση Για κάθε ζώο έγινε ιστολογική επιβεβαίωση της
σωστής τοποθέτησης της κάνουλας. Σε 70% περίπου των ζώων, µικροενέθηκε fast
green dye (3 ll σε 1.5 λεπτά) αµέσως πριν από την ευθανασία του ζώου µε CO2. Οι εγκέφαλοι αυτοί εξετάσθηκαν για την
εξάπλωση της χρωστικής στις κοιλίες. Για τα υπόλοιπα ζώα, οι εγκέφαλοί τους
αφαιρέθηκαν αµέσως µετά την ευθανασία και αποθηκεύτηκαν σε 8% διάλυµα
formaldehyde. Από τους πρόσθιους εγκεφάλους που αποθηκεύτηκαν στην formaldehyde
έγιναν τοµές πάχους 60 lm και χρησιµοποιήθηκε 0.1% thionen. Οι τοµές
µελετήθηκαν σε στερεοσκοπικό µικροσκόπιο για την επιβεβαίωση της θέσης της
κάνουλας και των µικροενέσεων. Στις περιπτώσεις που δεν επιβεβαιώθηκε η σωστή
θέση της κάνουλας, τα δεδοµένα των δοκιµασιών δεν συµπεριλήφθηκαν στην ανάλυση.
Ανάλυση αποτελεσµάτων πειράµατος-διεξαγωγή συµπερασµάτων Πείραµα
1 Σε όλες τις οµάδες των ζώων παρατηρήθηκε µια σταδιακή µείωση του χρόνου
ανεύρεσης της κρυµµένης πλατφόρµας µετά από διαδοχικές δοκιµασίες εκπαίδευσης.
Ακόµη, δεν παρατηρήθηκαν διαφορές στην ταχύτητα κολύµβησης ή
στον προσανατολισµό στις οµάδες που χορηγήθηκε vehicle ή γαλανίνη.
Παρατηρούµεόµως ότι τα ζώα στα οποία χορηγήθηκε γαλανίνη 30 λεπτά µετά τη
δοκιµασία εκπαίδευσης παρουσιάζουν διαφορά στο χρόνο εντόπισης της κρυµµένης
πλατφόρµας σε σύγκριση µε τα vehicle, κάτι που δεν παρατηρήθηκε σε άλλες
χρονικά σηµεία. Το χρονικό σηµείο των 30 λεπτών αντιστοιχεί στη φάση του
consolidation (Γράφηµα 1). Κατά τη probe trial δεν παρατηρήθηκε σηµαντική
διαφορά στην ταχύτητα κολύµβησης και στον προσανατολισµό σε όλες τις οµάδες
ζώων. Αντιθέτως, οι παράµετροι που αξιολογούνται κατά τη δοκιµασία αυτή
παρουσίασαν διαφορές στις οµάδες των ζώων που χορηγήθηκε γαλανίνη σε όλα τα
χρονικά σηµεία εκτός από τις 18 ώρες µετά τη δοκιµασία εκπαίδευσης (Γράφηµα 2).
[α]

Γράφηµα 1 Χρόνος
ανεύρεσης κρυµµένης πλατφόρµας στις διάφορες χρονικές στιγµές χορήγησης
γαλανίνης και ορού κατά τη δοκιµασία εκπαίδευσης. Παρατηρούµε ότι τα ζώα που
έλαβαν τη γαλανίνη 30 min µετά τη δοκιµασία παρουσίασαν αύξηση του χρόνου σε
σύγκριση µε τα vehicle. Η χρονική στιγµή των 30 min αντιστοιχεί στη φάση του
consolidation.

Γράφηµα 2 Γραφική
παράσταση δεδοµένων που προέκυψαν κατά την probe trial. Οι παράµετροι που
αξιολογούνται είναι ο χρόνος που πέρασε κάθε ζώο σε κάθε τεταρτηµόριο (Α-Ε) και
πόσες φορές η πορεία των ζώων διασταυρώθηκε µε την προηγούµενη θέση της
πλατφόρµας (F-J). Παρατηρούµε ότι εκτός από τη χορήγηση στις 18 ώρες, σε όλα τα
άλλα χρονικά σηµεία τα ζώα που έλαβαν γαλανίνη δαπάνησαν τον ίδιο χρόνο σε όλα
τα τεταρτηµόρια και πέρασαν ισάριθµες φορές από το τεταρτηµόριο-στόχο.
Πείραµα 2 Στην
παρούσα µελέτη, η forskolin (ένας µη εκλεκτικός ενεργοποιητής της αδενυλικής
κυκλάσης) εµποδίζει την εµφάνιση των ελλειµµάτων που προκαλεί η γαλανίνη στη
δοκιµασία εκπαίδευσης και στη probe trial (Γράφηµα 3).

Γράφηµα 3 Ανατροπή
της δράσης της γαλανίνης από τη forskolin. Κατά την probe trial παρατηρείται
στατιστικά σηµαντική διαφορά και στις δύο παραµέτρους στις οµάδες των ζώων που
έλαβαν forskolin, di deoxyforskolin και στα vehicle. Στις οµάδες που έλαβαν
γαλανίνη ή συνδυασµό γαλανίνης µε di deoxyforskolin δεν παρατηρείται στατιστικά
σηµαντική διαφορά στους χρόνους. Το φαινόµενο αυτό όµως δεν παρατηρείται όταν η
γαλανίνη χορηγείται σε συνδυασµό µε τη orskolin, που είναι ένας εκλεκτικός
ενεργοποιητής της αδενυλικής κυκλάσης.
Τα δεδοµένα αυτά υποστηρίζουν ότι η forskolin επαρκεί για να
διατηρήσει την διαδικασία του consolidation την οποία αναστέλλει η γαλανίνη. Η
di-deoxyforskolin (ένα ανάλογο της forskolin που δεν ενεργοποιεί την αδενυλική
κυκλάση) δεν επηρεάζει το έλλειµµα απόδοσης που προκαλεί η γαλανίνη, παρέχοντας
ένα αρνητικό µάρτυρα στη δοκιµασία. Εποµένως θα µπορούσαµε να συµπεράνουµε ότι
η γαλανίνη προκαλεί µνηµονικά ελλείµµατα µέσω της αναστολής του συστήµατος της
αδενυλικής κυκλάσης, µια δράση που αναστρέφεται από έναν ενεργοποιητή του
συστήµατος αυτού. [α]
Οι υποδοχείς του γλουταµικού ευθύνονται για το encoding και το retrieval
στην συνδυαστική-συσχετιστική µάθηση (paired-associate learning)
Πρόσφατα στο περιοδικό Nature οι M. Day, R. Langston και R.G.M.
Morris δηµοσίευσαν τα αποτελέσµατα µιας νέας πειραµατικής συµπεριφορικής
τεχνικής που ελέγχει τη συνδυαστική-συσχετιστική µάθηση. Παρουσιάζεται ένα νέο
παράδειγµα στο οποίο οι επίµυες κωδικοποιούν σε µια µόνο δοκιµασία, η οποία
επαναλαµβάνεται κάθε µέρα, δύο «συνδυασµένες συσχετίσεις» και επιδεικνύουν πέρα
από την τύχη, ανάκληση του ενός εκ των δύο στοιχείων του συνδυασµού (µια χωρική
θέση) εάν τους δοθεί ως ένδείξη το άλλο στοιχείο (µια συγκεκριµένη τροφή). Σε
µια πρώτη µελέτη, ο συνδυασµός µιας τροφής και της θέσης της δεν επαναλήφθηκε
ποτέ, διασφαλίζοντας µε αυτόν τον τρόπο µια µοναδική «τι-που» συµπεριφορά σε
ένα απλό χωρικό περιβάλλον. Η συνδυαστική-συσχετιστική µάθηση (paired-associate
learning) χρησιµοποιείται συχνά για τον έλεγχο της episodic memory στον
άνθρωπο. Το µπλοκάρισµα των NMDA υποδοχέων στον ιππόκαµπο ο οποίος είναι
σηµαντικός, όπως προαναφέρθηκε, για συγκεκριµένες µορφές συναπτικής
πλαστικότητας-επηρέασε το encoding αλλά δεν είχε καµιά επίδραση στο recall.
Απενεργοποίηση της νευρικής δραστηριότητας του ιππόκαµπου µπλοκάροντας τους
AMPA υποδοχείς επηρέασε τόσο το encoding όσο και το recall.
Ζώα Χρησιµοποιήθηκαν
αρσενικοί Lister hooded επίµυες, ηλικίας 3 µηνών.
Πειραµατική διάταξη Χρησιµοποιήθηκε µια αρένα φτιαγµένη από
Perspex (διαστάσεις
Πειραµατική διαδικασία Η όλη διαδικασία καταγράφηκε από κάµερες.
Συνολικά εκπαιδεύτηκαν 16 ζώα, τα οποία χωρίστηκαν σε δύο οµάδες των οκτώ και
σε υποοµάδες των τεσσάρων.
Η διαδικασία εξοικείωσης (habituation), διάρκεσε πέντε ηµέρες.
Την πρώτη ηµέρα
µόνο η θέση 4,4 ήταν ανοικτή και δεν περιείχε τροφή. Τη δεύτερη µέρα τοποθετήθηκε
µια pellet τροφής, 1 gr., χωρίς γεύση, στο κέντρο της αρένας. Η επιλογή ενός
από τα κεντρικά δοχεία έγινε για να αντισταθµιστεί η έµφυτη ροπή των επίµυων να
κινούνται στην περιφέρεια της αρένας. Σταδιακά η τροφή θαβόταν όλο
και πιο βαθιά στην άµµο του δοχείου, έτσι ώστε να µάθουν τα ζώα
να σκάβουν για την ανεύρεση της τροφής. Παρατηρήθηκε ακόµη ότι τα ζώα
προτιµούσαν στην πλειοψηφία τους να µεταφέρουν και να καταναλώνουν την τροφή
είτε κοντά στα σηµεία εισόδου είτε µέσα στο start box.
Η διαδικασία εκπαίδευσης (training) επαναλαµβανόταν για πέντε
συνεχείς ηµέρες και περιλάµβανε δύο sample trials και µια choice trial. Στην
πρώτη sample trial ο επίµυς µπαίνει στην αρένα από ένα από τα start boxes και
ξεκινά να ψάχνει για το ένα και µοναδικό ανοικτό δοχείο σε µια συγκεκριµένη
θέση, L1, στο οποίο µπορεί να σκάψει και να βρει µια pellet τροφής 1 gr. µιας
συγκεκριµένης γεύσης, F1, (Εικόνα 8a). ∆ύο λεπτά αργότερα ο επίµυς επαναλαµβάνει
την ίδια δοκιµασία (δεύτερη sample trial), αλλά µε διαφορετική γεύση, F2 και σε
διαφορετική θέση αυτή τη φορά, L2, (Εικόνα 8b). Τις δύο sample trials ακολουθεί
µια choice trial. Η τελευταία είναι µια «ανταµειβόµενη» επιλογή (rewarded
choice). Στον επίµυ, πριν την είσοδό του στην αρένα, δίνεται µια «ένδειξη
επανάκλησης» (recall cue) που είναι µια pellet τροφής 500 mgr. που έχει µια από
τις δύο προηγούµενες γεύσεις, σε ένα διαφορετικό start box αυτή τη φορά. Το ζώο
έχει 30 δευτερόλεπτα για να φάει την τροφή και στη συνέχεια η πόρτα του start
box ανοίγει και το ζώο βγαίνει στην αρένα. Κατά την choice trial στην αρένα
υπάρχουν τώρα δύο ανοικτά δοχεία, L1 και L2. Εάν ο επίµυς έχει λάβει ως ένδειξη
την F1, το ζώο ανταµείβεται µε 1 gr. pellet της γεύσης F1, πηγαίνοντας και
σκάβοντας στη θέση L1. Εάν ο επίµυς έχει λάβει ως ένδειξη την F2, το ζώο
ανταµείβεται µε 1 gr. pellet της γεύσης F2, πηγαίνοντας και σκάβοντας στη θέση
L2 (Εικόνα 8c). Την επόµενη µέρα επαναλαµβάνεται η ίδια διαδικασία (2 sample
trials, 1 choice trial) αλλά επιλέγεται νέο ζευγάρι γεύσεων και θέσεων. Η
εκπαίδευση των ζώων διήρκεσε 8 εβδοµάδες.
Κατά τη διάρκεια των sample trials, οι επίµυες είχαν τα κεφάλια
τους κοντά στο πάτωµα της αρένας, κάνοντας µικρές πλάγιες κινήσεις, ψάχνοντας το
µοναδικό δοχείο που ήταν ανοικτό. Στη choice trial, τα ζώα κατευθύνονται σχεδόν
κατευθείαν σε ένα από τα δύο δοχεία L1 ή L2 , χωρίς να επιδεικνύουν αυτές τις
κινήσεις του κεφαλιού, γεγονός που αποδεικνύει ανάκληση της θέσης της τροφής.

Εικόνα 8 [α]
Μετά από 6 µόνο ηµέρες εκπαίδευσης, η επιλογή ήταν σωστή κατά
70,0±7,6% (µέσο όρο) σε σύγκριση µε αυτό που παρατηρείται σε αυθόρµητη επιλογή
(Γράφηµα 4) (οµάδα επίµυων που εκπαιδεύτηκαν µε τη µονή-συνδυαστική διαδικασία).

Γράφηµα 4 Γρήγορη
µάθηση κατά τις πρώτες 6 ηµέρες της εκπαίδευσης. Οι επίµυες (n=8) είχαν
καλύτερη απόδοση από αυτή που αναµενόταν σαν τυχαίο γεγονός. Το ποσοστό αυτό
ήταν µικρότερο στην οµάδα των ζώων που εκπαιδεύτηκαν µε τη διπλή συνδυαστική
διαδικασία [α]
(57.5 ± 8.8%). Μετά τις πρώτες 5 ηµέρες του training και τα 16
ζώα συνέχισαν την εκπαίδευσή τους µε µονήσυνδυαστική διαδικασία (Γράφηµα 5).
Γράφηµα 5 Σχηµατική παράσταση της εκπαίδευσης κατά τις πρώτες 15
ηµέρες. Η διπλήσυνδυαστική διαδικασία εγκαταλείφθηκε µετά την πρώτη εβδοµάδα.
Τα 12 ζώα που εµφάνισαν την καλύτερη απόδοση κατά τη διάρκεια του habituation
και του training επιλέχθηκαν µετά τη 15 ηµέρα του training (6 ζώα από κάθε
οµάδα). [α]

Μονή-,διπλή-συνδυαστική
διαδικασία [α]
Αν και ήταν πολύ πιθανό ότι η νέα συνδυαστική-συσχετιστική
µάθηση θα κωδικοποιούνταν σε µια και µόνο διαδικασία εκπαίδευσης, οι πολλαπλές
παρουσιάσεις που συνήθως χρησιµοποιούνται σε µελέτες της µνήµης έκανε αναγκαίο
τον πειραµατισµό µεταξύ µιας µονής-συνδυαστικής διαδικασίας και µιας
διπλής-συνδυαστικής διαδικασίας. Στη µονή-συνδυαστική διαδικασία κάθε sample
trial γίνεται µόνο µια φορά, δηλαδή υπάρχουν 2 sample trials κάθε µέρα, µια για
κάθε γεύση, και ακολουθεί η choice trial. Στη διπλή-συνδυαστική διαδικασία,
κάθε sample-trial επαναλαµβάνεται δύο φορές, µε την ελπίδα να αυξηθεί η
πιθανότητα συνδυασµού µιας συγκεκριµένης γεύσης µε µια συγκεκριµένη θέση.
Έχουµε λοιπόν τώρα 5 δοκιµασίες κάθε µέρα-2 sample trials για κάθε συνδυασµό
γεύσης-θέσης και µετά ακολουθεί η choice trial (Γράφηµα 5). Στην πράξη βρέθηκε
ότι στη διπλή-συνδυαστική διαδικασία τα ζώα είχαν πιο άσχηµη απόδοση. Η απόδοση
της υποοµάδας των 8 επίµυων που εκπαιδεύτηκαν αρχικά για πέντε µέρες µε
διπλή-συνδυαστική διαδικασία ήταν πιο φτωχή από την υποοµάδα της
µονής-συνδυαστικής διαδικασίας. Ανάλυση των δεδοµένων απέδειξε ότι η
διπλή-συνδυαστική διαδικασία οδήγησε τα ζώα στο να σχηµατίσουν µια προτίµηση
ανάµεσα στις δύο γεύσεις. Καθώς η τροφή υπήρχε δύο φορές στην κάθε θέση πριν τη
choice test, οι επίµυες ίσως αγνοούσαν τη γεύση της τροφής-ένδειξης στο start
box και αντιθέτως επέλεγαν να πάνε στη θέση της τροφής που τους άρεσε καλύτερα.
[α]

Γράφηµα 6 ∆ύο ζώα θα
λάµβαναν το ∆είγµα F1, µετά το ∆είγµα F2 και µια choice trial στην οποία η
ένδειξη θα ήταν είτε το F1 είτε το F2. ∆ύο άλλα ζώα θα λάµβαναν το ∆είγµα F2,
µετά το ∆είγµα F1 και µια choice trial στην οποία η ένδειξη θα ήταν είτε το F2
είτε το F1. (Αρχικά κατά τις πρώτες 5 ηµέρες και τη µονή και για τη
διπλή-συνδυαστική διαδικασία). Αυτό αποτελεί ένα µοντέλο 2 x 2. [α]
Τα 12 ζώα που εµφάνισαν την καλύτερη απόδοση κατά τη διάρκεια
του habituation και του training επιλέχθηκαν µετά τη 15 ηµέρα του training (6
ζώα από κάθε αρχική οµάδα µονής και διπλής-συνδυαστικής διαδικασίας,) και
χρησιµοποιήθηκαν σε περαιτέρω στάδια του πειράµατος.
Για να ελεγχθεί ότι η ανάκληση της µνήµης στην choice trial δεν
ήταν το αποτέλεσµα της µυρωδιάς της τροφής, σχεδιάστηκαν δύο µη-ανταµειβόµενες
δοκιµασίες (nonrewarded probe test) που διήρκεσαν 10 ηµέρες. Στις δοκιµασίες
αυτές δεν υπήρχε τροφή ως ανταµοιβή σε καµία από τις δύο θέσεις στην choice
trial. Τα 12 ζώα που επιλέγηκαν εκπαιδεύτηκαν περαιτέρω µε τη µονή-συνδυαστική
διαδικασία για ακόµη 10 ηµέρες. Στο πρώτο probe test εξετάσθηκε τι θα συµβεί
εάν κατά την choice trial είναι ανοικτό και ένα τρίτο δοχείο (θέση L3 3,5) το
οποίο δεν ήταν ανοικτό κατά τις δύο προηγούµενες sample trials της
συγκεκριµένης µέρας. Τα ζώα αφέθηκαν να σκάβουν συνολικά για 60 δευτερόλεπτα
και υπολογίστηκε το ποσοστό του χρόνου που πέρασαν σε κάθε δοχείο. Παρατηρήθηκε
ότι τα ζώα δαπάνησαν περισσότερο χρόνο στη θέση που αντιστοιχούσε στη
γεύση-ένδειξη (Γράφηµα 7a). Στο δεύτερο probe test οι επίµυες «παραπλανήθηκαν»
µε το να τους δοθεί µια νέα, τρίτη γεύση (F3) σαν ένδειξη-ανάκλησης στην αρχή
της choice trial. Τα ζώα στην περίπτωση αυτή έδειξαν την ίδια προτίµηση για τις
δύο προηγούµενες θέσεις, L1 και L2, η οποία όµως ήταν πολύ µεγαλύτερη από αυτή
της καινούριας θέσης, L3 (Γράφηµα 7b). Συµπεραίνουµε λοιπόν ότι οι επίµυες
µπορούν να κωδικοποιήσουν µια συσχέτιση µεταξύ γεύσης-θέσης µε µια µόνο δοκιµασία
και να επιδείξουν αργότερα ανάκληση της συσχέτισης αυτής µε αφορµή µια ένδειξη.

Γράφηµα 7
Μη-ανταµειβόµενες δοκιµασίες (non-rewarded probe test). a. [α]
Το ποσοστό του χρόνου που δαπανήθηκε για σκάψιµο κατά την choice
trial στην σωστή θέση (είχε δοθεί η ένδειξη) διέφερε σηµαντικά από αυτό που
δαπανήθηκε για σκάψιµο στη λανθασµένη και στη νέα θέση, στις οποίες όµως ήταν
σχεδόν το ίδιο. b. Στις choice trials στις οποίες χρησιµοποιήθηκε µια νέα γεύση
ως ένδειξη το ποσοστό του χρόνου που δαπανήθηκε για σκάψιµο στις δύο γνωστές
θέσεις δεν διέφερε, αλλά ήταν σηµαντικά υψηλότερο από αυτό στην νέα θέση.
Χορήγηση φαρµάκων Το πείραµα αυτό σχεδιάστηκε σαφέστατα για να
ερευνηθεί εάν η ενεργοποίηση των υποδοχέων του γλουταµικού οξέως στον ιππόκαµπο
διαµεσολαβεί στις διαδικασίες του encoding (κωδικοποίησης) και του retrieval
(ανάκλησης). Για το λόγο αυτό εξετάσθηκαν στη συνέχεια οι εκλεκτικοί
ανταγωνιστές 6-cyano-7- nitroquinoxaline (CNQX, ένας ανταγωνιστής των υποδοχέων
AMPA) και D(2)-2-amino-5phosphonopentanoic acid (D-AP5, ένας ανταγωνιστής των
υποδοχέων NMDA -Nmethyl-D-aspartate-). Η φάση της χορήγησης των φαρµάκων
ξεκίνησε περίπου 3 µήνες µετά από την έναρξη της εκπαίδευσης. Έγινε έγχυση των
ουσιών αυτών ή τεχνητού εγκεφαλονωτιαίου υγρού ως µάρτυρας (aCSF) µέσα στο
ραχιαίο ιππόκαµπο 15 λεπτά πριν τις sample trials ή 15 λεπτά πριν την choice
trials (sample και choice γίνονται µε διαφορά 20 λεπτών). Σύµφωνα µε το
πρωτόκολλο, κάθε ένας από τους 12 επίµυες εκπαιδεύτηκε για διάστηµα 17 ηµερών
εκ των οποίων οι 11 ηµέρες ήταν οι κανονικές µέρες εκπαίδευσης κατά τις οποίες
γίνονταν η έγχυση των φαρµάκων ή του aCSF σύµφωνα µε έξι συνθήκες (Γράφηµα 8). [α]

Γράφηµα 8 Ενδεικτική
σειρά χορήγησης των φαρµάκων σε έναν επίµυ κατά τις 17 ηµέρες του πειράµατος.
Τα D-AP5, CNQX και aCSF σηµαίνουν αµφίπλευρη έγχυση in, τα R και N δείχνουν
αντιστοίχως εάν η choice trial ήταν ανταµειβόµενη ή µη-ανταµειβόµενη, τα PreS
και PreCh δείχνουν εάν η έγχυση ήταν πριν τη sample trial ή πριν τη choice
trial. Το NoI σηµαίνει ότι δεν έγινε έγχυση. [α]

Γράφηµα 9 Έγχυση των
φαρµάκων. a. Η έγχυση των φαρµάκων πριν από τις sample trials έδειξε ότι τις
ηµέρες που έγινε έγχυση του aCSF η απόδοση των ζώων ήταν καλύτερη από ότι εάν
ήταν τυχαία, ενώ η έγχυση των D-AP5 και CNQX προκάλεσε την ίδια απόδοση που
ήταν στα επίπεδα του τυχαίου. b. Η έγχυση των φαρµάκων πριν από τις choice
trials έδειξε ότι δεν υπάρχει διαφορά στην απόδοση των ζώων µε την έγχυση του
aCSF και του D-AP5 και ότι αυτή είναι καλύτερη από τα επίπεδα του τυχαίου αν
συγκριθούν µε την απόδοση κατά τις ηµέρες του CNQX. [α]
Αποτελέσµατα Οι επίµυες στους οποίους έγινε έγχυση aCSF είχαν
καλύτερη απόδοση στην choice trial σε σύγκριση µε τυχαία επιλογή, ανεξάρτητα
από την χρονική στιγµή της έγχυσης (Γράφηµα 9a, 9b). Έγχυση του D-AP5 επηρέασε
την ακρίβεια της επιλογής όταν η έγχυση έγινε πριν από τις sample trials, αλλά
όχι όταν έγινε µετά τις sample trials και πριν τις choice trials. Έγχυση του
CNQX επηρέασε την ακρίβεια της επιλογής ανεξάρτητα από το εάν η έγχυση έγινε
πριν ή µετά από τη sample trial. Αυτός ο διαχωρισµός ήταν ένα προκαθορισµένο
συµπέρασµα, αλλά έχει σηµασία αν λάβουµε υπόψιν µας το ρόλο των NMDA υποδοχέων
στην επαγωγή της δρασεοεξαρτώµενης συναπτικής πλαστικότητας στον ιππόκαµπο
(Γράφηµα 10b) και της γρήγορης συναπτικής µεταβίβασης, που πραγµατοποιείται από
τους AMPA υποδοχείς, στην έκφραση αλλαγών στη συναπτική δύναµη(Γράφηµα 10a).

Γράφηµα 10
∆ιαφορετικοί υποδοχείς γλουταµικού οξέος εµπλέκονται στο encoding και στο
retrieval. [α]
a. Η µέγιστη νευρική απενεργοποίηση του ιππόκαµπου εµφανίζεται
10-15 λεπτά µετά την έγχυση του CNQX και διαρκεί περίπου 60 λεπτά. b. Η έγχυση
του D-AP5 δεν επηρεάζει την γρήγορη συναπτική µεταβίβαση, αλλά µπλοκάρει την
επαγωγή του LTP 15 λεπτά µετά την έγχυση.
Συµπεράσµατα Από το παραπάνω πείραµα προκύπτει ότι ένα επίµυς
µπορεί να κωδικοποιήσει µια νέα συσχέτιση µεταξύ µιας γεύσης µιας τροφής («τί»)
και µιας θέσης στο χώρο («πού») και να ανακαλέσει επιλεκτικά την σωστή θέση
όταν του δοθεί ως ένδειξη η γεύση που αντιστοιχεί σε αυτή τη θέση. Τα νευροβιολογικά
ευρήµατα αυτής της µελέτης δείχνουν ότι το µπλοκάρισµα των NMDA υποδοχέων κατά
τις sample trials επηρεάζουν την κωδικοποίηση της µνήµης αλλά δεν έχουν καµιά
επίδραση στην ανάκληση. Το µπλοκάρισµα των AMPA υποδοχέων µπλοκάρει τη γρήγορη
συναπτική µεταβίβαση στον ιππόκαµπο επηρεάζοντας τόσο την κωδικοποίηση της
µνήµης όσο και την ανάκλησή της. [α]
Αποτελέσµατα
Περιγραφή των µοριακών µηχανισµών της implicit memory
Μεγάλο τµήµα της γνώσης µας για τους µηχανισµούς της µνήµης το
οφείλουµε σε ένα θαλάσσιο οργανισµό, την Aplysia. Στη συνέχεια θα παρουσιάσουµε
τα δεδοµένα που προέκυψαν για τους µηχανισµούς της implicit memory
χρησιµοποιώντας ως πρότυπο την Aplysia. Το γιγάντιο θαλάσσιο καλαµάρι, Aplysia,
αποτελεί έναν οργανισµό εξαιρετικά χρήσιµο στη µελέτη του ΚΝΣ καθώς το νευρικό
του σύστηµα αποτελείται από µικρό αριθµό νευρικών κυττάρων, περίπου 20.000 και
τα περισσότερα από αυτά είναι γιγάντια. Η Aplysia παρουσιάζει µια ποικιλία
αµυντικών αντανακλαστικών απόσυρσης του σιφονίου και του βράγχιού της. Τα
αντανακλαστικά αυτά µπορούν να υποστούν τόσο habituation όσο και sensitization
αλλά και classical conditioning όπως θα δούµε παρακάτω. Το νευρικό κύκλωµα του
αντανακλαστικού απόσυρσης του βραγχίου (gillwithdrawal reflex) εντοπίζεται στο
κοιλιακό γάγγλιο και αποτελείται από 24 κεντρικούς αισθητικούς νευρώνες (που
περιέχουν µηχανοϋποδοχείς) οι οποίοι νευρώνουν το δέρµα του σιφονίου και
σχηµατίζουν απευθείας µονοσυναπτικές συνδέσεις µε 6 κινητικά κύτταρα του
βραγχίου (Εικ. 9). Οι αισθητικοί νευρώνες επίσης, σχηµατίζουν έµµεσες συνδέσεις
µε κινητικά κύτταρα µέσω µικρών οµάδων διεγερτικών και κατασταλτικών ενδιάµεσων
νευρώνων. [ζ]

Εικόνα 9 Σχηµατική
παρουσίαση των αισθητικών, κινητικών και ενδιάµεσων νευρώνων που εµπλέκονται
στο αντανακλαστικό απόσυρσης στην Aplysia [ζ]
Sensitization (Short-term και Long-term sensitization) Ένα
επώδυνο ερέθισµα στην ουρά της Aplysia προκαλεί έντονη αντίδραση απόσυρσης του
βραγχίου της και σε άλλα, πιο ήπια ερεθίσµατα. Το φαινόµενο αυτό καλείται
Sensitization και έχει µια Short-term και µια Long-term φάση. Το Sensitization
αποτελεί µια ετεροσυναπτική διαδικασία. Η αύξηση της συναπτικής δύναµης
προκαλείται από ενδιάµεσους νευρώνες. Υπάρχουν τουλάχιστον τρεις οµάδες
ενδιάµεσων νευρώνων. Από αυτούς οι πιο καλά µελετηµένοι είναι αυτοί που
απελευθερώνουν σεροτονίνη. Στην Aplysia η σεροτονίνη δρα σε τουλάχιστον έξι
διαφορετικούς υποτύπους υποδοχέων, χωρίς να γνωρίζουµε ακόµα επακριβώς ποιοι
υπότυποι εµπλέκονται στη µνήµη και τη µάθηση. Οι σεροτονεργικοί και οι
υπόλοιποι ενδιάµεσοι νευρώνες σχηµατίζουν συνάψεις µε τους αισθητικούς
νευρώνες, συµπεριλαµβανοµένων και αξονο-αξονικές συνάψεις στα προσυναπτικά τους
άκρα (Εικ. 9, 10). Οι ασθητικοί νευρώνες µε τη σειρά τους σχηµατίζουν συνάψεις
µε τα κινητικά κύτταρα (Εικ. 9, 10). Μετά από ένα επώδυνο ερέθισµα στην ουρά,
απελευθερώνονται από τους ενδιάµεσους νευρώνες σεροτονίνη και άλλοι
νευροµεταβιβαστές. Η σεροτονίνη που απελευθερώνεται προσυναπτικά από τον
ενδιάµεσο νευρώνα, συνδέεται σε δύο τύπους µετασυναπτικών υποδοχέων στον
αισθητικό νευρώνα. Ο πρώτος από αυτούς τους υποδοχείς συνδέεται µε µια G
πρωτεΐνη (Gs) η οποία αυξάνει τη δράση της αδενυλικής κυκλάσης. Η αδενυλική
κυκλάση µε τη σειρά της µετατρέπει το ATP σε cAMP και αυξάνονται µε τον τρόπο
αυτό τα επίπεδα του cAMP στον αισθητικό νευρώνα. Το cAMP ενεργοποιεί την cAMP
εξαρτώµενη κινάση Α (PKA) µε το να συνδέεται στην ρυθµιστική υποµονάδα και να
απελευθερώνει την καταλυτική. Η καταλυτική υποµονάδα της PKA δρα µε τη σειρά
της σε τρεις οδούς: Στην οδό 1 η καταλυτική υποµονάδα φωσφορυλιώνει ιοντικούς
διαύλους Κ+ και έτσι αυξάνεται το ρεύµαΚ+ . Η αύξηση του Κ+ παρατείνει το
δυναµικό και αυξάνει την είσοδο Ca2+ από Ν-τύπου διαύλους Ca2+. Η
αύξηση των Ca2+ στον αισθητικό νευρώνα προκαλεί αύξηση της
απελευθέρωσης του νευροµεταβιβαστή µεταξύ αισθητικού νευρώνα και κινητικού
κυττάρου. Στην οδό 2, συναπτικά κυστίδια που περιέχουν µεταβιβαστή
κινητοποιούνται προς την ενεργό ζώνη και αυξάνεται έτσι η ικανότητα
εξωκύττωσης. Στην οδό 3 η δράση της καταλυτικής υποµονάδας της PKA προκαλεί το
άνοιγµα L τύπου διαύλων Ca2+ και αυξάνεται έτσι ακόµη περισσότερο η είσοδος
Ca2+ στον αισθητικό νευρώνα. Ο δεύτερος υποδοχέας συνδέεται µε µια G πρωτεΐνη
(Gο) η οποία ενεργοποιεί τη φωσφολιπάση C (PLC) η οποία µε τη σειρά της
ενεργοποιεί µια διαµεµβρανική διακυλογλυκερόλη µε τελική κατάληξη την
ενεργοποίηση της πρωτεϊνικής κινάσης C (PKC). Η
PKC εµπλέκεται µαζί µε την PKA στις οδούς 2 και 3 (Eικ. 10). [ζ]
Εάν το επώδυνο ερέθισµα επαναλαµβάνεται τότε η µνήµη γίνεται πιο
σταθερή και µετατρέπεται σε long term. Αναλυτικότερα, επαναλαµβανόµενο ερέθισµα
προκαλεί αύξηση των ενδοκυττάριων επιπέδων cAMP που διαρκεί αρκετά λεπτά. Οι
καταλυτικές υποµονάδες της PKA τότε κινητοποιούν την πρωτεινική κινάση που
ενεργοποιείται από το µιτογόνο (MAPK) και µαζί οι δύο κινάσες µετακινούνται
στον πυρήνα. Στον πυρήνα η PKA και η MAPK
φωσφορυλιώνουν και ενεργοποιούν την CREB πρωτεΐνη (cAMP-response
element binding protein), έναν µεταγραφικό παράγοντα, και
αναστέλλουν την κατασταλτική δράση της CREB-2, ενός αναστολέα
της CREB-1. Η CREB-1 µε τη σειρά της ενεργοποιεί διάφορα γονίδια µεταξύ των
οποίων και αυτό που κωδικοποιεί µια ubiquitin υδρολάση, απαραίτητη για την
ελεγχόµενη πρωτεόλυση της καταλυτικής υποµονάδας της PKA. Η αποκοπή της
καταλυτικής υποµονάδας της PKA οδηγεί σε συνεχή φωσφορυλίωση των υποστρωµάτων
της PKA. Ένα δεύτερο γονίδιο που ενεργοποιείται από την CREB-1 κωδικοποιεί το
C/EBP το οποίο δρα τόσο ως οµοδιµερές όσο και ως ετεροδιµερές µε ενεργοποιητικό
παράγοντα (AF) για την ενεργοποίηση και άλλων γονιδίων που οδηγούν στο σχηµατισµό
νέων συνάψεων (Εικ. 11). [ζ]

Εικόνα 10 Short-term ευαισθητοποίηση
του αντανακλαστικού απόσυρσης στην Aplysia. Από τον ενδιάµεσο προσυναπτικό
νευρώνα απελευθερώνεται σεροτονίνη η οποία συηνδέεται σε µετασυναπτικούς
υποδοχείς του σώµατος του αισθητικού νευρώνα. Στη συνέχεια ακολουθεί ένας
καταρράκτης βιοχηµικών γεγονότων που οδηγεί στην απελευθέρωση γλουταµικού στη
συναπτική σχισµή µεταξύ του αισθητικού και του κινητικού νευρώνα. Με τον τρόπο
αυτό παράγεται το αντανακλαστικό. Βλέπουµε δηλαδή πως ο ενδιάµεσος νευρώνας
διευκολύνει τη νευρωνική µεταβίβαση µεταξύ αισθητικού και κινητικού νευρώνα. [ζ]
Οι µοριακοί µηχανισµοί που εµπλέκονται στην Long-term ευαισθητοποίηση
χρησιµοποιούν τις ίδιες οδούς ενδοκυττάριων δεύτερων αγγελιοφόρων µε την
Short-term ευαισθητοποίηση, δηλαδή το cAMP και το PKA, αλλά όπως συµβαίνει µε
τη long term μνήμη, έχουµε τη σύνθεση νέων πρωτεϊνών. Στην Long-term ευαισθητοποίηση
βλέπουµε ότι οι καταλυτικές υποµονάδες συνεχίζουν να φωσφορυλιώνουν πρωτεΐνες
σηµαντικές για την αύξηση της απελευθέρωση των µεταβιβαστών και να ενισχύουν
τις συνάψεις µέσω της CREB-1, για µεγάλο χρονικό διάστηµα µετά την επιστροφή
του δεύτερου αγγελιοφόρου cAMP στα φυσιολογικά του επίπεδα και ενώ το ερέθισµα
παύει να υφίσταται. Παρατηρούµε ακόµη ότι κατά τη διαδικασία αποθήκευσης της
long term μνήμη ενεργοποιείται ένας στενά ελεγχόµενος καταρράκτης γονιδιακής
έκφρασης. Τα κατασταλτικά γονίδια της µνήµης παρέχουν ένα κατώφλι ή καλύτερα
ένα σηµείο ελέγχου της αποθήκευσης τα µνήµης. Οι καταστολείς της µνήµης ίσως
επιτρέπουν την µεταβολή της αποθηκευµένης µνήµης από συναισθηµατικά ερεθίσµατα,
όπως για παράδειγµα µια µνήµη ενός συναισθηµατικά φορτισµένου γεγονότος να
επανέρχεται τόσο ζωντανά, µε κάθε λεπτοµέρεια σαν να έχει µόλις συµβεί. [ζ]

Εικόνα 11 [ζ]
Περιγραφή των µοριακών
µηχανισµών της explicit memory
Είναι πλέον καθολικά αποδεκτό ότι ο ιππόκαµπος παίζει σηµαντικό
ρόλο στη δηµιουργία της χωρικής µνήµης στα θηλαστικά. Το LTP αποτελεί τη
µοριακή βάση αυτής της διαδικασίας. Για το λόγο αυτό οι µελέτες για τη µνήµη
έχουν επικεντρωθεί στη µελέτη του LTP. Στη συνέχεια επιχειρείται µια προσπάθεια
περιγραφής των µοριακών µηχανισµών που εµπλέκονται στο LTP.
Πώς παράγεται το LTP; Βρέθηκε ότι το γλουταµικό οξύ είναι ο
βασικός νευροµεταβιβαστής που εµπλέκεται στο LTP. Το γλουταµικό οξύ δρα σε δύο
τύπους υποδοχέων, ιοντοτροπικούς και µεταβοτροπικούς. Κύριο ρόλο µέχρι σήµερα
θεωρείται ότι διαδραµατίζουν οι ιοντοτροπικοί υποδοχείς αν και συνεχώς
προκύπτουν νέα στοιχεία για την εµπλοκή και των µεταβοτροπικών υποδοχέων στη συναπτική
πλαστικότητα και στο σχηµατισµό της µνήµης. Στο Schaffer collateral pathway και
Perforant pathway ο µηχανισµος του early LTP είναι ο ίδιος. Αναλυτικότερα,
φυσιολογικά σαν απάντηση σε ένα ερέθισµα, απελευθερώνεται γλουταµικό οξύ από
τους προσυναπτικούς νευρώνες και δρα τόσο στους non-NMDA (AMPA και
µεταβοτροπικούς) όσο και στους NMDA υποδοχείς που αποτελούν ταυτοχρόνως και
ιοντικά κανάλια. Ιόντα Na+ και K+ εισέρχονται στο κύτταρο από τους non-NMDA
υποδοχείς αλλά όχι και από τους NMDA οι οποίοι στην κατάσταση του δυναµικού
ηρεµίας της µεµβράνης, φράζονται από Mg2+ (Εικ. 12). [θ]

Εικόνα 12 [θ]
Όταν η µετασυναπτική µεµβράνη εκπολώνεται από τη δράση των μη-NMDA
υποδοχέων, όπως συµβαίνει από µια υψηλής συχνότητας σειρά ερεθισµάτων που
παράγει το LTP, η εκπόλωση έχει ως αποτέλεσµα την αποµάκρυνση των Mg2+
από τους NMDA υποδοχείς. Το γεγονός αυτό επιτρέπει την είσοδο Ca2+
µέσα από τους NMDA υποδοχείς. Η επακόλουθη αύξηση του ασβεστίου µετασυναπτικά
πυροδοτεί τις Ca2+ -εξαρτώµενες κινάσες (CaMKII και PKC) καθώς και
την τυροσινική κινάση Fyn. Μαζί, οι κινάσες αυτές παράγουν το LTP. Η CaMKII
φωσφορυλιώνει τους non-NMDA υποδοχείς και αυξάνει την ευαισθησία τους στο
γλουταµικό οξύ αλλά και ενεργοποιεί κάποιους άλλους «σιωπηλούς» ιοντοτροπικούς
υποδοχείς. Οι αλλαγές αυτές συµµετέχουν στην διατήρηση του LTP. Επιπρόσθετα,
καθόσον παράγεται το LTP, το µετασυναπτικό κύτταρο θεωρείται ότι απελευθερώνει
(µε άγνωστους προς το παρόν µηχανισµούς) ανάδροµους αγγελιοφόρους, ένας εκ των
οποίων εικάζεται ότι είναι το ΝΟ, οι οποίοι δρουν στις κινάσες του
προσυναπτικού νευρώνα για να προκαλέσουν την αύξηση της απελευθέρωσης των
µεταβιβαστών η οποία µε τη σειρά της συνεισφέρει στο LTP (Εικ. 13). Εάν
επαναλαµβάνεται το ερέθισµα που προκαλεί την εµφάνιση του LTP, τότε το ρεύµα Ca2+
επιστρατεύει την αδενυλική κινάση η οποία ενεργοποιεί µια cAMP-εξαρτώµενη
κινάση. Η τελευταία µετακινείται προς τον πυρήνα όπου φωσφορυλιώνει την CREB. Η
CREB µε τη σειρά της ενεργοποιεί στόχους που προκαλούν δοµικές αλλαγές (Εικ. 14).
[θ]

Εικόνα 13 Early LTP.
Κατά τη διάρκεια µιας σειράς ερεθισµάτων υψηλής συχνότητας που παράγουν το LTP,
η µετασυναπτική µεµβράνη εκπολώνεται από τη δράση των non-NMDA υποδοχέων. Η
εκπόλωση της µεµβράνης προκαλεί την αποµάκρυνση των Mg2+ που φράζουν
τους NMDA υποδοχείς. Έτσι Ca2+εισέρχεται και από τους NMDA. Τα
αυξηµένα επίπεδα Ca2+ ενεργοποιούν έναν καταράκτη βιοχηµικών
γεγονότων που συνεισφέρει στην διατήρηση του LTP µετασυναπτικά. Επιπρόσθετα, το
µετασυναπτικό κύτταρο παράγει ανάδροµους αγγελιοφόρους που δρούν στον προσυναπτικό
νευρώνα και ενισχύουν την απελευθέρωση του γλουταµικού. [θ]
Στο mossy fiber μονοπάτι βρέθηκε ότι το LTP εξαρτάται από την
είσοδο Ca2+ στον προσυναπτικό νευρώνα. Το ρεύµα Ca2+
φαίνεται ότι ενεργοποιεί µια Ca2+ /καλµοδουλίνη εξαρτώµενη αδενυλική
κυκλάση η οποία αυξάνει τα επίπεδα του cAMP και ενεργοποιεί την PKA στον
προσυναπτικό νευρώνα. Ακόµη, το LTP στο mossy fiber pathway µπορεί να ρυθµιστεί
από µετατρεπτικά ερεθίσµατα. Τα ερεθίσµατα αυτά είναι νοραδρενεργικά και
εµπλέκουν β-αδρενεργικούς υποδοχείς, οι οποίοι ενεργοποιούν την αδενυλική
κυκλάση. Βλέπουµε λοιπόν πως στην αποθήκευση της explicit μνήμης στον ιππόκαµπο
των θηλαστικών, η PKA παίζει έναν σηµαντικό ρόλο στην µετατροπή της short-term μνήμη
σε long-term μνήμη. [θ]

Εικόνα 14 [θ]
Πρόσφατες μνήμες χρειάζονται χρόνο να σταθεροποιηθούν. Η
διαδικασία της σταθεροποίησης μνήμης
περιλαμβάνει αλλαγές στην πρωτεϊνική σύνθεση σε διάφορες περιοχές του
εγκεφάλου. Αυτές οι πρωτεϊνες συμβάλλουν σε μόνιμες συναπτικές και/ή δομικές
τροποποιήσεις που υπόκεινται στη διατήρηση της μνήμης στην αποτύπωση της μνήμης
στο πρόσωπο ενός πάντα μεταβαλλόμενου εγκεφάλου. Εντούτοις, πλήρως παγιωμένες
μνήμες είναι μακριά από το να είναι σταθερές και ανθεκτικές στη διάσπαση. Όταν
ανακτάται και επανενεργοποιούνται, μνήμες μπορούν να αναστατωθούν για έναν
περιορισμένο χρόνο και απαιτείται επαναπαγίωση για να διατηρηθούν
μακροπρόθεσμα. Με την επαναλαμβανόμενη ανάκληση σταθερών μνημών μπορούν ακόμη
να υφίστανται διαγραφή οδηγώντας σε μια πτώση της απόκρισης της
συμπεριφοριστικής μάθησης. Όπως η σταθεροποίηση, η επαναπαγίωση και η εξάλειψη
είναι από πρωτεϊνική σύνθεση - εξαρτώμενες διαδικασίες μνήμης. Οι περιοχές του
εγκεφάλου που υποστηρίζουν την αποτύπωση της μνήμης μπορούν επίσης να
υποβληθούν σε αναδιοργάνωση με το χρόνο.[κ]

Χρησιμοποιώντας την παρεμπόδιση ειδικών σηματοδοτικών πρωτεϊνών
στον ιππόκαμπο, μια δομή σημαντική για τη μνήμη στους ανθρώπους και ζώα, οι
μοριακές διαδικασίες σταθεροποίησης και επαναπαγίωσης της long-term fear μνήμης
είναι διαφορετικές. Τα λίγα στοιχεία που υπάρχουν προτείνουν ότι οι μοριακοί
μηχανισμοί της εξάλειψης μπορούν να είναι διαφορετικοί από εκείνους που
δεσμεύονται κατά τη διάρκεια της σταθεροποίησης.[κ]

Η έρευνα στοχεύει να προσδιορίσει τα γονίδια που ρυθμίζονται
κατά τη διάρκεια της σταθεροποίησης, επαναπαγίωσης και εξάλειψης της μνήμης
χρησιμοποιώντας έναν συνδυασμό από μεγάλο όγκο έργου σκιαγράφησης με
χρησιμοποίηση της microarray τεχνολογίας και της πρωτεϊνικής στοχοθέτησης με
αντιαγγελιαφόρου και siRNA τεχνολογίες. Αυτό θα οδηγήσει τελικά στον
προσδιορισμό χωριστών μηχανισμών της σταθεροποίησης, επαναπαγίωσης και
εξάλειψης, και όπου στον εγκέφαλο αυτές οι διαδικασίες εμφανίζονται. Αυτοί οι
μοριακοί διαχωρισμοί μπορούν να παρέχουν νέους στόχους για τη θεραπεία στις
αναταραχές της ανθρώπινης μνήμης όπως η μετα - τραυματική αναταραχή στρές,
φοβίες και εθισμός φαρμάκων, όπου επίμονες μνήμες κρύβονται κάτω από την
δυσπροσάρμοστης συμπεριφορά. Ενδεχομένως με την προώθηση της εξάλειψης και/ή η
παρεμπόδιση της επαναπαγίωσης επανενεργοποιημένων μνημών θα μπορούσε να
αντιμετωπιστεί χωριστά χωρίς επιρροή της απόκτησης σε νέες μνήμες ή άλλες μη -
υπενθυμισμένες μνήμες.[κ]
Μελέτη των µοριακών µηχανισµών
της µνήµης σε έντοµα
Drosophila Στα έντοµα
οι δύο πιο σηµαντικές δοµές του κεντρικού εγκεφάλου είναι τα αµφοτερόπλευρα,
συµµετρικά mushroom bodies και το κενρικό σύµπλεγµα (central complex). Το
κεντρικό σύµπλεγµαεµπλέκεται κυρίως στη ρύθµιση της συµπεριφορικής
δραστηριότητας ενώ τα mushroom bodies είναι υπεύθυνα για τον ανώτερο έλεγχο
συγκεκριµένων κινητικών προγραµµάτων, της µνήµης και της µάθησης. Τα mushroom bodies αποτελούν το πιο σηµαντικό
νευρωνικό κύκλωµα που συνδέεται µε τη µνήµη και τη µάθηση στα έντοµα, ειδικά
όταν αυτή προκαλείται από οσφρητικά ερεθίσµατα. Τα mushroom bodies αποτελούνται
από νευρικά κύτταρα, τα Kenyon κύτταρα. Η µνήµη σχηµατίζεται εν µέρει από τη
µεταβολή της φυσιολογίας των νευρώνων την οποία προκαλούν νευροπεπτίδια. Τα
νευροπεπτίδια αυτά είναι προϊόντα του γονιδίου amnesiac και απελευθερώνονται
από πεπτιδεργικούς νευρώνες που νευρώνουν τα mushroom bodies. Μελέτες σε Kenyon κύτταρα σε ενήλικες
Drosophila έδειξαν µια συγχρονισµένη ταλάντωση της ενδοκυττάριας συγκέντρωσης
ασβεστίου µε µια µέση περίοδο 4 λεπτών. Το εύρος της ταλάντωσης αυτής
µεταβάλλεται ισχυρά από τα προϊόντα του γονιδίου amnesiac, που είναι υπεύθυνο
για τη σταθεροποίηση της μνήμης. Ακόµη, σε knock out για το γονίδιο amnesiac
έντοµα, παρατηρείται αργή και αυτόµατη αύξηση της ταλάντωση των επιπέδων
ασβεστίου ενδοκυττάρια στα mushroom bodies. Τα παραπάνω είναι ενδεικτικά των
µοριακών µηχανισµών µνήµης στη Drosophila. Apis mellifera Στη µέλισσα Apis
mellifera η διαδικασία της µνήµης συνδέεται µε συστήµατα δευτέρων αγγελιοφόρων
που προκαλούν τη φωσφορυλίωση πρωτεϊνών. ∆ιαφορετικές µορφές της οσφρητικής
µνήµη στη µέλισσα εξαρτώνται από διαφορετικά συστήµατα δευτέρων αγγελιοφόρων,
µιας cAMP εξαρτώµενης φωσφορυλίωσης µέσω PKA και µιας Ca21/ από φωσφολιπίδια
εξαρτώµενης φωσφορυλίωσης µέσωPKC. Εποµένως, µεγάλο ενδιαφέρον για τη µελέτη
της µνήµης παρουσιάζει η εντόπιση των PKA και PKC στα νευρωνικά κυκλώµατα που
εµπλέκονται στη µνήµη, όπως τα mushroom bodies και τα antennal lobes. Με
µεθόδους ανοσοϊστολογίας έγινε µια συγκριτική µελέτη της κατανοµής των PKA και
PKC στον εγκέφαλο της µέλισσας µε εστίαση στα antennal lobes και στα mushroom
bodies, δοµές που εµπλέκονται στην οσφρητική µνήµη. Tα αποτελέσµατα της
ανοσοϊστολογικής µελέτης έδειξαν ότι PKA εντοπίζεται παντού στον εγκέφαλο ενώ η
Ca21/από φωσφολιπίδια εξαρτώµενη PKC εντοπίζεται κυρίως στα antennal lobes και
στα mushroom bodies. Στα antennal lobes, η PKAII εντοπίζεται στους αισθητικούς
νευρώνες και στους ενδιάµεσους νευρώνες. Αντιθέτως, η ανοσοσήµανση της PKC
οφείλεται αποκλειστικά στους ενδιάµεσους νευρώνες, µε χαρακτηριστική επίταση
της σήµανσης στην κεντρική περιοχή των antennal lobes. Τα mushroom bodies
παρουσιάζουν την υψηλότερη συγκέντρωση σε PKC και PKAII στον εγκέφαλο. Οι PKAII
και PKC εκφράζονται σε διαφορετικά επίπεδα στις διάφορες υποοµάδες των Kenyon κυττάρων.
Στη διαφορετική αυτή κατανοµή των PKAII και PKC στα antennal lobes και στα
mushroom bodies, τουλάχιστον εν µέρει, οφείλεται και ο διαφορετικός ρόλος τους
στη διαδικασία της οσφρητικής µνήµης. [η]
Συζήτηση-Μελλοντικοί Στόχοι
Στην παραπάνω µελέτη χρησιµοποιήσαµε για να περιγράψουµε τους
µοριακούς µηχανισµούς της µνήµης δύο οργανισµούς µε µεγάλη φυλογενετική
απόσταση. Οι κυτταρικές και µοριακές στρατηγικές που χρησιµοποιεί η Aplysia για
την αποθήκευση της short-term και long-term memory διατηρούνται στα θηλαστικά
και οι ίδιοι µοριακοί µηχανισµοί εµπλέκονται στην αποθήκευση τόσο της implicit
όσο και της explicit memory. Και στις
δύο αυτές µορφές µνήµης υπάρχουν στάδια της µνήµης που κωδικοποιούνται ως
αλλαγές στις συνάψεις. Οι short term αλλαγές των συνάψεων περιλαµβάνουν
µετατροπή προϋπαρχόντων πρωτεϊνών που οδηγούν σε αλλαγές σε προϋπάρχουσες
συνάψεις. Αντιθέτως, οι long-term συναπτικές αλλαγές
περιλαµβάνουν ενεργοποίηση έκφρασης γονιδίων, νέα
πρωτεϊνοσύνθεση και σχηµατισµό νέων συνάψεων.
Παρατηρούµε ακόµη ότι ενώ η short-term αποθήκευση στην implicit
και explicit memory απαιτούν διαφορετικά συστήµατα µετάδοσης του σήµατος, η
long-term αποθήκευση και των δύο αυτών τύπων µνήµης χρησιµοποιεί ως πυρήνα την
οδό των PKA, MAPK και CREB-1. Τέλος τόσο στην implicit όσο και στην explicit
memory ο διακόπτης που ρυθµίζει τη µετάβαση από τη short-term στη long-term
memory είναι περιοριστικοί παράγοντες των γονιδίων.
Μέχρι σήµερα το µεγαλύτερο µέρος της µελέτης έχει εστιασθεί
στους µηχανισµούς αποθήκευσης της µνήµης. Το πιο δύσκολο όµως µέρος είναι η
µελέτη της µνήµης ως ένα σύστηµα. Πώς αλληλεπιδρούν οι διάφορες περιοχές του
εγκεφάλου; Πώς οι πληροφορίες µεταφέρονται στο νεοφλοιό για µόνιµη αποθήκευση;
Πώς γίνεται άραγε η ανάκληση των πληροφοριών; Για τον ερευνητή του παρόντος και
του µέλλοντος λοιπόν, υπάρχουν ακόµη πολλά αναπάντητα ερωτήµατα στα οποία
καλείται να δώσει λύσεις.[α]
Η ασθένεια του Αλτσχάιμερ εντάσσεται στις ασθένειες τις οποίες
φοβούνται περισσότερο οι άνθρωποι. Πρόκειται για μια εκφυλιστική πάθηση που
ανήκει στο σύνολο των διαταραχών που προκαλούν άνοια οι οποίες διαταράσσουν και
αποδιοργανώνουν καταστρέφοντας τις νοητικές και άλλες λειτουργίες του
εγκεφάλου.
Οι διάφορες μορφές άνοιας όπως και η ασθένεια του Αλτσχάιμερ,
δεν αποτελούν φυσιολογική εξέλιξη που προκύπτει λόγω γήρανσης. Υπάρχουν
διάφορες μορφές άνοιας με πολλές διαφορετικές αιτίες. Η νόσος του Αλτσχάιμερ
είναι η συχνότερη μορφή άνοιας.
Η άνοια μπορεί να εμφανιστεί σε ηλικιωμένους αλλά και σε νέους.
Όμως η συχνότητα της νόσου Αλτσχάιμερ, αυξάνεται με την αύξηση της ηλικίας.
Επειδή ο μέσος όρος διάρκειας ζωής των ανθρώπων αυξάνεται, ταυτόχρονα αυξάνεται
και ο αριθμός των ανθρώπων που παρουσιάζουν την πάθηση.
Ένα από τα πιο χαρακτηριστικά προβλήματα της νόσου Αλτσχάιμερ
που μάλιστα αρχίζουν να εμφανίζονται από τα πρώτα της στάδια, είναι η σταδιακή
απώλεια μνήμης. Είναι όμως σημαντικό να γίνεται ξεκάθαρα η διαφορά μεταξύ των
δυσκολιών της μνήμης λόγω ηλικίας και της απώλειας μνήμης που παρατηρείται στη
νόσο Αλτσχάιμερ.[β]
Η απώλεια μνήμης λόγω
ηλικίας
Υπάρχει σαφής διαφορά μεταξύ των προβλημάτων μνήμης που
προκύπτουν λόγω αύξησης της ηλικίας και νόσου Αλτσχάιμερ. Οι διαφορές αυτές
τεκμηριώνονται από αντικειμενικά ευρήματα στον εγκέφαλο και από τα συμπτώματα
που παρουσιάζουν οι ηλικιωμένοι και οι ασθενείς.
Στην άνοια, (Εικόνα 15 ) επηρεάζονται με απώλειες, το σύνολο των
πνευματικών γνωσιακών ικανοτήτων. Αντίθετα τα προβλήματα μνήμης λόγω ηλικίας
χαρακτηρίζονται κυρίως από μια δυσκολία των ανθρώπων να θυμούνται γεγονότα,
πρόσωπα, τόπους και πράγματα που αντιμετωπίζουν καθημερινά.
Για παράδειγμα μπορεί ένας ηλικιωμένος να ξεχνά περιστασιακά που
έχει παρκάρει το αυτοκίνητο του. Εάν όμως ξεχνά πώς είναι το αυτοκίνητο του,
τότε υπάρχει λόγος ανησυχίας.
Μια σημαντική διαπίστωση που προέκυψε από τις έρευνες, είναι ότι
οι ασθενείς με Αλτσχάιμερ, συγκρατούν μετά την παρέλευση κάποιου χρόνου πολύ
λιγότερες πληροφορίες από ότι οι υγιείς άνθρωποι. Αυτό σημαίνει ότι μπορεί να
είναι σε θέση να μαθαίνουν νέα πράγματα αλλά θα θυμούνται μόνο λίγα μετά την
παρέλευση μερικών ωρών.[β]

Εικόνα 15 [στ]
Αλλαγές της μνήμης και
νόσος Αλτσχάιμερ
Σε μερικούς αλλά όχι σε όλους τους ασθενείς, μια ήπια γνωσιακή
μειονεξία (επαναλαμβανόμενα κενά της βραχυπρόθεσμης μνήμης), μπορεί να
εντάσσεται στα πρώτα στάδια της νόσου Αλτσχάιμερ. Οι εν λόγω διαταραχές της
μνήμης εμφανίζονται και διαρκούν για ένα έως δύο χρόνια και μπορούν να
αξιολογηθούν με τη βοήθεια ψυχολογικών τεστ.
Οι αλλοιώσεις αυτές της μνήμης, είναι αρχικά πολύ ήπιες και
παρατηρούνται από κάποιο αγαπημένο πρόσωπο του ασθενούς που βρίσκεται κοντά
του. Είναι λοιπόν σημαντικό να ζητήσετε τη βοήθεια του γιατρού σας, εάν εσείς ή
κάποιο αγαπημένο σας πρόσωπο, έχετε δυσκολίες μνήμης ή ξεχνάτε πράγματα που
διαταράσσουν την εργασία σας ή το τι κάνετε στο σπίτι σας.
Μην ξεχνάτε επίσης ότι το στρες και η κούραση επηρεάζουν τη
μνήμη. Υπάρχουν επίσης άλλοι λόγοι που δυνατόν να προκαλούν κενά της μνήμης όπως
φάρμακα, κατάθλιψη, τραυματισμοί στο κεφάλι και εγκεφαλικά επεισόδια.[β]
Οι αιτίες της νόσου
Αλτσχάιμερ
Οι νευρώνες του εγκεφάλου καταστρέφονται και σταδιακά μειώνονται
σε αριθμό στη νόσο Αλτσχάιμερ. Οι νευρώνες που σχηματίζουν τις λειτουργικές
δομές στον ιππόκαμπο του εγκεφάλου που ελέγχουν και οργανώνουν τη μνήμη, είναι
ιδιαίτερα ευάλωτοι στις καταστροφικές αλλοιώσεις που παρατηρούνται στη νόσο
Αλτσχάιμερ.
Πολλοί ειδικοί πιστεύουν σήμερα ότι ο θάνατος των νευρώνων του
εγκεφάλου, σχετίζεται με τη δημιουργία στον εγκέφαλο των πλακών της αμυλοειδούς
πρωτεΐνης. Οι πλάκες αυτές που είναι συσσωρεύσεις της αμυλοειδούς πρωτεΐνης,
παρατηρήθηκαν για πρώτη φορά πριν 100 χρόνια από το γιατρό Alois Alzheimer που
περιέγραψε την πάθηση για πρώτη φορά.
Δεν είναι ξεκάθαρο εάν οι πλάκες αμυλοειδούς είναι η αιτία
πρόκλησης θανάτου των νευρώνων ή εάν είναι τα υπολείμματα των νεκρωμένων
κυττάρων. Επίσης διερευνάται κατά πόσο η παρουσία της αμυλοειδούς είναι αιτία
ενεργοποίησης άλλων μηχανισμών σε συνέργεια με πρωτεΐνες που ήδη υπάρχουν στους
νευρώνες οδηγώντας έτσι σε εκφυλιστικές αλλοιώσεις.
Συνοπτικά, μπορούμε να πούμε ότι μέχρι σήμερα, οι επιστήμονες
δεν κατάφεραν να ανακαλύψουν τι προκαλεί την έναρξη της νόσου Αλτσχάιμερ σε
ορισμένους ανθρώπους. Στις σπάνιες μορφές της νόσου με έναρξη σε μικρότερη
ηλικία από ότι συνήθως, πιθανόν να παίζουν ρόλο κληρονομικά γονίδια. Όμως στις
συνήθεις μορφές Αλτσχάιμερ, η επιρροή της κληρονομικότητας δεν έχει ακόμη
διευκρινιστεί.[β]
Τα συμπτώματα της νόσου
Αλτσχάιμερ
Εκτός από την απώλεια μνήμης, τα πρώτα σημεία της νόσου, συχνά
περιλαμβάνουν δυσκολίες της ομιλίας και των καθημερινών δραστηριοτήτων όπως το
οδήγημα και το ψώνισμα. Στα τελευταία στάδια, οι ικανότητες ομιλίας και
βαδίσματος, πιθανόν να χαθούν.
Κάθε ασθενής με Αλτσχάιμερ, μπορεί να έχει τη δική του
εξελικτική εικόνα με διάφορα σημεία και συμπτώματα. Μερικά από τα συχνότερα
συμπτώματα, είναι τα ακόλουθα:
·
Μεγάλη δυσκολία του ασθενούς στο να θυμάται
ονόματα, αντικείμενα, τόπους, ώρες και ημερομηνίες
·
Δυσκολίες στην αναγνώριση ατόμων της οικογένειας
και φίλων. Αδυναμία στο να θυμάται ο ασθενής το όνομα τους
·
Ο ασθενής ξεχνά τον αριθμό του δικού του τηλεφώνου
και τη διεύθυνση του
·
Δυσκολεύεται στο να βρει το δρόμο για να πάει
από το σπίτι του σε ένα γνωστό του τόπο ή από γνωστό του τόπο να πάει σπίτι του
·
Τάση να χάνεται περιπλανώμενος από το σπίτι ή
από τη δουλειά του
·
Ξεχνά να τρώει ή να κάνει τα απαραίτητα για την
υγιεινή του
·
Αποπροσανατολισμός τη νύκτα ή την ημέρα και
προβλήματα ύπνου
·
Εμφανής χειροτέρευση των δεξιοτήτων νόησης και
ομιλίας
·
Μείωση της ικανότητας κρίσεως, αδυναμία
ακολούθησης απλών οδηγιών και συγκέντρωσης σε ένα πράγμα
·
Προοδευτική εγκατάσταση αισθήματος δυσπιστίας, ο
ασθενής γίνεται φιλύποπτος
·
Συναισθηματική απάθεια, μείωση του ενδιαφέροντος
για δραστηριότητες
·
Κατάθλιψη
·
Ασυνήθιστη ταραχή και ερεθιστικότητα
·
Ψευδαισθήσεις και αυταπάτες
Παρά το γεγονός ότι η διάγνωση της νόσου Αλτσχάιμερ προκαλεί
φόβο στους περισσότερους ανθρώπους και υπάρχει η τάση να αποφεύγουμε να μιλούμε
για το θέμα, εντούτοις είναι σημαντικό να έχουμε μια όσο το δυνατό καλύτερη και
πληρέστερη ενημέρωση.
Η έγκαιρη ανίχνευση της νόσου Αλτσχάιμερ διασφαλίζει την άμεση
έναρξη των μέτρων αντιμετώπισης της πάθησης για την καλύτερη δυνατή εξέλιξη του
ασθενούς και είναι προς όφελος όλης της οικογένειας.[β]
Η μνήμη και οι γνωσιακές ικανότητες μπορεί να μειώνονται λόγω
του ότι στο αίμα συσσωρεύεται η ομοκυστεϊνη.
Το πρόβλημα μπορεί να αντιμετωπισθεί και η μνήμη να βελτιωθεί,
χάρις στο φολικό οξύ και τις άλλες βιταμίνες Β που βοηθούν στην εξουδετέρωση
της ομοκυστεϊνης στον οργανισμό.
Η ομοκυστεϊνη είναι αμινοξύ το οποίο όταν συγκεντρωθεί σε
μεγάλες ποσότητες στον οργανισμό μας, αυξάνει τον κίνδυνο για αθηρωμάτωση των
αρτηριών, στηθάγχη, έμφραγμα και εγκεφαλικά επεισόδια.
Επίσης έχει βρεθεί σε έρευνες ότι τα ψηλά επίπεδα ομοκυστεϊνης
στους ηλικιωμένους μειώνουν τις πνευματικές και ιδιαίτερα τις γνωσιακές
ικανότητες.
Σε πρόσφατη εργασία που έγινε από γιατρούς του πανεπιστημίου της
Οξφόρδης, εξετάστηκε σε 2.100 ηλικιωμένους, η σχέση ομοκυστεϊνης, φολικού οξέος
και βιταμίνης Β12 από τη μια και μνήμης από την άλλη. Οι ερευνητές εξέτασαν τα
επίπεδα των εν λόγω ουσιών στο αίμα των συμμετεχόντων κατά το 1992-1993 και
μετά ξανά 6 χρόνια αργότερα.
Τα αποτελέσματα έδειξαν ότι τα άτομα που είχαν ψηλότερα επίπεδα
ομοκυστεϊνης στο αίμα τους και χαμηλότερο φολικό οξύ, είχαν σημαντικά
χειρότερες επιδόσεις σε ειδικά τεστ μνήμης. Η χειροτέρευση της μνήμης αυξανόταν
με την αύξηση των επιπέδων ομοκυστεϊνης στο αίμα.
Είναι σημαντικό ότι χάρις στην ορθή διατροφή πλούσια σε φολικό
οξύ και άλλες βιταμίνες Β, είναι δυνατόν τόσο οι νέοι όσο και οι ηλικιωμένοι,
να βοηθούν τον οργανισμό τους να διασπά την ομοκυστεϊνη. Έτσι προστατεύουν τον
εγκέφαλο, τη μνήμη, τις πνευματικές και γνωστικές ικανότητες, την καρδία και τα
αγγεία τους.
Το φολικό οξύ ανήκει στην οικογένεια των βιταμινών Β (βιταμίνη
Β9). Τα τρόφιμα που είναι πλούσια σε φολικό οξύ είναι:
Μπρόκολο, μπιζέλι, σπαράγγια, πράσινα φυλλώδη λαχανικά
Μπανάνες, πορτοκάλια
Ψωμί, δημητριακά, μακαρόνια
Ξηροί καρποί, όσπρια
Οι βιταμίνες της οικογένειας Β και ιδιαίτερα οι Β1, Β6 και Β12
που βοηθούν το νευρικό σύστημα, περιέχονται στα ακόλουθα τρόφιμα:
Ψάρι, κρέας, πουλερικά
Σόγια, δημητριακά, μπιζέλια, μη αποφλοιωμένο ρύζι
Ξηροί καρποί, μπανάνες
Αυγά, γαλακτοκομικά προϊόντα
Πρέπει επίσης να υπενθυμίσουμε ότι για την προστασία της μνήμης,
ένα από τα σημαντικότερα όπλα που μπορούμε να χρησιμοποιούμε είναι η σωματική
άσκηση. Η καθημερινή άσκηση βελτιώνει την κατάσταση του εγκεφάλου, αυξάνει την
οξυγόνωση των νευρικών κυττάρων, βελτιώνει τη μνήμη και μειώνει τον κίνδυνο για
ασθένεια του Αλτσχάιμερ.
Επιπρόσθετα ο καλύτερος χειρισμός του στρες και η μείωση του,
εξουδετερώνουν την κορτιζόνη που απελευθερώνεται σε καταστάσεις στρες. Η
κορτιζόνη όταν επιδρά με χρόνιο τρόπο και με αυξημένες συγκεντρώσεις στον
εγκέφαλο, προκαλεί ατροφία των κέντρων μνήμης του εγκεφάλου.[γ]
Ο καλός ύπνος διασώζει τη μνήμη
Πιθανόν να θυμάστε την τελευταία φορά που πήγατε για ύπνο με μια
ερώτηση που σας απασχολούσε και όταν ξυπνήσατε είχατε την απάντηση.
Το φαινόμενο αυτό συμβαίνει σε πολλούς και τώρα οι επιστήμονες
άρχισαν να καταλαβαίνουν πως ο ύπνος οργανώνει, διατηρεί, συνενώνει και
διασφαλίζει τη μνήμη. Μάλιστα δεν θα ήταν υπερβολή να πούμε ότι ο ύπνος μπορεί
να είναι μέρος ενός εκπαιδευτικού προγράμματος και της μάθησης γενικότερα.
Πολλές πληροφορίες που μας δίνονται και αποθηκεύονται προσωρινά
όταν είμαστε ξύπνιοι, δια μέσου ενός καλού ύπνου συγκεντρώνονται, οργανώνονται
και αποθηκεύονται.
Όμως προσοχή διότι εάν δεν ακολουθήσει ένας καλός ύπνος μετά από
την πρόσληψη των πληροφοριών, η ποιότητα της επεξεργασίας και αποθήκευσης των
πληροφοριών για μελλοντική χρήση δεν είναι τόσο καλή. Εάν ο ύπνος ακολουθήσει
πολύ πιο αργά υπάρχει απώλεια στην ποιότητα της μάθησης.
Κατά τη διάρκεια μια δύσκολης μέρας, βομβαρδιζόμαστε με ένα
απίστευτα μεγάλο όγκο πληροφοριών. Έρχονται ακανόνιστα και γίνεται συνεχώς μια
ανάμειξη μεταξύ καινούργιων πληροφοριών και παλαιότερων που η μνήμη καλεί για
χρήση ανάλογα με τις ανάγκες.
Μέσα σε αυτή την εντατική λειτουργία υπάρχει κίνδυνος απώλειας
και αποδιοργάνωσης των δεδομένων. Ο ύπνος που ακολουθεί συνενώνει διάφορα
κομμάτια πληροφόρησης και διασφαλίζει την αποκατάσταση παλαιότερης μνήμης που
χρησιμοποιήθηκε τη συγκεκριμένη ημέρα.
Φαίνεται ότι η ανάκληση πληροφοριών από τη μνήμη, είναι μια
διαδικασία που μπορεί να τροποποιήσει την ποιότητα των πληροφοριών.
Δηλαδή όταν θυμόμαστε ένα
γεγονός, οι πληροφορίες που σχετίζονται με αυτό, μπορ-ούν να υποστούν αλλαγές
και όταν πάλι αποθηκευτούν να υπάρχουν αλλαγές όσον αφορά τα γεγονότα που είχαν
αρχικά συμβεί.
Ο καλός ύπνος συμβάλλει στην αποκατάσταση και επαναφορά στην
αρχική κατάσταση των σχετικών πληροφοριών με τρόπο τέτοιο που η μνήμη να μην
αλλοιώνεται. Όμως η στέρηση ύπνου ή ο ύπνος κακής ποιότητας, παρεμποδίζουν την
επαναφορά και αποκατάσταση και αποθήκευση των πληροφοριών στη μνήμη με τον ορθό
τρόπο.
Εδώ οι επιστήμονες βλέπουν μια πρακτική εφαρμογή σε άτομα που
πάσχουν ψυχολογικά σε σοβαρό βαθμό, από το σύνδρομο του μετατραυματικού στρες.
Στο σύνδρομο αυτό, οι ασθενείς που έζησαν ένα τραυματικό γεγονός
όπως μια μεγάλη καταστροφή ή πολεμικές εμπειρίες, υποφέρουν κάθε φορά που
επαναφέρουν στη μνήμη τους τα τραυματικά γεγονότα. Ίσως μελλοντικά οι γνώσεις
που θα αποκτηθούν, αναφορικά με το ρόλο του ύπνου στη μνήμη, να επιτρέψουν μια
επιλεκτική επεξεργασία των πληροφοριών που είναι αποθηκευμένες στη μνήμη με
τρόπο τέτοιο που οι ασθενείς να ανακουφίζονται.
Ο ρόλος του ύπνου στους μηχανισμούς μάθησης δεν περιορίζεται
μόνο στις πνευματικές δεξιότητες αλλά επεκτείνεται και στις κινητικές δεξιότητες.
Αυτοί που εκπαιδεύονται στο να κάνουν πράγματα με τα χέρια τους, όταν κοιμηθούν
μετά από μια εκπαιδευτική περίοδο, μαθαίνουν και διατηρούν μακροχρόνια καλύτερα
τις δεξιότητες που απέκτησαν κατά την εκπαιδευτική περίοδο.
Μάλιστα φάνηκε από πειράματα ότι αυτοί που μάθαιναν κάτι το
βράδυ και λόγω του ότι ακολουθούσε ο ύπνος μετά, αποκτούσαν καλύτερες
δεξιότητες σε σύγκριση με αυτούς που δεν κοιμόντουσαν αμέσως μετά από μια
εκπαιδευτική δραστηριότητα διότι για παράδειγμα η δραστηριότητα αυτή έγινε το πρωί.
Δηλαδή εάν ο ύπνος ακολουθήσει σύντομα μετά από την εκμάθηση, η
επεξεργασία των νεοαποκτηθέντων πληροφοριών γίνεται καλύτερα και οι δεξιότητες
που αποκτούνται βελτιώνονται.
Οι σημαντικές αυτές διαπιστώσεις μπορούν να βοηθήσουν στη
εφαρμογή εκπαιδευτικών προγραμμάτων για καλύτερη μάθηση όπως επίσης και για την
αντιμετώπιση ψυχιατρικών ασθενειών. Η επέμβαση στις πληροφορίες που
αποθηκεύονται δια μέσου της φυσιολογίας του ύπνου, μπορεί να έχει πολλές
εφαρμογές.
Τα αξιόλογα αυτά νέα δεδομένα έχουν προκύψει από πρόσφατες
έρευνες που έγιναν από ερευνητές του πανεπιστημίου του Σικάγου. Η φυσιολογία
του ύπνου και ο συσχετισμός της με τις διαδικασίες αποθήκευσης, ανάκλησης και
επεξεργασίας των πληροφοριών της μνήμης ελκύει μεγάλο ενδιαφέρον.
Η εκμετάλλευση των χρήσιμων πληροφοριών, η απόρριψη των λιγότερο
σημαντικών, η αποθήκευση και ανάκλησή τους από τη μνήμη αποκτούν τεράστια
σημασία σήμερα που κατακλυζόμαστε καθημερινά από ένα τεράστιο όγκο νέων
δεδομένων.[δ,ε]
[α] Ζησοπούλου Στυλιανή, Ο
ρόλος των δεύτερων αγγελιοφόρων στη διαδικασία της µνήµης – µια προσπάθεια
κατανόησης των µοριακών µηχανισµών, Μεταπτυχιακό Πρόγραµµα Σπουδών στις
Βασικές Νευροεπιστήµες, Τµήµα Ιατρικής, Πανεπιστήµιο Κρήτης.
[β] http://www.medlook.net/article.asp?item_id=2210
[γ] Plasma total homocysteine and
memory in the elderly: The Hordaland Homocysteine study, Annals of Neurology 2005;58(6):847-857, Δεκέμβριος 2005.
[δ] Consolidation during sleep of
perceptual learning of spoken language, Nature 2203;425:614 - 616, 9 Οκτωβρίου 2003
[ε] Dissociable stages of human memory
consolidation and reconsolidation, Nature 425;616 - 620, 9 Οκτωβρίου 2003.
[στ] ΣΚΟΥΛΑΚΗΣ Ε., Ο ΡΟΛΟΣ
ΤΩΝ ΠΡΩΤΕΙΝΩΝ 14-3-3 ΣΤΗ ΜΑΘΗΣΗ ΚΑΙ ΣΤΗ ΜΝΗΜΗ, ΕΡΓΑΣΤΗΡΙΟ ΜΟΡΙΑΚΗΣ
ΝΕΥΡΟΒΙΟΛΟΓΙΑΣ ΜΑΘΗΣΗΣ ΜΝΗΜΗΣ ΚΑΙ ΣΥΜΠΕΡΙΦΟΡΑΣ, ΙΝΣΤΙΤΟΥΤΟ ΜΟΡΙΑΚΗΣ ΒΙΟΛΟΓΙΑΣ
ΚΑΙ ΓΕΝΕΤΙΚΗΣ, ΕΡΕΥΝΗΤΙΚΟ ΚΕΝΤΡΟ ΒΙΟΙΑΤΡΙΚΩΝ ΕΠΙΣΤΗΜΩΝ ΑΛΕΞΑΝΔΡΟΣ ΦΛΕΜΙΓΚ.
[ζ] Roberts, A.
C., Glanzman, D. L. Learning in Aplysia:
looking at synaptic plasticity from both sides. Trends Neurosci. 26(12),
662-670 (2003).
[η] Rosay, P.,
Armstrong, J. D., Wang, Z., Kaiser, K. Synchronized
neural activity in the Drosophila memory centers and its modulation by amnesiac.
Neuron 30(3), 759-770 (2001).
[θ] Poser, S.,
Storm, D. R. Role of Ca2+
-stimulated cyclases in LTP and memory formation. Int. J. Devl.
Neuroscience 19, 387-394 (2001).
[ι] Abraham, W.
C., Williams, J. M. Properties and
mechanisms of LTP maintenance. Neuroscientist. 9(6), 463-474 (2003).
[κ] Kerrie L. THOMAS PhD, Cardiff School of
Biosciences, BIOSI 3, Museum Avenue, Cardiff CF10 3US, UK, http://www.cardiff.ac.uk/biosi/research/neuroscience/staff/thomas.html
10. Μηχανισμοί δράσης της ινσουλίνης. Νεότερες προσεγγίσεις
στη θεραπεία του σακχαρώδους διαβήτη
Εισαγωγή
Το πάγκρεας, εκτός από την πεπτική του λειτουργία, εκκρίνει και
δυο σημαντικές ορμόνες, την ινσουλίνη και γλυκαγόνη. Το πάγκρεας αποτελείται
από δυο διαφορετικούς τύπους ιστού, (Εικόνα 1): (1) αδενοκυψέλες. από τις
οποίες εκκρίνονται πεπτικά υγρά προς το δωδεκαδάκτυλο, και (2) νησίδια του
Langerhans, τα οποία δεν διαθέτουν κανένα μέσο για την απόδοση του εκκρίματος
τους προς τα έξω, αλλά εκκρίνουν ινσουλίνη και γλυκαγόνη κατευθείαν προς το
αίμα. Τα νησίδια του Langerhans, περιέχουν τρεις κυρίους τύπους κυττάρων, τα
άλφα. βήτα και δέλτα, κύτταρα, που διακρίνονται μεταξύ τους από μορφολογικά και
χρωστικά χαρακτηριστικά. Τα βήτα κύτταρα εκκρίνουν ινσουλίνη, τα άλφα κύτταρα
γλυκαγόνη και τα δέλτα κύτταρα εκκρίνουν σωματοστατίνη.[α]

Εικόνα 1 Η φυσιολογική ανατομία του παγκρέατος
 [ω7]
[ω7]
Η ινσουλίνη είναι ένα μεγάλο πολυπεπτίδιο (μικρή πρωτείνη), με
μοριακό βάρος 5.808 στην περίπτωση του ανθρώπου. Αποτελείται από δύο πεπτιδικές
αλυσίδες, που συνδέονται μεταξύ τους με δισουλφιδικούς δεσμούς.(Εικόνα 2)
Πριν η ινσουλίνη μπορέσει να ασκήσει την επίδρασή της πρέπει
πρώτα να συνδεθεί με μία μεγάλη ,πρωτεΐνη-υποδοχέα. στην κυτταρική μεμβράνη.[α]

Εικόνα 2 [β]
Βιοσύνθεση και έκκριση της
ινσουλίνης.
Ή ινσουλίνη συνθέτεται σαν προϊνσουλίνη, σύμφωνα με τις αρχές
της πρωτεϊνικής βιοσυνθέσεως. στα ριβοσώματα του κοκκιώδους ενδοπλασματικού
δικτύου. Ή πεπτιδική αλυσίδα αποτελούμενη από 84 αμινοξέα εισέρχεται αμέσως στις
δεξαμενές του ενδοπλασματικού δικτύου, Ή προϊνσουλίνη (Εικόνα 3 )μεταφέρεται
στο σύστημα Golgi και φθάνει με μεταφορικά κυστίδια στις δεξαμενές του
συστήματος.

Εικόνα 3 Σύνθεση ινσουλίνης
- Η παραγωγή της ινσουλίνης περιλαμβάνει τα ενδιάμεσα βήματα. Αρχικά, η προπροινσουλίνη
είναι ανενεργή και εκκρίνεται από τοενδοπλασματικό δίκτυο. Μετα - μεταφραστική επεξεργασία
κόβει την N-τελική σηματοδοτική
αλληλουχία και σχηματίζει γέφυρες δισουλφιδίου. Τελικά, το πολυπεπτίδιο κόβεται
σε δύο θέσεις για να απελευθερώσει την παρεμβαλλόμενη αλυσίδα C. Αυτή και η ενεργός ινσουλίνη
συσκευάζεται τελικά στους εκκριτικούς κόκκους για αποθήκευση.[στ]
Στο σύστημα αρχίζει ή μεταβολή της προϊνσουλίνης σε ινσουλίνη,
πού συνεχίζεται αργότερα στα έτοιμα κοκκία. Τα έτοιμα β-κοκκία εναποθηκεύονται
και μεταφέρονται με μικροσωληνίσκους στη βασική μεμβράνη. Αποδίδουν αμέσως
ινσουλίνη από τα κύτταρα μετά από ερεθισμό για έκκριση. Σε περιπτώσεις υπερβολικής
εναποθηκεύσεως εκκρίματος (σε παθολογικές καταστάσεις) μπορεί να γίνει έκκριση
χωρίς τη συμμετοχή των αποταμιευτικών κοκκίων. (Εικόνα 4) [β]

Εικόνα 4 [β]
Η βασική λειτουργία της
ινσουλίνης: Ενεργοποίηση των υποδοχέων των κυττάρων - στόχων από την ινσουλίνη
και οι συνακόλουθες επιδράσεις στα κύτταρα
Για την έναρξη των επιδράσεων της ινσουλίνης στα κύτταρα-στόχους,
η ινσουλίνη συνδέεται πρώτα με μια δεκτική πρωτεϊνη, που βρίσκεται στην
κυτταρική μεμβράνη, με μοριακό βάρος 300.000 περίπου, και στη συνέχεια την
ενεργοποιεί. Οι επακόλουθες επιδράσεις προκαλούνται από αυτόν τον
ενεργοποιημένο υποδοχέα και όχι από την ινσουλίνη.
 [ω7]
[ω7]
Ο υποδοχέας για την ινσουλίνη αποτελείται από τέσσερις
ξεχωριστές υπομονάδες, που συνδέονται μεταξύ τους με δισουλφιδικούς δεσμούς,
δύο άλφα υπομονάδες, που βρίσκονται εντελώς έξω από την κυτταρική μεμβράνη, και
δύο βήτα υπομονάδες. που διαπερνούν τη μεμβράνη και το ένα άκρο τους προεξέχει
μέσα στο κυτόπλασμα του κυττάρου.(Εικόνα 5 )[α]

Εικόνα 5 [δ]
 [ω7]
[ω7]
Η ινσουλίνη συνδέεται με τις άλφα υπομονάδες, που βρίσκονται έξω
από το κύτταρο. Εξαιτίας όμως των δεσμών με τις βήτα υπομονάδες, τα τμήματα των
βήτα υπομονάδων που προεξέχουν προς το εσωτερικό του κυττάρου υφίστανται
αυτοφωσφορυλίωση. Με αυτό τον τρόπο, οι μονάδες αυτές καθίστανται
ενεργοποιημένο ένζυμο, μια τοπική πρωτεϊνική κινάση, η οποία με τη σειρά της
προκαλεί τη φωσφορυλίωση πολλαπλών άλλων ενζύμων της κυτοσόλης. Το τελικό αποτέλεσμα
συνίσταται σε ενεργοποίηση ορισμένων από αυτά τα ένζυμα και στην απενεργοποίηση
άλλων. Έτσι, με αυτό τον έμμεσο τρόπο, η ινσουλίνη κατευθύνει τον ενδοκυττάριο
μεταβολικό μηχανισμό για να προκαλεί τα επιθυμητά αποτελέσματα.(Εικόνα 6)[α]

Εικόνα 6 Ενέργειες αλληλεπιδράσεων
ινσουλίνης και υποδοχέων ινσουλίνης στο επίπεδο IRS1 και ενεργοποίησης του καταρράκτη της
κινάσης που οδηγεί στις αλλαγμένες δραστηριότητες της φωσφορυλάσης του
γλυκογόνου και της συνθετάσης του γλυκογόνου.[γ]
Τα τελικά αποτελέσματα της επίδραση της ινσουλίνης είναι
ξεκάθαρα, και βασικά είναι τα ακόλουθα:
1. Σε
δευτερόλεπτο μετά τη σύνδεση της ινσουλίνης με τους υποδοχείς στην κυτταρική
μεμβράνη, οι μεμβράνες των μυϊκών κυττάρων, των λιποκυττάρων και πολλών άλλων
τύπων κυττάρων σε ολόκληρο το σώμα, που αποτελούν το 80% περίπου όλων των
κυττάρων του σώματος, καθίστανται σε πολύ μεγάλο βαθμό διαβατές προς τη
γλυκόζη. Αυτό ισχύει ιδιαίτερα για τα μυϊκά κύτταρα και τα κύτταρα του λιπώδους
ιστού, όχι όμως και για τις περισσότερες νευράδες στον εγκέφαλο. Το γεγονός
αυτό επιτρέπει την είσοδο γλυκόζης προς το εσωτερικό των κυττάρων. Μέσα στα
κύτταρα, η γλυκόζη υφίσταται άμεση φωσφορυλίωση και μετατρέπεται σε υπόστρωμα
για όλες τις συνήθεις μεταβολικές διεργασίες των υδατανθράκων, Η αυξημένη
μεταφορά της γλυκόζης προς το εσωτερικό των κυττάρων πιστεύεται ότι οφείλεται
σε σύντηξη πολλαπλών κυστιδίων με την κυτταρική μεμβράνη, ενώ αυτά τα κυστίδια
μεταφέρουν στην ίδια τη μεμβράνη τους πολλά μόρια μεταφορικής πρωτεΐνης
γλυκόζης, δηλαδή μιας πρωτεΐνης της κυτταρικής μεμβράνης με μοριακό βάρος
55.000 περίπου. Όταν ινσουλίνη δεν είναι πλέον διαθέσιμη, αυτά τα κυστίδια
αποχωρίζονται από τη μεμβράνη και μετακινούνται προς το εσωτερικό του κυττάρου,
για επαναχρησιμοποίηση οποτεδήποτε χρειαστούν.
2. Εκτός από την
αύξηση διαπερατότητας της κυτταρικής μεμβράνης για τη γλυκόζη, η κυτταρική
μεμβράνη καθίσταται επίσης περισσότερο διαβατή για πολλά από τα αμινοξέα, για
ιόντα καλίου και μαγνησίου, καθώς και για φωσφορικά ιόντα.
 [ω7]
[ω7]
3. Κατά τα
επόμενα 10 ως 15 λεπτά επιτελούνται άλλες βραδύτερες επιδράσεις για τη μεταβολή
του επιπέδου δραστηριότητας πολλών άλλων ενδοκυτταρικών ενζύμων που έχουν σχέση
με το μεταβολισμό. Οι επιδράσεις αυτές προκαλούνται κατά κύριο λόγο με μεταβολή
της κατάστασης φωσφορυλίωσης των ενζύμων.(Εικόνα 7)

Εικόνα 7 Μονοπάτια περιλαμβάνουν
την ρύθμηση της φωσφορυλάσης του γλυκογόνου από την ενεργοποίηση της επινεφρίνης
από a-αδρεναλινεργικούς
υποδοχείς. Δείτε το μεταβολισμό του γλυκογόνου για τις λεπτομέρειες της δράσης της
επινεφρίνης. PLC-g είναι
φωσφολιπάση C-g. Το υπόστρωμα για PLC-g είναι phosphatidylinositol-4,5- bisphosphate,
PIP2 και τα προϊόντα είναι
ιinositol trisphosphate,
IP3 και diacylglycerol, DAG. Παρόμοιες με
καλμοδουλίνη - μεσολαβημένες φωσφορυλιώσεις καθοδηγούν την παρεμπόδιση της
συνθάσης του γλυκογόνου. [γ]
4. Στη συνέχεια,
επιτελούνται και άλλες ακόμα βραδύτερες επιδράσεις για χρονικό διάστημα ωρών,
είτε ακόμα και λίγων ημερών. Αυτές οφείλονται σε μεταβολές του ρυθμού
μετάφρασης αγγελιοφόρων RΝΑ
από τα ριβοσώματα για το σχηματισμό νέων πρωτεϊνών, καθώς και ακόμα βραδύτερες:
επιδράσεις από μεταβολές του ρυθμού αντιγραφής DΝΑ στον πυρήνα των κυττάρων. Με αυτό τον
τρόπο η ινσουλίνη αναδιαμορφώνει μεγάλο μέρος από τον ενζυμικό κυτταρικό
μηχανισμό για να επιτύχει τους μεταβολικούς της στόχους.[α]

Εικόνα 8 Μονοπάτι της ινσουλίνης [ε]
Η επίδραση της ινσουλίνης
στο μεταβολισμό των υδατανθράκων
Αμέσως μετά από γεύμα με υψηλή περιεκτικότητα σε υδατάνθρακες, η
γλυκόζη που απορροφάται προς το αίμα προκαλεί ταχεία έκκριση ινσουλίνης. Η
ινσουλίνη με τη σειρά της προκαλεί ταχεία πρόσληψη, εναποθήκευση και
χρησιμοποίηση γλυκόζης από όλους σχεδόν τους ιστούς του σώματος, αλλά ιδιαίτερα
από τους μυς, το λιπώδη ιστό και το ήπαρ.[α]
Η επίδραση της ινσουλίνης
στην προαγωγή του μεταβολισμού γλυκόζης στους μυς
Κατά το μεγαλύτερο μέρος της ημέρας, ο μυϊκός ιστός δεν
εξαρτάται από τη γλυκόζη για την παροχή ενέργειας, αλλά από λιπαρά οξέα. Ο
κυριότερος λόγος γι' αυτό είναι ότι η κυτταρική μεμβράνη του μυϊκού κυττάρου,
που βρίσκεται σε κατάσταση ηρεμίας, εμφανίζει μικρή μόνο διαπερατότητα για τη
γλυκόζη, εκτός από την περίπτωση που η μυϊκή ίνα υφίσταται την επίδραση της ινσουλίνης.
Αλλά στα μεσοδιαστήματα μεταξύ των γευμάτων, το ποσό της ινσουλίνης που εκκρίνεται
είναι μικρό για να προκαλέσει σημαντική ενίσχυση του ποσού της γλυκόζης που
εισέρχεται στα μυϊκά κύτταρα.
Εντούτοις, υπό δύο διαφορετικές συνθήκες, οι μύες χρησιμοποιούν
πράγματι μεγάλα ποσά γλυκόζης. Η πρώτη περίπτωση είναι κατά τη διάρκεια μέτριας
ως και έντονης μυϊκής δραστηριότητας. Για αυτή τη χρησιμοποίηση της γλυκόζης
δεν απαιτούνται μεγάλα ποσά ινσουλίνης γιατί οι μυϊκές ίνες που λειτουργούν,
καθίστανται εξαιρετικά διαπερατές για τη γλυκόζη, ακόμα και όταν δεν υπάρχει
ινσουλίνη, εξαιτίας της διεργασίας της ίδιας της συστολής τους.
Η δεύτερη περίπτωση για τη χρησιμοποίηση από τους μυς μεγάλου
ποσού γλυκόζης είναι για λίγες ώρες μετά το γεύμα. Κατά το χρονικό αυτό
διάστημα η συγκέντρωση της γλυκόζης στο αίμα είναι υψηλή. Επίσης, το πάγκρεας
εκκρίνει μεγάλα ποσά ινσουλίνης, και η επιπρόσθετη αυτή ινσουλίνη προκαλεί
ταχεία μεταφορά γλυκόζης στα μυϊκό κύτταρα. Αυτό εξαναγκάζει τα μυϊκά κύτταρα,
κατά το χρονικό αυτό διάστημα, να χρησιμοποιούν γλυκόζη, κατά προτίμηση έναντι
λιπαρών οξέων.[α]
 [ω7]
[ω7]
Εναπόθεση γλυκογόνου
στους μύες. Εάν οι μύες δεν λειτουργούν κατά το χρονικό διάστημα που
ακολουθεί το γεύμα, ενώ η γλυκόζη μεταφέρεται προς το εσωτερικό των μυϊκών ινών
σε μεγάλα ποσά, τότε το μεγαλύτερο μέρος από αυτή τη γλυκόζη, αντί να
χρησιμοποιείται για την άμεση απόδοση ενέργειας, μετατρέπεται και εναποτίθεται
στις μυϊκές ίνες με τη μορφή γλυκογόνου, μέχρι το όριο συγκέντρωσης 2 ως 3%. Το
γλυκογόνο αυτό μπορεί να χρησιμοποιείται αργότερα για να παρέχει ενέργεια στο
μυ. Πράγματι, αυτό είναι ιδιαίτερα χρήσιμο, για μικρά χρονικά διαστήματα
εξαιρετικά έντονης χρησιμοποίησης ενέργειας από του; μυς, καθώς επίσης και για
την παροχή αναερόβιας ενέργειας για χρονικά διαστήματα λίγων μόνο λεπτών κάβε
φορά, με γλυκολυτική διάσταση του γλυκογόνου προς γαλακτικό οξύ. που μπορεί να
γίνεται και χωρίς την παρουσία οξυγόνου.(Εικόνα 9)

Εικόνα 9 Ινσουλίνη-ινσουλίνη
δράσεις υποδοχέων στην ομοιόσταση του γλυκογόνου παρουσιάζουν το ρόλο της
πρωτεϊνης που στοχεύει στο γλυκογόνο, PTG σε σύμπλεξη με πολλά ένζυμα και
υποστρώματα από κοινού. Επίσης είναι απόκριση της ινσουλίνης στο επίπεδο
μεταφοράς γλυκόζης στα κύτταρα μέσω GLUT4 δυνατότητας διακίνησης στην πλασματική μεμβράνη. GS/GP κινάση = συνθάση
γλυκογόνου: γλυκογόνου φωσφορυλάση κινάση. PPI = πρωτεϊνικός ανασταλτικός παράγοντας φωσφατάσεων. Τα βέλη
δείχνουν είτε την κατεύθυνση της ροής είτε τα θετικά αποτελέσματα, T γραμμές
αντιπροσωπεύουν τα ανασταλτικά αποτελέσματα. [γ]
Βαθμός διευκόλυνσης
μεταφοράς γλυκόζης μέσα από την κυτταρική μεμβράνη μυϊκού κυττάρου από την ινσουλίνη.
Ο βαθμός κατά τον οποίο η ινσουλίνη διευκολύνει τη μεταφορά γλυκόζης μέσα από
την κυτταρική μεμβράνη του μυϊκού κυττάρου καταφαίνεται από πειραματικά
αποτελέσματα. (Εικόνα 10). Η κάτω καμπύλη με την ένδειξη "μάρτυρες,"
παριστάνει τη συγκέντρωση ελεύθερης γλυκόζης, όπως μετράται μέσα στο κύτταρο,
από την οποία προκύπτει ότι η συγκέντρωση γλυκόζης παραμένει σταθερή σχεδόν ακριβώς
σε επίπεδο μηδέν, παρά την αυξημένη εξωκυττάρια συγκέντρωση γλυκόζης, η οποία
φθάνει μέχρι και σε 750 mg/dl,, Αντίθετα, με την καμπύλη
με την ένδειξη "ινσουλίνη," αποδεικνύεται ότι η ενδοκυττάρια
συγκέντρωση της γλυκόζης αυξάνεται μέχρι και οε 400 mg/dl, μετά προσθήκη ινσουλίνης. Από αυτό, καθίσταται εμφανές ότι η
ινσουλίνη μπορεί να αυξάνει τον ρυθμό μεταφοράς της γλυκόζης προς το εσωτερικό
του μυϊκού κυττάρου που βρίσκεται σε κατάσταση ηρεμίας, τουλάχιστο κατά 15
φορές.[α]

Εικόνα 10 [α]
Η επίδραση της ινσουλίνης στην προαγωγή πρόσληψης, αποθήκευσης και
χρησιμοποίησης της γλυκόζης από το ήπαρ
Μία από τις σημαντικότερες επιδράσεις της ινσουλίνης είναι η
προαγωγή της εναποθήκευσης του μεγαλυτέρου μέρους της γλυκόζης που απορροφάται
από το έντερο μετά από γεύμα σχεδόν αμέσως μέσα στο ήπαρ με τη μορφή του γλυκογόνου.
Στη συνέχεια, στα μεταξύ των γευμάτων χρονικά διαστήματα, όταν δεν υπάρχει
διαθέσιμη τροφή, και η συγκέντρωση γλυκόζης στο αίμα αρχίζει να ελαττώνεται,
γλυκογόνο του ήπατος αρχίζει να διασπάται προ; γλυκόζη, που αποδίδεται προ; το
αίμα για τη διατήρηση της συγκέντρωσης της γλυκόζης σε ικανοποιητικό επίπεδο.
Ο μηχανισμός με τον οποίο η ινσουλίνη επιτυγχάνει την πρόσληψη
και εναποθήκευση της γλυκόζης από το ήπαρ περιλαμβάνει διάφορες, σχεδόν ταυτόχρονες
βαθμίδες:
1. Η ινσουλίνη
αναστέλλει τη φωσφορυλάση του ήπατος, δηλαδή το ένζυμο που προκαλεί διάσπαση
γλυκογόνου του ήπατος σε γλυκόζη. Με αυτό τον τρόπο προφανώς εμποδίζεται η διάσπαση
του γλυκογόνου που ήδη βρίσκεται στα ηπατικά κύτταρα.
2. Η ινσουλίνη ενισχύει
την πρόσληψη γλυκόζης από το αίμα προς τα ηπατικά κύτταρα. Αυτό το επιτυγχάνει
με την αύξηση της δραστηριότητας τον ενζύμου γλυκοκινάση. που είναι το ένζυμο
που προκαλεί την αρχική φωσφορυλίωση της γλυκόζης μετά τη διάχυσή της στο ηπατικό
κύτταρο. Μετά τη φωσφορυλίωσή της, η γλυκόζη εγκλωβίζεται πρόσκαιρα μέσα στα
ηπατικά κύτταρα, γιατί η φωσφορυλιωμένη γλυκόζη δεν μπορεί να διαχέεται πίσω,
μέσα από την κυτταρική μεμβράνη προς το αίμα.
3. Η ινσουλίνη
αυξάνει επίσης τη δραστηριότητα των ενζύμων τα οποία προάγουν τη σύνθεση
γλυκογόνου.
Το καθαρό αποτέλεσμα όλων αυτών των επιδράσεων συνίσταται σε
αύξηση του γλυκογόνου του ήπατος. Το γλυκογόνο μπορεί να αυξάνεται τελικά μέχρι
ποσοστό 5 ως 6% της ολικής μάζας του ήπατος, ποσό που αντιστοιχεί σε σχεδόν
Απόδοση γλυκόζης από το
ήπαρ στα μεταξύ των γευμάτων χρονικά διαστήματα. Μετά το τέλος του γεύματος
και την έναρξη ελάττωσης του επιπέδου γλυκόζης του αίματος σε χαμηλότερο
επίπεδο, διάφορα γεγονότα συμβάλλουν για την απόδοση γλυκόζης από το ήπαρ προς
το αίμα:
Η ελάττωση της συγκέντρωσης γλυκόζης στο αίμα συνεπάγεται
ελάττωση και της έκκρισης ινσουλίνης από το πάγκρεας.
Στη συνέχεια, η έλλειψη ινσουλίνης αναστρέφει όλες τις
επιδράσεις που αναφέρονται παραπάνω για την εναποθήκευση γλυκογόνου, και
ουσιαστικά σταματά η περαιτέρω σύνθεση γλυκογόνου στο ήπαρ και παρακωλύεται η
περαιτέρω πρόσληψη γλυκόζης του αίματος από το ήπαρ.
Η έλλειψη ινσουλίνης (παράλληλα με την αύξηση της γλυκαγόνης
συνεπάγεται ενεργοποίηση του ένζυμου φωσφορυλάση, το οποίο διασπά το γλυκογόνο
σε φωσφορική γλυκόζη.
Το ένζυμο φωσφατάση της
γλυκόζης, που είχε ανασταλεί από την ινσουλίνη, ενεργοποιείται τώρα με την έλλειψη
ινσουλίνης, και προκαλεί απομάκρυνση της φωσφορικής ρίζας από τη γλυκόζη. Με
αυτό τον τρόπο επιτρέπεται στην ελεύθερη γλυκόζη να διαχέεται, πίσω προς το
αίμα.
Έτσι, το ήπαρ αφαιρεί γλυκόζη από το αίμα όταν η γλυκόζη στο
αίμα βρίσκεται σε περίσσεια μετά το γεύμα, και την αποδίδει πίσω στο αίμα όταν
χρειάζεται στα μεταξύ των γευμάτων χρονικά διαστήματα. Ποσοστό 60% περίπου από
τη γλυκόζη που προσλαμβάνεται με το γεύμα αποθηκεύεται με αυτό τον τρόπο στο
ήπαρ, και αποδίδεται αργότερα προς το αίμα.
 [ω7]
[ω7]
Άλλες επιδράσεις της
ινσουλίνης στο μεταβολισμό των υδατανθράκων στο ήπαρ. Όταν η ποσότητα της
γλυκόζης που εισέρχεται στα ηπατικά κύτταρα είναι μεγαλύτερη από αυτή που
μπορεί να αποθηκεύεται με τη μορφή γλυκογόνου, η ινσουλίνη προάγει τη μετατροπή
όλης αυτής της περίσσειας της γλυκόζης σε λιπαρά οξέα. Τα λιπαρά αυτά οξέα στη
συνέχεια "δεματοποιούνται" με τη μορφή τριγλυκεριδίων σε λιποπρωτεϊνες
πολύ χαμηλής πυκνότητας και μεταφέρονται στο λιπώδη ιστό και αποθηκεύονται με
τη μορφή του λίπους.
 [ω7]
[ω7]
Η ινσουλίνη επίσης αναστέλλει τη γλυκονεογένεση. Αυτό το
επιτυγχάνει κυρίως με την ελάττωση του ποσού και της δραστηριότητας ενζύμων του
ήπατος που απαιτούνται για τη γλυκονεογένεση.[α]
Απουσία επίδρασης της
ινσουλίνης στην πρόσληψη και χρησιμοποίηση γλυκόζης από τον εγκέφαλο
Ο εγκέφαλος διαφέρει ριζικά από τους περισσότερους άλλους ιστούς
του σώματος κατά το ότι η ινσουλίνη δεν έχει καμία, ή ελάχιστη μόνο, επίδραση
όσον αφορά την πρόσληψη ή τη χρησιμοποίηση γλυκόζης. Πράγματι, τα εγκεφαλικά
κύτταρα είναι διαπερατά για τη γλυκόζη χωρίς τη μεσολάβηση της ινσουλίνης.
Τα εγκεφαλικά κύτταρα διαφέρουν επίσης από τα περισσότερα άλλα
κύτταρα του σώματος κατά το ότι, φυσιολογικά χρησιμοποιούν μόνο γλυκόζη για την
παροχή ενέργειας, μπορούν δε να χρησιμοποιούν άλλα υποστρώματα για την απόληψη
ενέργειας μόνο με δυσκολία. Γι' αυτό, είναι απαραίτητο όπως το επίπεδο της
γλυκόζης στο αίμα διατηρείται πάντοτε πάνω από ένα ορισμένο κρίσιμο επίπεδο,
γεγονός που αποτελεί μια από τις σημαντικότερες λειτουργίες του συστήματος
ρύθμισης της γλυκόζης του αίματος. Όταν η γλυκόζη του αίματος ελαττώνεται σε
πολύ χαμηλά επίπεδα, στα πλαίσια των 20 ως 50 mg/dl, εμφανίζονται τα συμπτώματα της υπογλυκαιμικής καταπληξίας, η
οποία χαρακτηρίζεται από προοδευτική νευρική υπερευαισθησία, που οδηγεί σε
λιποθυμία, σπασμούς, τελικά δε ακόμα και σε κώμα.[α]
Επίδραση της ινσουλίνης στο
μεταβολισμό των υδατανθράκων σε αλλά κύτταρο
Η ινσουλίνη αυξάνει τη μεταφορά γλυκόζης στα περισσότερα άλλα
κύτταρα του σώματος, καθώς και τη χρησιμοποίηση της από αυτά (με εξαίρεση τα
ηπατικά και εγκεφαλικά κύτταρα), με τον ίδιο τρόπο που επιδρά στη μεταφορά και
χρησιμοποίηση γλυκόζης στα μυϊκά κύτταρα. Η μεταφορά της γλυκόζης μέσα στα
λιποκύτταρα είναι απαραίτητη για την παροχή της γλυκερόλης για τον σχηματισμό
των μορίων του λίπους για την εναπόθεση του μέσα σ' αυτά τα κύτταρα. Κατά
συνέπεια, με αυτό τον έμμεσο τρόπο, η ινσουλίνη προάγει την εναπόθεση λίπους σ'
αυτά τα κύτταρα.[α]
Επίδραση της ινσουλίνης στο
μεταβολισμό του λίπους
Μολονότι όχι και τόσο εμφανείς όπως είναι οι επιδράσεις της
ινσουλίνης στο μεταβολισμό των υδατανθράκων, η ινσουλίνη εξασκεί επιδράσεις και
στο μεταβολισμό του λίπους με τρόπους που, μακροπρόθεσμα, είναι εξίσου
σημαντικοί. Ιδιαίτερα σημαντική είναι η μακροπρόθεσμη επίδραση της έλλειψης
ινσουλίνης στην πρόκληση βαριάς αθηροσκλήρωσης, που συχνά οδηγεί σε καρδιακές
προσβολές, αγγειακά εγκεφαλικά επεισόδια και άλλα "αγγειακά"
ατυχήματα.[α]
Επίδραση περίσσειας ινσουλίνης
στη σύνθεση και αποθήκευση λίπους
Η ινσουλίνη εξασκεί διάφορες επιδράσεις που οδηγούν σε
αποθήκευση λίπους στο λιπώδη ιστό. Πρώτο, η ινσουλίνη αυξάνει τη χρησιμοποίηση
γλυκόζης από τους περισσότερους ιστούς του σώματος, γεγονός που αυτόματα
περιορίζει τη χρησιμοποίηση του λίπους, και με αυτό τον τρόπο πραγματοποιείται
μια "εξοικονόμηση λίπους." Εντούτοις, η ινσουλίνη προάγει επίσης τη
σύνθεση λιπαρών οξέων. Αυτό συμβαίνει ιδιαίτερα όταν οι υδατάνθρακες που προσλαμβάνονται
δεν μπορούν να χρησιμοποιούνται άμεσα για παροχή ενέργειας, με αποτέλεσμα να
παρέχουν υπόστρωμα για σύνθεση λίπους. Σχεδόν στο σύνολο της, αυτή η σύνθεση επιτελείται
στα ηπατικά κύτταρα, και στη συνέχεια τα λιπαρά οξέα μεταφέρονται, με λιποπρωτεΐνες
στα λιποκύτταρα για εναποθήκευση.
Αποθήκευση λίπους σε λιποκύτταρα.
Η ινσουλίνη εξασκεί επίσης δύο άλλες απαραίτητες επιδράσεις, οι οποίες
απαιτούνται για την αποθήκευση του λίπους σε λιποκύτταρα:
Η ινσουλίνη αναστέλλει την ενέργεια της ορμονοευαίσθητης
λιπάσης. Αυτό είναι το ένζυμο που προκαλεί υδρολυτική διάσπαση τριγλυκεριδίων
που βρίσκονται ήδη αποθηκευμένα στα λιποκύτταρα. Κατά συνέπεια, η απόδοση λιπαρών
οξέων προς το αίμα αναστέλλεται.
Η ινσουλίνη προάγει τη μεταφορά γλυκόζης μέσα από τη κυτταρική
μεμβράνη προς τα λιποκύτταρα, με τον ίδιο ακριβώς τρόπο με τον οποίο προάγει
και τη μεταφορά γλυκόζης στα μυϊκά κύτταρα. Στη συνέχεια, μέρος από αυτή τη γλυκόζη
χρησιμοποιείται για σύνθεση μικρού ποσού λιπαρών οξέων. Το σημαντικότερο όμως
είναι ότι σχηματίζει επίσης και μεγάλα ποσά αγλυκεροφωσφορικού οξέος, Αυτή η
ουσία παρέχει γλυκερόλη, η οποία συνδέεται με λιπαρά οξέα για το σχηματισμό των
τριγλυκεριδίων, τα οποία αποτελούν τη μορφή με την οποία το λίπος εναποτίθεται
στα λιποκύτταρα. Κατά συνέπεια, όταν ινσουλίνη δεν είναι διαθέσιμη, ακόμα και η
αποθήκευση τον μεγάλου ποσού λιπαρών οξέων, τα οποία μεταφέρονται με τις
λιποπρωτείνες από το ήπαρ αποκλείεται σχεδόν πλήρως.[α]
Αυξημένη χρησιμοποίηση λίπους
για το μεταβολισμό, που προκαλείται από έλλειψη ινσουλίνης
Όλες οι διεργασίες που αφορούν διάσπαση λίπους και χρησιμοποίηση
του για παροχή ενέργειας ενισχύονται σε μεγάλο βαθμό από την απουσία
ινσουλίνης. Αυτό το φαινόμενο παρατηρείται ακόμα και φυσιολογικά, στα μεταξύ
των γευμάτων χρονικά διαστήματα, όταν η έκκριση ινσουλίνης βρίσκεται στο χαμηλότερο
της επίπεδο, φθάνει όμως στο αποκορύφωμα του στο σακχαρώδη διαβήτη, κατά τον
οποίο η έκκριση ινσουλίνης είναι σχεδόν μηδενική. Τα αποτελέσματα είναι τα ακόλουθα:
Η λιπόλυση λίπους των
λιπαποθηκών και απόδοση ελεύθερων λιπαρών οξέων σε έλλειψη ινσουλίνης. Σε
απουσία ινσουλίνης, όλες οι επιδράσεις της ινσουλίνης που αναφέρονται,
παραπάνω, όσον αφορά την εναποθήκευση λίπους αναστρέφονται. Η σημαντικότερη
επίδραση είναι η μεγάλη ενεργοποίηση του ένζυμου ορμονοευαίσθητη λιπάση, που
βρίσκεται στα λιποκύτταρα. Με αυτό το ένζυμο, προκαλείται υδρολυτική διάσπαση
αποθηκευμένων τριγλυκεριδίων, με αποτέλεσμα την απελευθέρωση μεγάλου ποσού
ελεύθερων λιπαρών οξέων και γλυκερόλης προς το αίμα. Κατά συνέπεια, η συγκέντρωση
ελευθέρων λιπαρών οξέων στο πλάσμα αρχίζει να αυξάνεται σε λίγα μόνο λεπτά. Και
αυτά τα λιπαρά οξέα αποτελούν σ' αυτή την περίπτωση το κύριο υπόστρωμα για την
παροχή ενέργειας, ουσιαστικά για όλους τους ιστούς του σώματος, εκτός από τον
εγκέφαλο. Στην Εικόνα 11 απεικονίζεται η επίδραση έλλειψης ινσουλίνης στη
συγκέντρωση ελεύθερων λιπαρών οξέων, γλυκόζης και ακετοξεικού οξέος στο πλάσμα.
Σημειώνεται ότι αμέσως μετά την αφαίρεση του παγκρέατος, η συγκέντρωση
ελεύθερων λιπαρών οξέων στο πλάσμα αρχίζει να αυξάνεται, αυτή δε η αύξηση είναι
σημαντικά ταχύτερη ακόμα και από την αύξηση της συγκέντρωσης γλυκόζης.

Εικόνα 11 [α]
Επίδραση της έλλειψης
ινσουλίνης στη συγκέντρωση χοληστερόλης και φωσφολιπιδίων του πλάσματος. Η
περίσσεια λιπαρών οξέων στο πλάσμα προάγει επίσης τη μετατροπή από το ήπαρ
ορισμένου ποσού από τα ελευθέρα λιπαρά οξέα σε φωσφολιπίδια και χοληστερόλη,
ουσίες που αποτελούν δύο κύρια προϊόντα μεταβολισμού του λίπους. Οι δύο αυτές
ουσίες, μαζί με περίσσεια τριγλυκεριδίων που σχηματίζονται συγχρόνως στο ήπαρ,
αποδίδονται, στο αίμα με τις λιποπρωτεΐνες. Σε μερικές περιπτώσεις, οι
λιποπρωτεΐνες του πλάσματος αυξάνονται μέχρι και το τριπλάσιο όταν ελλείπει η
ινσουλίνη, με αποτέλεσμα η ολική συγκέντρωση των λιπιδίων του πλάσματος να
μετρείται σε αρκετές μονάδες επί τοις εκατό μάλλον αντί της φυσιολογικής της
τιμής των 0,6%. Αυτή η υψηλή συγκέντρωση λιπιδίων - και ιδιαίτερα η υψηλή
συγκέντρωση της χοληστερόλης - οδηγεί σε ταχεία ανάπτυξη αθηροσκλήρωσης σε
άτομα με βαρύ σακχαρώδη διαβήτη.
Η έλλειψη ινσουλίνης
προκαλεί οξέωση. Η έλλειψη ινσουλίνης συνεπάγεται επίσης και την παραγωγή
από τα ηπατοκύτταρα υπέρμετρου ποσού ακετοξεικού οξέος. Επομένως, από το ήπαρ
αποδίδεται τόσο πολύ ακετοξεικό οξύ, ώστε να μη μπορεί όλο να μεταβολίζεται από
τους ιστούς. Γι' αυτό, η συγκέντρωση του αυξάνεται κατά τις ημέρες που
ακολουθούν την παύση της έκκρισης ινσουλίνης, σε μερικές δε περιπτώσεις φθάνει
σε συγκεντρώσεις ως και 10 mEq/λίτρο
ή και περισσότερο. Σε βαρύ σακχαρώδη διαβήτη, το ακετοξεικό είναι δυνατό να
προκαλέσει βαριά οξέωση και κώμα, το οποίο συχνά οδηγεί σε θάνατο.[α]
Επίδραση ινσουλίνης στο
μεταβολισμό των πρωτεϊνών και την αύξηση του σώματος
Η επίδραση της ινσουλίνης στη σύνθεση και εναπόθεση πρωτεϊνών.
Κατά τη διάρκεια λίγων ωρών μετά από γεύμα, όταν στο αίμα τα θρεπτικά στοιχεία
διατίθενται σε περίσσεια, στους ιστούς δεν αποθηκεύονται μόνο υδατάνθρακες και
λίπη αλλά και πρωτεΐνες, γι' αυτή δε τη διεργασία απαιτείται και η παρουσία
ινσουλίνης. Ο τρόπος με τον οποίο η ινσουλίνη προκαλεί εναποθήκευση πρωτεϊνών
δεν κατανοείται τόσο καλά όσο οι μηχανισμοί για την εναποθήκευση γλυκόζης και
λιπών. Ορισμένα από τα διαπιστωμένα γεγονότα είναι τα ακόλουθα:
1. Η ινσουλίνη προκαλεί
ενεργητική μεταφορά πολλών αμινοξέων προς το εσωτερικό των κυττάρων. Έτσι, η
ινσουλίνη διαθέτει την ίδια ικανότητα με την αυξητική ορμόνη σε ότι αφορά την
αύξηση πρόσληψης αμινοξέων από τα κύτταρα.
2. Η ινσουλίνη εξασκεί
άμεση επίδραση στα ριβοσώματα και αυξάνει τη μετάφραση τον αγγελιοφόρου RΝΑ. και με αυτό τον τρόπο
συμβάλλει στην παραγωγή νέων πρωτεϊνών. Με κάποιο ανεξήγητο τρόπο που δεν έχει
διευκρινισθεί, η ινσουλίνη "θέτει σε κίνηση "το μηχανισμό των
ριβοσωμάτων.
3. Μακροπρόθεσμα,
η ινσουλίνη αυξάνει επίσης το ρυθμό της μεταγραφής επιλεγμένων τμημάτων DΝΑ στον πυρήνα του κυττάρου,
και με αυτό τον τρόπο αυξάνει την παραγωγή RΝΑ, με αποτέλεσμα την ακόμα μεγαλύτερη σύνθεση πρωτεϊνών,
ιδιαίτερα δε προάγει τη σύνθεση μεγάλης σειράς από ένζυμα, που χρειάζονται για
την αποθήκευση υδατανθράκων, λιπών και πρωτεϊνών.
4. Η ινσουλίνη
επίσης αναστέλλει τον καταβολισμό πρωτεϊνών, με αποτέλεσμα την ελάττωση του
ρυθμού απόδοσης αμινοξέων από τα κύτταρα, και ιδιαίτερα από τα μυϊκά κύτταρα.
Περιληπτικά, η ινσουλίνη από τη μια μεριά προάγει την παραγωγή
πρωτεϊνών, και από την άλλη μεριά καταστέλλει τη διάσπαση πρωτεϊνών.
Η επίδραση της ινσουλίνης
στην αύξηση του σώματος - Συνεργική επίδραση της με την αυξητική ορμόνη.
Επειδή η ινσουλίνη χρειάζεται για τη σύνθεση πρωτεϊνών, η παρουσία της είναι
εξίσου απαραίτητη για την αύξηση του σώματος όπως και της αυξητικής ορμόνης. Επιπρόσθετα,
με τη χορήγηση αυξητικής ορμόνης είτε ινσουλίνης, σε διάφορο χρόνο την καθεμιά,
δεν επιτυγχάνεται σχεδόν καθόλου αύξηση του σώματος. Αντίθετα, με την
ταυτόχρονη χορήγηση των δύο αυτών ορμονών επιτυγχάνεται θεαματική αύξηση του σώματος.
Με αυτό τον τρόπο καταδεικνύεται ότι οι δύο αυτές ορμόνες συνεργάζονται για την
προαγωγή της αύξησης του σώματος, και η καθεμιά τους επιτελεί ειδική
λειτουργία, που διαφέρει από τη λειτουργία της άλλης. Είναι πιθανό αυτή η
ανάγκη για την παρουσία και των δύο αυτών ορμονών να οφείλεται στο γεγονός ότι
η καθεμιά τους προάγει την είσοδο προς τα κύτταρα διαφορετικής ομάδας από αμινοξέα,
για δε την αύξηση του σώματος απαιτείται η παρουσία και των δυο αυτών ομάδων
αμινοξέων.[α]
Ρύθμιση της έκκρισης
ινσουλίνης
Διέγερση της έκκρισης
ινσουλίνης από τη γλυκόζη του αίματος
Κατά το φυσιολογικό επίπεδο της γλυκόζης του αίματος σε
κατάσταση νηστείας, των 80 ως 90 -, ο ρυθμός έκκρισης ινσουλίνης είναι
ελάχιστος, γύρω στα 25 ng/min/kg σωματικού
βάρους. Εάν η συγκέντρωση της γλυκόζης του αίματος αυξηθεί αιφνίδια σε επίπεδο
2 ως 3 φόρε; πάνω από το φυσιολογικό, και στη συνέχεια διατηρείται σ' αυτό το
υψηλό επίπεδο, η έκκριση ινσουλίνης αυξάνεται σημαντικά σε δύο φάσεις. όπως
φαίνεται από τις μεταβολές της συγκέντρωση; ινσουλίνης στο πλάσμα.
1. Η συγκέντρωση
ινσουλίνης στο πλάσμα αυξάνεται σχεδόν στο 10 πλάσιο σε 3 ως 5 λεπτά μετά από οξεία
αύξηση της γλυκόζης αίματος. Αυτό οφείλεται σε άμεση απόδοση προσχηματισμένης
ινσουλίνης από τα βήτα κύτταρα των νησιδίων του Langerhans. Εντούτοις, ο αρχικός αυτός
υψηλός ρυθμός της έκκρισης δεν διατηρείται. Πράγματι, η συγκέντρωση της
ινσουλίνης ελαττώνεται κατά το μισό περίπου της αρχικής αύξησης στα προσεχή 5
ως 10 λεπτά.
2, Μετά την
πάροδο 15 περίπου λεπτών, η έκκριση ινσουλίνης εμφανίζει δεύτερη έξαρση, και
φθάνει σε νέο επίπεδο σε 2 ως 3 ώρες. Ο ρυθμός έκκρισης σ’ αυτή τη φάση συνήθως
είναι μεγαλύτερος από εκείνο της αρχικής φάσης. Η δεύτερη αυτή φάση έκκρισης
οφείλεται τόσο σε επιπρόσθετη απόδοση προσχηματισμένης ινσουλίνης, όσο και σε
ενεργοποίηση του ενζυμικού συστήματος με το οποίο συντίθεται και απελευθερώνεται
νέα ινσουλίνη από τα βήτα κύτταρα.
Ανατροφοδοτική σχέση μεταξύ συγκέντρωσης γλυκόζης στο αίμα και
ρυθμού έκκρισης ινσουλίνης. Κατά την αύξηση της συγκέντρωσης της γλυκόζης
αίματος πάνω από 100 mg/dl, αίματος, ο ρυθμός έκκρισης
ινσουλίνης αυξάνεται με ταχύ ρυθμό, και φθάνει σε επίπεδο 10 ως 25 φορές
υψηλότερο από το βασικό, όταν η συγκέντρωση της γλυκόζης στο αίμα φθάνει σε 400
και 600 mg/dl, αίματος. Έτσι, η αύξηση
της έκκρισης ινσουλίνης με ερέθισμα τη γλυκόζη είναι θεαματική, όσον αφορά τόσο
την ταχύτητα όσο και τα εκπληκτικά υψηλό επίπεδο στο οποίο φθάνει. Επιπρόσθετα,
η διακοπή της έκκρισης ινσουλίνης είναι σχεδόν εξίσου απότομη, και επέρχεται σε
λίγα λεπτά μετά την αποκατάσταση της συγκέντρωσης της γλυκόζης του αίματος σε
επίπεδο νηστείας. Αυτή η ανταπόκριση της έκκρισης ινσουλίνης προς την αυξημένη
συγκέντρωση της γλυκόζης του αίματος παρέχει ένα εξαιρετικά σημαντικό
ανατροφοδοτικό μηχανισμό για τη ρύθμιση της συγκέντρωσης της γλυκόζης του
αίματος. Δηλαδή, η οποιαδήποτε αύξηση της γλυκόζης του αίματος συνεπάγεται
αύξηση της έκκρισης ινσουλίνης, και η ινσουλίνη με τη σειρά της προκαλεί
μεταφορά γλυκόζης προς το ήπαρ, τους μυς και άλλα κύτταρα, και με αυτό τον
τρόπο η συγκέντρωση της γλυκόζης του αίματος επαναφέρεται προς τη φυσιολογική
της τιμή.[α]
Διέγερση της έκκρισης
ινσουλίνης από μερικά αμινοξέα
Εκτός από την περίσσεια γλυκόζης, η οποία διεγείρει την έκκριση
ινσουλίνης, πολλά αμινοξέα εξασκούν την ίδια επίδραση. Τα πλέον δραστικά είναι
η αργινίνη και λυσίνη. Η διέγερση της έκκρισης ινσουλίνης από αμινοξέα φαίνεται
ότι αποτελεί σκόπιμη απάντηση, γιατί με τη σειρά της η ινσουλίνη προάγει τη
μεταφορά αμινοξέων προς τα κύτταρα των ιστών, καθώς και τη σύνθεση πρωτεϊνών
μέσα σ' αυτά τα κύτταρα. Δηλαδή, η ινσουλίνη είναι σημαντική για την κατάλληλη
χρησιμοποίηση της περίσσειας των αμινοξέων με τον ίδιο τρόπο που είναι
σημαντική για τη χρησιμοποίηση των υδατανθράκων.[α]
Ο ρόλος της ινσουλίνης στην
εναλλαγή του μεταβολισμού μεταξύ υδατανθράκων και λιπιδίων
Από την προηγούμενη συζήτηση κατέστη ήδη σαφές ότι η ινσουλίνη
προάγει τη χρησιμοποίηση των υδατανθράκων για απόδοση ενέργειας, ενώ καταστέλλει
τη χρησιμοποίηση των λιπών γι' αυτό το σκοπό. Αντίθετα, η έλλειψη ινσουλίνης
προκαλεί τη χρησιμοποίηση, κατά κύριο λόγο των λιπών, και τον αποκλεισμό των
υδατανθράκων για την παροχή ενέργειας, εκτός από τον εγκεφαλικό ιστό.
Επιπρόσθετα, το σήμα με το οποίο ελέγχεται αυτός ο μηχανισμός εναλλαγής
συνίσταται, κατά κύριο λόγο, στη συγκέντρωση της γλυκόζης στο αίμα. Όταν η συγκέντρωση
γλυκόζης είναι χαμηλή, η έκκριση ινσουλίνης καταστέλλεται, και το λίπος χρησιμοποιείται
σχεδόν αποκλειστικά για παροχή ενέργειας σε ολόκληρο το σώμα, εκτός από τον
Εγκέφαλο. Όταν η συγκέντρωση της γλυκόζης είναι υψηλή, η έκκριση ινσουλίνης
διεγείρεται, και χρησιμοποιούνται υδατάνθρακες αντί του λίπους, η δε περίσσεια
της γλυκόζης του αίματος εναποθηκεύεται με τη μορφή γλυκογόνου ατό ήπαρ και
μυς. Γι' αυτό, ένας από τους πλέον σημαντικούς ρόλους της ινσουλίνης στο σώμα
είναι ο έλεγχος για το ποια από τις δυο αυτές θρεπτικές ουσίες θα
χρησιμοποιείται από στιγμή σε στιγμή από τα κύτταρα για την παροχή ενέργειας.[α]
O διαβήτης είναι μία από τις παλαιότερα γνωστές ασθένειες του
ανθρώπου. Η πλήρης ονομασία του - σακχαρώδης διαβήτης - προέρχεται από τις
λέξεις σάκχαρο και διαβήτης (σιφόνι) και περιγράφει το πλέον εμφανές σύμπτωμα
του μη ελεγχόμενου διαβήτη - την αποβολή μεγάλης ποσότητας ούρων που είναι
«γλυκά» διότι περιέχουν σάκχαρο (γλυκόζη). Υπάρχουν περιγραφές των συμπτωμάτων
από τους αρχαίους Πέρσες, Ινδούς και Αιγυπτίους, αλλά η ουσιαστική κατανόηση
της κατάστασης επετεύχθη τα τελευταία εκατό περίπου χρόνια. Το δεύτερο μισό του
19ου αιώνα, δύο Γερμανοί γιατροί κατέληξαν στο συμπέρασμα ότι το πάγκρεας -
ένας μεγάλος αδένας πίσω από το στομάχι - πρέπει να παράγει κάποια ουσία που
σταματά την αύξηση των επιπέδων σακχάρου στο αίμα. Το 1921, τρεις Καναδοί επιστήμονες
απομόνωσαν τη μυστηριώδη ουσία, την οποία ονόμασαν ινσουλίνη, από μικρές ομάδες
κυττάρων μέσα στο πάγκρεας, που ονομάζονται νησίδια του Λάνγκερχανς. Όταν η
ινσουλίνη άρχισε να διατίθεται ως αγωγή για τον διαβήτη, μετά το 1922,
αντιμετωπίστηκε ως ιατρικό θαύμα, μεταβάλλοντας τις μελλοντικές προοπτικές των
πασχόντων και σώζοντας τις ζωές πολλών νέων ανθρώπων, που ειδάλλως θα είχαν
πεθάνει έπειτα από μία επώδυνη, εξαντλητική ασθένεια. Τριάντα περίπου χρόνια
αργότερα, διαπιστώθηκε ότι μία μορφή διαβήτη μπορεί να αντιμετωπιστεί με δισκία
που μειώνουν τα επίπεδα του σακχάρου στο αίμα. Αυτή η νέα εξέλιξη οδήγησε τους
γιατρούς να διακρίνουν δύο μορφές διαβήτη:
Ινσουλινοεξαρτώμενος
διαβήτης. Αυτός ο τύπος διαβήτη, που ονομάζεται επίσης τύπου 1 διαβήτης,
παρουσιάζεται συνήθως σε νεαρότερους ασθενείς, οι οποίοι πρέπει να κάνουν
τακτικά ενέσεις ινσουλίνης προκειμένου να παραμείνουν υγιείς.
Μη ινσουλινοεξαρτώμενος
διαβήτης. Αυτή η μορφή διαβήτη, που ονομάζεται και τύπου 2 διαβήτης,
σχετίζεται με την ηλικία ή εκδηλώνεται στην ωριμότητα, είναι πιο συνήθης στη
μέση ή στην προχωρημένη ηλικία και μπορεί να ελεγχθεί με δισκία ή απλώς με
δίαιτα.[ζ]
Διαβήτης
της κύησης
Πρόκειται για την εμφάνιση σακχαρώδους διαβήτη για πρώτη φορά
κατά τη διάρκεια της εγκυμοσύνης. (δεν συμπεριλαμβάνονται στον ορισμό γυναίκες με
γνωστό διαβήτη πριν την έναρξη της εγκυμοσύνης). Ο τύπος αυτός μοιάζει με το διαβήτη
τύπου 2 ως προς το ότι χαρακτηρίζεται από ταυτόχρονη ελαττωμένη έκκριση
ινσουλίνης και ελαττωμένη ευαισθησία των κυττάρων στην ινσουλίνη. Παχύσαρκες
γυναίκες είναι πιο πιθανό να αναπτύξουν διαβήτη της κύησης. Ο τύπος αυτός
διαβήτη αφορά στο 3-5% των κυήσεων. 30-40% των γυναικών με διαβήτη κύησης θα
αναπτύξουν διαβήτη τύπου 2 αργότερα στη ζωή τους. Ο διαβήτης της κύησης είναι
αναστρέψιμος και υποχωρεί μετά τον τοκετό, μπορεί όμως να προκαλέσει περιγεννητικές επιπλοκές και
προβλήματα στην υγεία μητέρας και νεογνού.
Άλλοι τύποι διαβήτη
Σακχαρώδης διαβήτης μπορεί να εμφανιστεί και στις ακόλουθες
περιπτώσεις:
·
Γενετικά ελαττώματα των β-κυττάρων του παγκρέατος
·
Γενετικό ελάττωμα της δράσης της ινσουλίνης
·
Νόσοι του παγκρέατος
·
Ορμονικές διαταραχές και ενδοκρινικά νοσήματα
·
Διαβήτης λόγω λήψης φαρμάκων
Τι είναι ο διαβήτης;
O διαβήτης είναι μία μόνιμη διαταραχή της εσωτερικής χημείας του
σώματος, που έχει ως αποτέλεσμα τη συσσώρευση υπερβολικής ποσότητας γλυκόζης
(σακχάρου) στο αίμα. Αυτό οφείλεται στην ανεπάρκεια της ορμόνης ινσουλίνη.
Μπορεί να υπάρχει ολική ανεπάρκεια παραγωγής ινσουλίνης, όπως στον τύπου 1
διαβήτη. Ωστόσο, στον τύπου 2 διαβήτη παρατηρείται συνήθως ένας συνδυασμός
μερικής ανεπάρκειας στην παραγωγή ινσουλίνης και μειωμένης ανταπόκρισης του
σώματος στην ορμόνη. Η κατάσταση αυτή ονομάζεται αντίσταση στην ινσουλίνη.[ζ]
Τι δεν πηγαίνει καλά;
Η ινσουλίνη είναι το μόνο μέσο που έχει στη διάθεσή του το σώμα
προκειμένου να μειώσει τα επίπεδα σακχάρου· όταν υπάρχει, λοιπόν, ανεπάρκεια
ινσουλίνης αποσταθεροποιείται ολόκληρο το σύστημα. Ύστερα από ένα γεύμα, η
απορρόφηση της γλυκόζης από τα τρόφιμα που έχετε καταναλώσει δεν σταματά, και
έτσι τα επίπεδά της στο αίμα αυξάνονται διαρκώς. Όταν η συγκέντρωση ξεπερνά ένα
συγκεκριμένο όριο, η γλυκόζη αρχίζει να αποβάλλεται από το κυκλοφορικό σύστημα
στα ούρα. Όταν τα ούρα είναι σακχαρώδη, αναπτύσσονται πιο εύκολα λοιμώξεις όπως
η κυστίτιδα και η μυκητίαση των γεννητικών οργάνων, καθώς τα υπεύθυνα μικρόβια
έχουν τη δυνατότητα να αναπτυχθούν πιο γρήγορα.
Μια άλλη συνέπεια της αύξησης των επιπέδων σακχάρου στο αίμα
είναι η τάση να αποβάλλει κανείς περισσότερα ούρα. Κι αυτό, διότι η πλεονάζουσα
γλυκόζη διηθείται από τα νεφρά, που προσπαθούν να απαλλαγούν από αυτήν
απεκκρίνοντας περισσότερο αλάτι και νερό. Αυτή η υπερβολική παραγωγή ούρων
ονομάζεται πολυουρία και συχνά αποτελεί το πρώτο σύμπτωμα του διαβήτη. Αν δεν
γίνει κάτι για να διακοπεί αυτή η διαδικασία, σύντομα το άτομο θα αφυδατωθεί
και θα νιώσει δίψα. Όπως προαναφέραμε, εκτός από τη ρύθμιση των επιπέδων
σακχάρου στο αίμα, η ινσουλίνη δρα επίσης στην πρόληψη της απώλειας βάρους,
καθώς και στην αύξηση του σωματικού ιστού - κατά συνέπεια, ένα άτομο στο οποίο
η ινσουλίνη δεν παράγεται επαρκώς ή δεν δρα σωστά θα χάσει αναπόφευκτα κάποια
κιλά. Η σοβαρότητα αυτών των συμπτωμάτων και ο ρυθμός με τον οποίο
αναπτύσσονται, μπορεί να διαφέρουν ανάλογα με τον τύπο του διαβήτη.[ζ]
Τύπου 1 διαβήτης
(παλαιότερα αποκαλούμενος ινσουλινοεξαρτώμενος ή νεανικός διαβήτης)
Χαρακτηρίζεται από καταστροφή των β-κυττάρων του παγκρέατος, που είναι υπεύθυνα για την παραγωγή
ινσουλίνης, με αποτέλεσμα ολική έλλειψη ή ελάχιστη έκκριση ινσουλίνης. Η
ευαισθησία των κυττάρων στην ινσουλίνη είναι συνήθως φυσιολογική, ιδιαίτερα στα
πρώιμα στάδια.
Ο τύπος αυτός αποτελεί την κυριότερη αιτία διαβήτη σε παιδιά,
μπορεί όμως να προσβάλλει και τους ενήλικες. Η καταστροφή των β-κυττάρων του παγκρέατος είναι στην πλειοψηφία των περιπτώσεων αυτοάνοσης
αιτιολογίας. Στο μεγαλύτερο ποσοστό των ασθενών με διαβήτη τύπου 1 ανιχνεύονται
στην κυκλοφορία ένα ή περισσότερα είδη αυτοαντισωμάτων, οι ασθενείς δε αυτοί
εμφανίζουν αυξημένη προδιάθεση και για άλλες αυτοάνοσες παθήσεις. Παρ’ όλ’ αυτά, σ’ ένα
μικρό ποσοστό ασθενών με διαβήτη τύπου 1 δεν ανιχνεύονται αυτοαντισώματα, ο
τύπος δε αυτός ονομάζεται ιδιοπαθής σακχαρώδης διαβήτης.
Ο διαβήτης τύπου 1 εισβάλλει συνήθως απότομα και οδηγεί συχνά
στην ανάπτυξη κέτωσης και διαβητικής κετοξέωσης εάν το έλλειμμα ινσουλίνης δεν
καλυφθεί. Ο ασθενής είναι απόλυτα εξαρτημένος από τη εξωγενή χορήγηση ινσουλίνης
προκειμένου τα επίπεδα σακχάρου του αίματος να διατηρηθούν σε φυσιολογικά
επίπεδα.[θ]
Τύπου 2 διαβήτης
(παλαιότερα αποκαλούμενος μη ινσουλινοεξαρτώμενος διαβήτης)
Χαρακτηρίζεται από το συνδυασμό ελαττωμένης έκκρισης ινσουλίνης και ελαττωμένης
ευαισθησίας των κυττάρων στη δράση της (φαινόμενο που ονομάζεται ινσουλινοαντοχή). Στα πρώτα στάδια της νόσου, η
ελαττωμένη ευαισθησία στην ινσουλίνη είναι η κύρια διαταραχή, ενώ τα επίπεδα
ινσουλίνης στο αίμα είναι αυξημένα.
Ο διαβήτης τύπου 2 είναι η συχνότερη αιτία διαβήτη στους
ενηλίκους. Σπουδαίος προδιαθεσικός παράγοντας για την ανάπτυξη διαβήτη τύπου 2
είναι η παχυσαρκία. Η παχυσαρκία προδιαθέτει στην ανάπτυξη
ινσουλινοαντοχής πιθανόν λόγω της παραγωγής από το λιπώδη ιστό ουσιών που ελαττώνουν την
ευαισθησία των κυττάρων στην ινσουλίνη. Άλλοι προδιαθεσικοί παράγοντες είναι η
ηλικία και το οικογενειακό ιστορικό.
Στον διαβήτη τύπου 2, τα συμπτώματα είναι πιο ήπια και η
πιθανότητα εμφάνισης διαβητικής κετοξέωσης είναι μικρή. Παρ’ όλ’ αυτά, ο
κίνδυνος απώτερων και σοβαρών επιπλοκών παραμένει υψηλός. Το πρώτο βήμα στη
θεραπεία του διαβήτη τύπου 2 είναι η αλλαγή του τρόπου ζωής του ασθενούς με
στόχο την απώλεια βάρους, την αύξηση της σωματικής άσκησης και την υγιεινή
διατροφή. Εάν κριθεί απαραίτητο, χρησιμοποιούνται αντιδιαβητικά φάρμακα. Στην περίπτωση που
η θεραπεία αποτύχει, κρίνεται σκόπιμη η χορήγηση ινσουλίνης για τον έλεγχο και
αυτών των ασθενών.[θ]
 [ω7]
[ω7]
Τι τον προκαλεί;
Υπάρχουν πολλοί γνωστοί λόγοι για τους οποίους η παραγωγή
ινσουλίνης μπορεί να μειωθεί, και κάθε άτομο μπορεί να επηρεασθεί από έναν ή
περισσότερους από αυτούς.
Γονίδια
Η γενετική του σακχαρώδους διαβήτη γνωρίζουμε ότι είναι σύνθετη,
αλλά ορισμένες πρόσφατες εξελίξεις στον τομέα αυτό δείχνουν ότι μεγάλο μέρος
της περιπλοκότητάς του ίσως σύντομα διαλευκανθεί.
Υπάρχουν όπως αναφέραμε δύο κύριοι τύποι σακχαρώδους διαβήτη, ο
ινσουλινοεξαρτώμενος (ΙΕΣΔ) και ο μη-ινσουλινοεξαρτώμενος (ΜΙΕΣΔ), που
αντιπροσωπεύουν το 10% και το 88% του συνόλου των περιπτώσεων, αντίστοιχα. Και
οι δύο τύποι «ενδημούν» σε οικογένειες, αλλά διαφέρουν ως προς την τυπική ηλικία
εμφάνισης, την ταυτόχρονη εμφάνιση στα ΜΖ δίδυμα και τη συσχέτιση με ΗLΑ
Ο ΙΕΣΔ έχει συχνότητα 1 ανά 200 περίπου Καυκάσιους και συχνά
εκδηλώνεται σε νεαρή ηλικία. Προκαλείται από την καταστροφή των κυττάρων β του
παγκρέατος, τα οποία παράγουν την ινσουλίνη. Η καταστροφή των κυττάρων β, που
ευθύνεται για τον ΙΕΣΔ, φαίνεται ότι είναι αυτοάνοση διεργασία, ενώ οι
απλότυποι ΗLΑ DR3 και DR4 είναι στενά συνδεδεμένοι με την προδιάθεση για το
νόσημα.
Περίπου 95% όλων των πασχόντων από ΙΗΣΔ (σε σύγκριση με το 50%
περίπου, για τον φυσιολογικό πληθυσμό) έχουν τον ΗLΑ-DR3 ή ΗLΑ-DR4 ετεροζυγώτες
DR3/DR4 είναι ιδιαίτερα ευπρόσβλητοι στον ΙΕΣΔ. Αυτή είναι μια από τις ισχυρότερες
συνδέσεις μεταξύ ΗLΑ και νοσήματος που γνωρίζουμε Οι μελέτες οικογενειών
υποδεικνύουν ότι στη συσχέτιση με ΗLΑ μπορεί να αποδοθεί πάνω από τη μισή
κληρονομισημότητα του ΙΕΣΔ.[η]
Λοιμώξεις
Είναι γνωστό εδώ και αρκετό καιρό ότι ο τύπου 1 διαβήτης στα
παιδιά και στα νεαρά άτομα είναι πιθανότερο να αναπτυχθεί σε συγκεκριμένες
εποχές του έτους, όταν υπάρχει έξαρση κρυολογημάτων. Oρισμένοι ιοί, όπως της
παρωτίτιδας και ο Κοξάκι, έχουν την ικανότητα να προκαλούν βλάβες στο πάγκρεας,
προκαλώντας διαβήτη. Σε ότι αφορά, ωστόσο, ατομικές περιπτώσεις ασθενών, πολύ
σπάνια μπορούν οι γιατροί να συσχετίσουν την εκδήλωση του διαβήτη με κάποια
συγκεκριμένη λοίμωξη. Μια πιθανή εξήγηση γι, αυτό, είναι ότι η λοίμωξη μπορεί
να έχει «πυροδοτήσει» μια διαδικασία που εκδηλώνεται πολλά χρόνια αργότερα. [ζ]
Περιβάλλον
Τα άτομα που αναπτύσσουν τύπου 2 διαβήτη είναι συχνά υπέρβαρα
και δεν ακολουθούν ισορροπημένη διατροφή. Αξίζει να σημειωθεί ότι τα άτομα που
μετακινούνται από μία χώρα με χαμηλό δείκτη κινδύνου για διαβήτη σε κάποια άλλη
με υψηλότερο, έχουν τις ίδιες πιθανότητες με τους ντόπιους να αναπτύξουν την
πάθηση. Oι ριζικές αλλαγές στον τρόπο ζωής επίσης μπορεί να αυξήσουν τις
πιθανότητες για ανάπτυξη διαβήτη. Πολύ καλό παράδειγμα αποτελούν οι κάτοικοι
της νήσου Ναούρου, στον Ειρηνικό Ωκεανό. Oι άνθρωποι αυτοί έγιναν πολύ πλούσιοι
όταν ανακαλύφθηκαν κοιτάσματα φωσφορικού άλατος στο νησί τους. Το επακόλουθο
ήταν να αλλάξει ριζικά η διατροφή τους, να παχύνουν πολύ και να γίνουν πολύ πιο
επιρρεπείς στην ανάπτυξη διαβήτη. Όλα αυτά αποδεικνύουν ότι υπάρχει σημαντική
σχέση μεταξύ της διατροφής, του περιβάλλοντος και του διαβήτη. Εντούτοις, δεν
υπάρχει σαφής συσχετισμός μεταξύ της ανάπτυξης διαβήτη και της κατανάλωσης
ζάχαρης και γλυκών. [ζ]
Δευτεροπαθής διαβήτης
Μικρός αριθμός ατόμων αναπτύσσουν διαβήτη ως συνέπεια κάποιας
άλλης ασθένειας του παγκρέατος. Η παγκρεατίτιδα (ή φλεγμονή του παγκρέατος),
για παράδειγμα, μπορεί να καταστρέψει μεγάλα τμήματα του αδένα προκαλώντας
διαβήτη. Oρισμένα άτομα που πάσχουν από ορμονικές ασθένειες, όπως το σύνδρομο
Cushing (ο οργανισμός παράγει μεγάλες ποσότητες στεροειδoύς ορμόνης) ή η ακρομεγαλία
(ο οργανισμός παράγει μεγάλες ποσότητες αυξητικής ορμόνης), μπορεί να
παρουσιάσουν διαβήτη ως επιπλοκή της κύριας ασθένειάς τους. O διαβήτης μπορεί
επίσης να είναι συνέπεια κάποιας βλάβης στο πάγκρεας λόγω χρόνιας
υπερκατανάλωσης αλκοόλ.[ζ]
Στρες
Μολονότι πολλά άτομα συνδέουν την εκδήλωση του διαβήτη τους με
κάποιο στρεσογόνο γεγονός, όπως ένα ατύχημα ή μια άλλη ασθένεια, είναι δύσκολο
να εδραιωθεί σαφής συσχετισμός μεταξύ του στρες και του διαβήτη.
 [ω7]
[ω7]
Η εξήγηση μπορεί να έγκειται στο γεγονός ότι οι άνθρωποι
επισκέπτονται τον γιατρό τους με αφορμή κάποιο στρεσογόνο γεγονός και η
διάγνωση του διαβήτη τους γίνεται συμπτωματικά την ίδια περίοδο.[ζ]

[ι]

[ι]

[ι]

[ι]
Ο δρόμος προς το μέλλον
Σήμερα επιδιώκονται διάφορες ερευνητικές γραμμές προκειμένου να
να κατανοηθεί καλύτερα η προέλευση και η παθολογία του διαβήτη Τύπου 1 και να
διευκρινιστούν οι συμπτωματικοί κυτταρικοί και μοριακοί μηχανισμοί που
εμπλέκονται.
Η συντονιστική ενέργεια TONECA γεφυρώνει 28 κορυφαία
ευρωπαϊκά κέντρα, ειδικευμένα στον κλάδο της κλινικής και πειραματικής έρευνας
για το διαβήτη Τύπου 1. Μέσα από αυτή την ενέργεια συλλέγονται οι καλύτερες
διαθέσιμες τεχνικές δεξιότητες, οι καινοτόμες προσεγγίσεις και περιεκτικές
ερευνητικές στρατηγικές.
Η μοναδική αυτή σύμπραξη αποτελεί σημαντικό πλεονέκτημα, τόσο
για την Ευρώπη όσο και για όλο τον κόσμο, αφού προσφέρει υποστήριξη και προωθεί
εξελιγμένες ερευνητικές πρωτοβουλίες και πρωτοβουλίες τεχνολογικής ανάπτυξης,
που στοχεύουν στην ανεύρεση της θεραπείας του διαβήτη Τύπου 1. Τα ειδικά
ερευνητικά θέματα περιλαμβάνουν:
·
Μηχανισμοί του θανάτου παγκρεατικών κυττάρων
·
Η επίδραση περιβαλλοντικών παραγόντων στη
γενετική ρύθμιση και εξέλιξη του διαβήτη Τύπου 1
·
Η χρήση καθιερωμένων και νέων ζωικών προτύπων
για τη διευκρίνιση μοριακών μηχανισμών και
·
Ο ρόλος του κυτταρικού ανοσοποιητικού συστήματος
στην παθογένεια του διαβήτη Τύπου 1
Οι έντεκα χώρες της ΕΕ που συμμετέχουν στην ενέργειας TONECA
πιστεύουν ότι το έργο μπορεί να παίξει σημαντικό ρόλο και ότι κάποια μέρα
μπορεί να είναι πλέον δυνατόν να ανιχνεύονται οι γενεσιουργοί αιτίες του
σακχαρώδη διαβήτη Τύπου 1 και να αναγνωρίζονται νέοι στόχοι για την πρόληψη, τη
διάγνωση και την αντιμετώπιση της νόσου.[μ]
Καλσυνευρίνη
Μια εντελώς νέα θεραπευτική προσέγγιση για τον διαβήτη «τύπου 2»
παρουσιάζει ο δρ Σουνγ Kιμ, αναπληρωτής καθηγητής αναπτυξιακής βιολογίας στο
Πανεπιστήμιο Στάνφορντ της Kαλιφόρνια. Eπιτυχημένα πειράματα έδειξαν ότι η
πρωτεϊνη «καλσυνευρίνη» που βρίσκεται στα «βήτα κύτταρα» του παγκρέατος παίζει
κεντρικό ρόλο στην εμφάνιση του διαβήτη. H καταστροφή των «κυττάρων βήτα» είναι
η αιτία της εμφάνισης του σακχαρώδους διαβήτη.
«H ελπίδα για μια σημαντική νέα αντιμετώπιση του διαβήτη
γεννήθηκε όταν μελετήσαμε σε πειραματόζωα, τις επιπτώσεις από τις
κυκλοσπορίνες, τα φάρμακα που παίρνουν οι μεταμοσχευμένοι για να μην απορρίψει
ο οργανισμός το μόσχευμα», λέει ο δρ Σουνγ Kιμ. «Eπειδή τα φάρμακα αυτά
συμβάλλουν σε ορισμένες περιπτώσεις στην αύξηση του κινδύνου εμφάνισης
σακχαρώδους διαβήτη, περιορίζουν «ασφυκτικά» την πρωτεϊνη «καλσυνευρίνη».

Mαζί με τον μεταπτυχιακό φοιτητή Tζέρεμι Xέιτ και τη συνεργασία
του καθηγητή Παθολογίας Tζέραλντ Γκάμπρι, ψάξαμε απαντήσεις στο ερώτημα γιατί η
παρεμπόδιση της «καλσυνευρίνης» οδηγεί στην ασθένεια. «Aρχίσαμε τη μελέτη από
τα έμβρυα ποντικιών, στα οποία τροποποιήσαμε κύτταρα του παγκρέατος για να
παράγουν «καλσυνευρίνη», μόνο μέχρι τη γέννησή τους». «Mετά τη γέννησή τους
διαπιστώσαμε ότι το πάγκρεας σε κάθε ποντίκι σταμάτησε να παράγει την πρωτεϊνη.
Mέχρι τις 12 πρώτες εβδομάδες της ηλικίας τους, τα ποντίκια που είχαν γεννηθεί
με έναν κανονικό αριθμό «βήτα κυττάρων», παρουσίαζαν την εικόνα σοβαρής πάθησης
από διαβήτη.
H «καλσυνευρίνη» απέτρεψε την αύξηση των «βήτα κυττάρων» στα
ποντίκια που η μάζα σώματός τους αυξανόταν και απαιτούσαν περισσότερα «βήτα
κύτταρα» για να ελέγξουν το σάκχαρο. Tαυτόχρονα, μειώθηκε και η ποσότητα
ινσουλίνης».
Πολύ σημαντικό θεωρείται το γεγονός ότι η πρωτεϊνη αυτή παίζει
κυρίαρχο ρόλο στη ρύθμιση όχι ενός, αλλά 10 γονιδίων που ήδη είχαν συσχετισθεί
με το διαβήτη. «Mε τον Xέιτ, είπαμε να προχωρήσουμε σε μια «γενετική πονηριά»,
να προσπαθήσουμε να παρακάμψουμε την «καλσυνευρίνη» και τεχνητά να
ενεργοποιήσουμε ένα πρωτεϊνικό ανάλογό του, που ονομάζεται «NFAT». Aυτό ήταν!
Tα «βήτα κύτταρα» που στερούνται «καλσυνευρίνης», αλλά έχουν ενεργό «NFAT»
συμπεριφέρθηκαν κανονικά, πολλαπλασιάζοντας -όσο τα ποντίκια μεγάλωναν- και την
παραγωγή των κανονικών ποσοτήτων ινσουλίνης». Η μελέτη αυτή έχει οδηγήσει τους
επιστήμονες να σκεφτούν πλέον κάποιους εξ ολοκλήρου νέους τρόπους για τη
θεραπεία του διαβήτη. Mέχρι τώρα άλλοι ερευνητές είχαν προσδιορίσει τα
μεμονωμένα γονίδια ή τις διαδικασίες που παίζουν ρόλο στον διαβήτη. Tα νέα αυτά
συμπεράσματα δείχνουν ότι όλες αυτές οι ερευνητικές προσεγγίσεις, έχουν κοινό
χαρακτηριστικό και συνδέονται μέσω ενός κοινού ρυθμιστή που είναι η πρωτεϊνη
«καλσυνευρίνη».
Tο επόμενο βήμα των ειδικών είναι να ελεγχθεί αν τα αποτελέσματα
των πειραμάτων θα ισχύουν και στους ανθρώπους.[ν]
Θεραπεία Διαβήτη - Το μέλλον
είναι η Γενετική
Με το βλέμμα στραμμένο στη Γενετική, για την παραγωγή ανθεκτικών
στα καταστροφικά αντισώματα μοσχευμάτων, που θα απαλλάξουν τους διαβητικούς από
τις ενέσεις ινσουλίνης και θα δώσουν λύση στην έλλειψη δοτών, βρίσκονται οι
επιστήμονες. Στις τελευταίες εξελίξεις στην έρευνα και τη θεραπεία του διαβήτη,
και ειδικότερα του νεανικού διαβήτη τύπου Ι, αναφέρεται ο καθηγητής
Παιδιατρικής του Πανεπιστημίου Αθηνών κ. Χρήστος Μπαρτσώκας. Τα μηνύματα για
τους ασθενείς και τις οικογένειές τους είναι ελπιδοφόρα, καθώς η επιστήμη
προχωρά με γοργά βήματα. Σήμερα περισσότεροι από 300 διαβητικοί, κυρίως σε ΗΠΑ
και Καναδά, ζουν χωρίς ενέσεις ινσουλίνης, χάρη στο πρωτόκολλο του Έντμοντον.
Είναι μια νέα μέθοδος που εφαρμόζεται πειραματικά τα τελευταία χρόνια σε 15
περίπου κέντρα της Αμερικής, του Καναδά και της Δυτικής Ευρώπης - όχι όμως
ακόμα στην Ελλάδα - με την οποία γίνεται μεταμόσχευση Β' κυττάρων του
παγκρέατος, τα οποία παράγουν την ινσουλίνη. Με τη μέθοδο αυτή γίνεται έγχυση
στην πυλαία φλέβα β - κυττάρων - διαδικασία απλή που διαρκεί το πολύ μισή ώρα -
τα οποία δίνουν τη δυνατότητα στο πάγκρεας του ασθενούς να παράγει ινσουλίνη,
και τον απαλλάσσει για μεγάλο χρονικό διάστημα από την ανάγκη των ενέσεων.[ο]
Αν και μεταμόσχευση νήσων με χρησιμοποίηση του Έντμοντον πρωτοκόλλου
επιτρέπει στους ασθενείς με τον τύπο Ι διαβήτη να σταματήσει την ινσουλίνη, πολλοί
μπορεί να πρέπει να ξαναξεκινήσουν το φάρμακό τους μέσα σε δύο έτη.
Η ερώτηση: Η μεταμόσχευση κυττάρων νήσων είναι μια πειραματική
διαδικασία για τους ανθρώπους με το διαβήτη τύπου Ι. Περιλαμβάνει την εξαγωγή
της ινσουλίνης - παράγοντας κύτταρα νήσων από τις παγκρεάσες που είναι στη
συνέχεια άμεσα εμποτισμένες στο υπομονετικό συκώτι τους. Μόλις εμφυτεύουμε, τα βήτα
κύτταρα σε αυτά τα νησάκια αρχίζουν να φτιάχνουν και να απελευθερώνουν την
ινσουλίνη. Ο στόχος είναι να επιτραπούν οι ασθενείς με το διαβήτη τύπου Ι να
ζήσουν χωρίς καθημερινές εγχύσεις ινσουλίνης. Οι προηγούμενες μελέτες έχουν καταδείξει
εκείνη την μεταμόσχευση νησακιών χρησιμοποιώντας μια διαδικασία αποκαλούμενη το
πρωτόκολλο του Έντμοντον που επιτρέπει στους ασθενείς να σταματήσουν την χρήση
ινσουλίνης. Το πρωτόκολλο του Έντμοντον χρησιμοποιεί έναν συνδυασμό ανοσοκαταστελτικών
φαρμάκων. Μερικά δίνονται ενδοφλεβίως σωστά μετά από τη μεταμόσχευση και έπειτα
διακομμένα, ενώ άλλα πρέπει να ληφθούν για όλη τη ζωή. Εντούτοις, τα
μακροπρόθεσμα αποτελέσματα του πρωτοκόλλου είναι άγνωστα. Οι ασθενείς
συνεχίζουν να είναι καλά μετά από μερικά έτη συνέχισης;
Τα συμπεράσματα: Αυτή η διεθνής μελέτη περιέλαβε 36 ασθενείς με
το διαβήτη τύπου Ι που έλαβαν μια μεταμόσχευση νήσων με χρησιμοποίηση του
πρωτοκόλλου του Έντμοντον. Το φάρμακο αντι-απόρριψης dacliximab δόθηκε
ενδοφλεβίως για οκτώ εβδομάδες μετά από τη μεταμόσχευση και έπειτα διακομμένα. Sirolimus και
tacrolimus, τα δύο
κύρια φάρμακα που κρατούν το ανοσοποιητικό σύστημα μακρυά από την καταστροφή
των μεταμοσχευμένων νήσων, δίνονται κατά τρόπο αόριστο. Αν και μερικοί ασθενείς
έφθασαν στην ανεξαρτησία ινσουλίνης σε κάποιο σημείο κατά τη διάρκεια της
δοκιμής, 76% αυτών έγιναν ινσουλίνη - εξαρτώμενοι ξανά μέχρι δύο έτη μετά από
τη μεταμόσχευση.
Ποιος είχε επιπτώσεις: Ασθενείς με τον τύπο Ι διαβήτη.
Προειδοποιήσεις: Σύμφωνα με ένα συνοδευτικό κύριο άρθρο, η
διαδικασία έχει τεράστιες τεχνικές προκλήσεις. Μόνο 45% των απομονώσεων νήσων οδήγησε
στις μεταμοσχεύσεις, σημαίνοντας ότι η πλειοψηφία των απομονώσεων ήταν
ανεπαρκής. Επιπλέον, πολλαπλάσιες εγχύσεις νήσων απαιτήθηκαν επίσης. Στη
μελέτη, 31% των ασθενών έλαβε μια ενιαία έγχυση, 25% έλαβε δύο εγχύσεις, και
44% έλαβε τρεις εγχύσεις, παρουσιάζοντας δυσκολία και έναν επαρκή αριθμό
ασταθών κυττάρων.
Καθαρό μήνυμα: Η μεταμόσχευση κυττάρων νήσων μπορεί να είναι μια
βιώσιμη επιλογή στην επεξεργασία του διαβήτη τύπου Ι. Εντούτοις, περισσότερες
ερευνητικές πρόοδοι απαιτούνται για να αυξηθούν η μακροπρόθεσμη αποτελεσματικότητα
του πρωτοκόλλου του Έντμοντον. [[κ]
Αν και ο ασθενής στη συνέχεια πρέπει να παίρνει
ανοσοκατασταλτικά φάρμακα - των οποίων οι πιθανές παρενέργειες δεν έχουν ακόμα
διευκρινιστεί - η μέθοδος αυτή γεννά σοβαρές ελπίδες για την αντιμετώπιση της
νόσου. Μάλιστα, προς την κατεύθυνση αυτή, δηλαδή της μεταμόσχευσης β - κυττάρων
του παγκρέατος, έχει επικεντρωθεί και η έρευνα στον τομέα της Γενετικής.
Συγκεκριμένα η έρευνα επικεντρώνεται στην παραγωγή β - κυττάρων από αρχέγονα
βλαστοκύτταρα με κλωνοποίηση, και στη γενετική τροποποίηση των β - κυττάρων που
χορηγούνται στον ασθενή, ούτως ώστε να μην καταστρέφονται από τα αντισώματα.
Κάτι τέτοιο θα δώσει λύση στο μείζον πρόβλημα της ανυπαρξίας δοτών, (οι δότες
σε ετήσια βάση δεν υπερβαίνουν τους 10) Και μάλιστα, όταν, εκτός από το διαβήτη
τύπου 1, που εμφανίζεται στους νέους, σημαντική αύξηση παρουσιάζει τα τελευταία
χρόνια και ο διαβήτης τύπου ΙΙ, που οφείλεται στην παχυσαρκία, την κακή
διατροφή και την έλλειψη άσκησης. Γι' αυτό, όπως τονίζει ο ίδιος, θα πρέπει να
δοθεί βάρος στην πρόληψη από την παιδική ηλικία, μέσα από την αγωγή υγείας και
καλής διατροφής. Η παραγωγή ανθεκτικών στα καταστροφικά αντισώματα μοσχευμάτων,
που θα απαλλάξουν τους διαβητικούς από τις ενέσεις ινσουλίνης, είναι στο
επίκεντρο της ιατρικής έρευνας. [ο]
Τα ένοχα γονίδια
Πρόσφατες μελέτες σχετικά με τον ρόλο των μιτοχονδρίων ή της
πρωτεΐνης PC-1 στην εκδήλωση της νόσου ανοίγουν τον δρόμο για ιδιότυπες
γονιδιακές θεραπείες
Πάνω από 171 εκατομμύρια άνθρωποι πάσχουν από τον σακχαρώδη
διαβήτη τύπου ΙΙ σε όλον τον κόσμο και αναμένεται ο αριθμός να διπλασιαστεί ως
το 2030, ενώ την τελευταία δεκαετία η αύξηση ήταν 25%. Ανάλογα ισχύουν και στη
χώρα μας. Το κόστος αντιμετώπισης της εν λόγω ασθένειας, που είναι έβδομη κατά
σειρά αιτία θανάτου, εκτιμάται ότι προσεγγίζει το 13%-14% του συνολικού ποσού
για την υγεία, με διαγνωσμένους διαβητικούς περίπου 8%.
Οι ειδικοί κατατάσσουν τους ανθρώπους σε τρεις σχετικές
κατηγορίες: σε μη διαβητικούς, με εξασθενημένη ανοχή στη γλυκόζη και σε
διαβητικούς. Οι τελευταίοι αντιπροσωπεύουν τρεις τύπους: τον τύπο I όπου δεν
παράγεται ινσουλίνη, ορμόνη που μεταβολίζει και μετατρέπει τη γλυκόζη, το άμυλο
και άλλες τροφές σε ενέργεια απαραίτητη για την καθημερινή ζωή· τον τύπο II
όπου υπάρχει ινσουλίνη αλλά δεν λειτουργεί το βιοχημικό σήμα για να
μεταβολίζεται η γλυκόζη· και τον διαβήτη της κυοφορίας.
Στον τύπο I τα β κύτταρα του παγκρέατος δεν παράγουν (αρκετή)
ινσουλίνη· και χωρίς εξωγενή χορήγησή της επέρχεται ο θάνατος. Στον τύπο αυτόν
αναπτύσσονται αντισώματα και αυτοανοσία στην παγκρεατική ινσουλίνη. Γενετικές
μελέτες διδύμων έδειξαν ότι η σύμπτωση να προκληθεί ασθένεια και στα δύο είναι
ελάχιστη, γι' αυτό ο κληρονομικός παράγοντας θεωρείται μικρός. H πάθηση
αποδίδεται σε περιβαλλοντικούς παράγοντες, πιθανόν σε αντιγόνα ιών.
Ο τύπος II είναι περίπου 10 φορές πιο συχνός από τον τύπο I,
π.χ., στην Αμερική και αντιπροσωπεύει γενικά το 90%-95% των διαβητικών. H
πάθηση αντανακλά την αδυναμία μεταβολισμού των υδατανθράκων και αν δεν ελεγχθεί
μπορεί να προκαλέσει πολλές οργανικές βλάβες, όπως τύφλωση, νεφρική ανεπάρκεια,
ακρωτηριασμούς κτλ. H ελαττωματική αντίδραση της ινσουλίνης με τα
όργανα-στόχους (μυς, συκώτι, λιπώδης ιστός) και η συνακόλουθη ανεπαρκής
απορρόφησή της, γνωστή και ως αντίσταση στην ινσουλίνη, οδηγεί τον οργανισμό σε
υψηλότερες απαιτήσεις ινσουλίνης, με τα προαναφερθέντα κύτταρα να πιέζονται για
τη σύνθεση μεγαλύτερης ποσότητας λόγω της εξασθενημένης ανοχής του οργανισμού
στη γλυκόζη και τελικά την κατάρρευσή τους.
Ο τύπος II δεν υπήρχε ουσιαστικά πριν από 100 χρόνια· είναι
προϊόν του σύγχρονου πολιτισμού μας, περιβαλλοντικής πρόκλησης δηλαδή
συνδυαστικά με προϋπάρχουσα εν υπνώσει γενετική προδιάθεση που ποικίλλει μεταξύ
εθνικών ομάδων - με τους ιθαγενείς Αμερικανούς και Ισπανούς, λ.χ., να δείχνουν
σαφή προδιάθεση και τους Καυκάσιους, Μελανήσιους και Εσκιμώους μικρότερη. Τα
υψηλά ποσοστά διαβητικών ανά τον κόσμο και τα συνακόλουθα κόστη έχουν φέρει την
αναγκαιότητα της γενετικής διαλεύκανσης της ασθένειας και των περιβαλλοντικών
παραμέτρων με τις οποίες φαίνεται να συνδέεται (διατροφή, παχυσαρκία, ελλιπής
σωματική άσκηση, στρες) σε πρώτη γραμμή.
Στο γενετικό επίπεδο λίγα ήταν γνωστά πριν από ελάχιστα χρόνια.
Οι πρώτες μελέτες κλασικής προσέγγισης βασίζονταν στην αξιοποίηση γενεαλογικών
δέντρων. Τα αρχικά συμπεράσματα οδήγησαν στον γενετικό προσδιορισμό της
ασθένειας ως μεντελικού αυτοσωματικού χαρακτήρα, μη συνδεδεμένου δηλαδή με το
φύλο. Ωστόσο τα πράγματα δεν είναι τόσο απλά καθώς ο περιβαλλοντικός
επηρεασμός, το γενετικό υπόβαθρο και τροποποιητικά γονίδια έχουν σημαντικό
ρόλο. Γι' αυτό οι προσπάθειες πέρασαν στη μελέτη αδελφών και διδύμων στα οποία
συνεκδηλώνεται σε ποσοστό 80%-90%, σε μελέτες σύνδεσης με ανιχνεύσιμους
μοριακούς μάρτυρες και τελευταία σε πιο συγκεκριμένες γενετικές μοριακές
αναλύσεις.
Στο πλαίσιο αυτό έχουν ενοχοποιηθεί πολλά υποψήφια γονίδια
πρόκλησης διαβήτη II, κατάσταση που υποδηλώνει ότι η ασθένεια είναι
πολυπαραγοντική - συμβάλλουν δηλαδή πολλά γονίδια -, χωρίς να έχει αποκαλυφθεί
κάποιο κυρίαρχο γονίδιο. Ανάλυση 30 γονιδιωμάτων ενοχοποιεί, λ.χ., πάνω από δύο
δεκάδες γονίδια, ευρισκόμενα σε διάφορα χρωμοσώματα (1, 3, 8, 12, 17, 20, ενώ
αν συνυπολογιστούν και γονίδια που συνδέουν την παχυσαρκία με τον διαβήτη II, ο
αριθμός αυξάνεται και άλλο!
Τον Σεπτέμβριο του 2005 δημοσιεύθηκαν πιο ενδιαφέροντα στοιχεία
που συγκεκριμενοποιούν ως αιτιατό παράγοντα τη δυσλειτουργία των μιτοχονδρίων,
οργανιδίων του κυττάρου τα οποία παράγουν ενέργεια· η σοβαρή απόκλιση στην
παραγωγή ενέργειας φαίνεται να είναι το κλειδί του προβλήματος που οδηγεί στο
σύνδρομο της αντίστασης στην ινσουλίνη και συνακόλουθα στον διαβήτη II.
Φυσιολογικά μιτοχόνδρια αντιδρούν στην ινσουλίνη και αυξάνουν τη σύνθεση
ενεργειακών μορίων (ΑΤΡ) κατά 90% και μόνο κατά 5% σε απογόνους διαβητικών με
αντίσταση στην ινσουλίνη. H αρχική μιτοχονδριακή λοιπόν δυσλειτουργία φαίνεται
να είναι ένα σήμα για όσους θα εκδηλώσουν αργότερα διαβήτη II.
Πιο εξειδικευμένη προσέγγιση του προβλήματος, δημοσιευμένη τον
Αύγουστο του 2005 στο περιοδικό «Nature Genetics» από ερευνητές του Ινστιτούτου
Pasteur στη Γαλλία σε συνεργασία με Αμερικανούς, ανέδειξε τη σημασία της
παραλλαγής μιας κοινής πρωτεΐνης που φαίνεται να παίζει πρωταρχικό ρόλο στον
διαβήτη II αλλά και στην παχυσαρκία. Χαρακτηριστικά του συνδρόμου αντίστασης
στην ινσουλίνη που επηρεάζει 50 εκατομμύρια Αμερικανούς και άλλους τόσους
Ευρωπαίους, μορφοποιώντας το λεγόμενο μεταβολικό σύνδρομο που συνδέεται με τη
στεφανιαία νόσο, την υψηλή πίεση, την υψηλή χοληστερόλη και υψηλά τριγλυκερίδια
- από αυτό πάσχει ένας στους τέσσερις Ελληνες και εκτιμάται ότι το 2030 η
αναλογία θα είναι 1 προς 2.
H εν λόγω πρωτεΐνη, γνωστή ως PC-1, βρέθηκε πριν από δέκα χρόνια
σε πολύ υψηλά επίπεδα σε διαβητικούς. Ουσιαστικός της ρόλος φαίνεται να είναι η
απενεργοποίηση μιας άλλης πρωτεΐνης η οποία είναι γνωστή ως υποδοχέας της
ινσουλίνης, ο οποίος φυσιολογικά δεσμεύεται με την ινσουλίνη για να
μεταβολισθεί το σάκχαρο. Εξέταση 3.000 ανθρώπων έδειξε ότι μια κοινή παραλλαγή
του γονιδίου PC-1 σχετίζεται ισχυρά με το σύνδρομο αντίστασης στην ινσουλίνη,
στον διαβήτη II και στην παχυσαρκία.
Δύο μεταλλάξεις που προσδιορίστηκαν με μοριακή ανάλυση και
αφορούν δύο μοναδικές νουκλεοτιδικές υποκαταστάσεις, αλλαγές δηλαδή σε δύο
«γράμματα» του DNA, αυξάνουν την παραγωγή της πρωτεΐνης PC-1 στα κύτταρα και
στο αίμα. Παράλληλες μελέτες σε ποντίκια τα οποία υπερεκφράζουν το γονίδιο PC-1
επιβεβαίωσαν τον Φεβρουάριο του 2005, με δημοσίευση στο περιοδικό «Diabetes»,
τον ρόλο της PC-1 πρωτεΐνης στον διαβήτη και ανοίγουν τον δρόμο για τη
φαρμακευτική αντιμετώπισή του σε πιο στέρεα και πιο αποτελεσματική βάση. Ηδη
ερευνάται κλινικά, με μια ιδιότυπη γονιδιακή θεραπεία, ο ρόλος επίσης μιας
πρωτεΐνης που αντιδρά με το DNA και προφυλάσσει από τη διαβητική νευροπάθεια.
Τέτοιες βασικές ερευνητικές προσεγγίσεις είναι αναμφίβολα πολύ σημαντικές καθώς
το πρόβλημα του διαβήτη ΙΙ μεγεθύνεται πολύ γοργά και είναι αναγκαία πιο
αποτελεσματικά φάρμακα που θα σταματούν ή θα αναστρέφουν την πορεία της
ασθένειας.
Μπορεί λοιπόν η βασική αιτία του διαβήτη να είναι γενετική, αλλά
η μη υγιεινή διατροφή, όπως και η σωματική αδράνεια συμβάλλουν ουσιαστικά στην
εκδήλωση του συνδρόμου της αντίστασης στην ινσουλίνη και στη συνακόλουθη
εξέλιξή του, στον διαβήτη II. Γι' αυτό ας μην ξεχνάμε ότι οι τρόποι κάνουν τον
άνθρωπο· τα γονίδια μόνα τους όχι, τουλάχιστον αυτά που υποθάλπουν τον
σακχαρώδη διαβήτη τον οποίο μπορούμε να προλάβουμε. [ω5]
Θεραπεία πόρτα - πόρτα
Ελπίδες για λύσεις στο θέμα του διαβήτη δίνει πείραμα στην
Άσβιλ της Βόρειας Καρολίνας όπου οι φαρμακοποιοί εκτελούν χρέη επιτηρητή και
επιμορφωτή των ασθενών.
Τα τελευταία 10 χρόνια στην πόλη Άσβιλ πραγματοποιείται ένα
πείραμα που λόγω των πολύ θετικών αποτελεσμάτων του, αποτελεί ακόμη ένα όπλο
στη μάχη για την αντιμετώπιση του διαβήτη. Στο πείραμα συμμετέχουν δημοτικοί
υπάλληλοι που πάσχουν από διαβήτη. Τα απαραίτητα φάρμακα τούς παρέχονται
δωρεάν, καθώς και όλες οι διευκολύνσεις που χρειάζονται με την προϋπόθεση ότι
θα επισκέπτονται κάθε μήνα τον φαρμακοποιό τους. Ο τελευταίος έχει εκπαιδευτεί
για να επιτελεί τον ρόλο του επιτηρητή και συμβούλου του ασθενούς. Τα πρώτα
αποτελέσματα, σύμφωνα με τοπικούς αξιωματούχους, είναι πολύ ενθαρρυντικά αφού
στο τέλος του πρώτου έτους του προγράμματος, οι μισοί εθελοντές είχαν θέσει υπό
έλεγχο τα επίπεδα σακχάρου στο αίμα. Μάλιστα, τέλος του τρίτου έτους, ο αριθμός
αυτός αυξήθηκε περίπου στο 65%. Τα στοιχεία αυτά καθιστούν το πείραμα στην
Άσβιλ ιδιαίτερα σημαντικό. Έρευνα που δημοσιεύτηκε στην επιθεώρηση
"Journal of the American Pharmaceutical Association" το 2003 έδειχνε
πως αν και οι διαβητικοί ρίχνουν τις τιμές σακχάρου το πρώτο διάστημα μετά την
έναρξη μαθημάτων για τη νόσο, μέσα σε τρεις μήνες το σάκχαρο επανέρχεται σε
υψηλά επίπεδα κάτι που δεν συμβαίνει όμως με τους ασθενείς του πειράματος.
Επιπλέον, στην Άσβιλ, περιορίστηκε το οικονομικό κόστος των ιατρικών δαπανών
κατά τουλάχιστον 1.500 ευρώ ανά ασθενή ετησίως. Στη διάρκεια των πέντε πρώτων
ετών του πειράματος, οι συμμετέχοντες απουσίασαν κατά μέσο όρο έξι εργάσιμες
μέρες από τη δουλειά τους εξαιτίας της ασθένειάς τους - τις μισές σε σύγκριση
με προηγούμενες χρονιές - ενώ περιορίστηκαν στο μισό οι πιθανότητες να
αντιμετωπίσουν τύφλωση ή ακρωτηριασμό ή να χρειαστούν αιμοκάθαρση. "Όταν
πρέπει να απαντάς στις ερωτήσεις κάποιου κάθε μήνα, σκέφτεσαι δύο φορές πριν
φας κάτι που απαγορεύεται", επισήμανε ο Τζορτζ Λέντφορντ, ο οποίος
συμμετέχει στο πρόγραμμα εδώ και πέντε χρόνια.
Στις Ηνωμένες Πολιτείες, ο διαβήτης είναι η πέμπτη πιο φονική
ασθένεια. Οι διαβητικοί υπολογίζεται ότι είναι τουλάχιστον 21 εκατομμύρια.
Παγκοσμίως, οι ασθενείς με διαβήτη ξεπερνούν τα 170 εκατ. (στην Ελλάδα
εκτιμάται ότι από διαβήτη πάσχει το 5,9% του γενικού πληθυσμού). Ο διαβήτης δεν
είναι μια ασθένεια που θεραπεύεται με εγχείρηση ή φαρμακευτική αγωγή. Απαιτεί
από τον ασθενή να αλλάξει όχι μόνο τις διατροφικές του συνήθειες, αλλά και τον
ίδιο τον τρόπο της ζωής του, κάτι πάρα πολύ δύσκολο. Το πείραμα στην πόλη Άσβιλ
όμως αποτελεί μια αχτίδα ελπίδας, ένα παράδειγμα προς μίμηση για το τι μπορεί
να επιτευχθεί αν αντιμετωπιστεί το πρόβλημα κατά περίπτωση, με την ενεργό συμμετοχή
των τοπικών κοινωνιών. Τα τελευταία χρόνια, περίπου 40 φορείς σε όλη τη χώρα -
ιδιωτικές επιχειρήσεις ή τοπικές αρχές - έχουν υιοθετήσει και εφαρμόζουν
παραλλαγές του πειράματος της Άσβιλ.[λ]
Η πρωτεΐνη GLP-1 κλειδί στη
θεραπεία του διαβήτη τύπου ΙΙ
Το πρωτεϊνικό μόριο GLP-1 που εκκρίνεται φυσιολογικά από τα
νευροενδοκρινικά κύτταρα του εντέρου, φαίνεται να υπόσχεται πολλά στην
καθυστέρηση ακόμη και την πρόληψη της εμφάνισης του σακχαρώδη διαβήτη τύπου ΙΙ,
σύμφωνα με αμερικανική μελέτη που δημοσιεύεται στο Endocrinology. H
εργαστηριακή μελέτη που πραγματοποιήθηκε στο Cedars-Senai Medical Center έδειξε
ότι το συνθετικό ανάλογο του GLP-1 (Glucagon Like Protein) όχι μόνο ενισχύει
την ικανότητα των β-νησιδιακών κυττάρων να παράγουν ινσουλίνη, αλλά ουσιαστικά
σχηματίζει νέα ινσουλίνη, αυξάνοντας το ρυθμό δημιουργίας νέων παγκρεατικών
κυττάρων και αποτρέποντας το θάνατο των υπερλειτουργούντων κυττάρων.
Προηγούμενες έρευνες σε πειραματόζωα έδειξαν ότι το GLP-1 αύξανε την παραγωγή
ινσουλίνης και μείωνε το ρυθμό καταστροφής των νησιδιακών κυττάρων. Οι
επιστήμονες θέλησαν να διαπιστώσουν αν το GLP-1 διατηρούσε τη λειτουργικότητα
και τη βιωσιμότητα των ανθρώπινων παγκρεατικών κυττάρων. Παρατήρησαν ότι το
GLP-1 καθυστερούσε την αποδόμηση των νησιδίων και επιμήκυνε τη διάρκεια ζωής
των κυττάρων. Τα παγκρεατικά κύτταρα γίνονταν πιο αποτελεσματικά αφού η αγωγή
με GLP-1 τα ωθούσε να παράγουν ινσουλίνη μόνο όταν ήταν αναγκαίο. Η αγωγή με
GLP-1 εμπόδιζε την υπερλειτουργία των ινσουλινοπαραγωγών κυττάρων, κάτι που
συμβαίνει στη φυσική πορεία του σακχαρώδη διαβήτη τύπου ΙΙ, αποτρέποντας έτσι
την εξάντληση και τον πρώιμο θάνατο τους. Στη μελέτη που έγινε υπό την επίβλεψη
του Δρος Ρικάρντο Περφέτι απομονώθηκαν δύο ομάδες νησιδίων από ανθρώπινο
πάγκρεας και καλλιεργήθηκαν στο εργαστήριο για πέντε ημέρες. Στη μια ομάδα
χορηγήθηκε αγωγή με GLP-1 δις ημερησίως ανά 12 ώρες-ομάδα μελέτης- ενώ η άλλη
ομάδα λειτούργησε ως ομάδα ελέγχου και δεν πήρε κανενός τύπου αγωγή. Στο τέλος
της πρώτης, τρίτης και πέμπτης μέρας της μελέτης προστέθηκε γλυκόζη στις
καλλιέργειες και ακολούθως πραγματοποιήθηκε μέτρηση του ποσού της εκκρινόμενης
ινσουλίνης. Οι ερευνητές παρατήρησαν ότι τα παγκρεατικά νησίδια και στις δύο
ομάδες διατήρησαν το σχήμα και τη δομική τους ακεραιότητα για μια ημέρα. Στις
μέρες που ακολούθησαν καταγράφηκε προοδευτική απώλεια της δομής των νησιδίων
και του αριθμού των κυττάρων εντός των νησιδίων στην ομάδα που δεν προστέθηκε
το μόριο GLP-1 στο υλικό καλλιέργειας με μείωση του αριθμού των βιώσιμων
κυττάρων κατά 45% στο τέλος της μελέτης. Στην ομάδα που τα νησίδια
καλλιεργήθηκαν με το μόριο GLP-1, αυτά κατάφεραν να διατηρήσουν το σχήμα και τη
δομική τους ακεραιότητα για μεγαλύτερο διάστημα, αφού το ποσοστό απώλειας των
βιώσιμων κυττάρων στο τέλος της πέμπτης μέρας ήταν 15%. Για να διαπιστώσουν
κατά πόσο το GLP-1 μπορούσε να επιβραδύνει το ρυθμό απώλειας των νησιδιακών
κυττάρων, οι ερευνητές εφάρμοσαν μια ειδική τεχνική χρώσεως για να υπολογίσουν
τον αριθμό των επιζώντων κυττάρων την πέμπτη ημέρα της μελέτης. Ο χρόνος ήταν
ένας μείζων παράγοντας, αλλά τα κύτταρα που τους χορηγήθηκε το μόριο GLP-1
έζησαν περισσότερο. Μέχρι την τρίτη ημέρα της μελέτης το 15,5% των κυττάρων της
ομάδας ελέγχου είχε πεθάνει σε αντίθεση με το 6,1% της ομάδας του GLP-1. Την
πέμπτη ημέρα είχε πεθάνει το 18,9% της ομάδας ελέγχου και το 8,9% της ομάδας
μελέτης. Επιπρόσθετα όταν οι ερευνητές πρόσθεσαν γλυκόζη στις καλλιέργειες για
να καθορίσουν αν το πρωτεϊνικό μόριο GLP-1 ενεργοποιούσε τα κύτταρα να
εκκρίνουν ινσουλίνη, διαπίστωσαν ότι όντως τα κύτταρα στα οποία χορηγήθηκε το
συγκεκριμένο μόριο ήταν πιο ευαίσθητα στη γλυκόζη και μπορούσαν να εκκρίνουν
περισσότερη ινσουλίνη από ότι τα κύτταρα της ομάδας ελέγχου. Τα αποτελέσματα
δείχνουν ότι οι δράσεις αυτής της πρωτεΐνης θα μπορούσαν να χρησιμοποιηθούν
μελλοντικά για τη θεραπεία και ίσως και για την αποτροπή της εκδήλωσης του
σακχαρώδους διαβήτη τύπου ΙΙ.[π]
Ο υπογλυκαιμικός παράγοντας
ΝΝ2211 στη θεραπεία του διαβήτη τύπου ΙΙ
Οι ερευνητές συνεχίζουν να αναζητούν πιο αποτελεσματικούς και
πρακτικούς τρόπους προκειμένου να βοηθήσουν τα άτομα με διαβήτη τύπου ΙΙ να
μειώσουν τα υψηλά μεταγευματικά επίπεδα σακχάρου του αίματος. Πρόσφατη έρευνα
από την Δανία αποκαλύπτει ενδεχομένως μια νέα θεραπευτική παρέμβαση. Πρόκειται
για τον υπογλυκαιμικό παράγοντα ΝΝ2211, που πιστεύεται πως θα αποτελέσει στο
μέλλον μια νέα, πολλά υποσχόμενη θεραπεία του διαβήτη τύπου 2. Ένας από τους
στόχους της αντιμετώπισης του διαβήτη τύπου ΙΙ είναι να εμποδίσει ή να μειώσει
την απότομη αύξηση της γλυκόζης του αίματος η οποία συμβαίνει αμέσως μετά το γεύμα.
Αυτή η κατάσταση χαρακτηρίζεται σαν μεταγευματική υπεργλυκαιμία. Έρευνες
έδειξαν ότι το GLP-1 (glucagon-like peptide – 1) μπορεί να ελαττώσει την
μεταγευματική υπεργλυκαιμία βοηθώντας το πάγκρεας να εκκρίνει ινσουλίνη και
καθυστερώντας την μετακίνηση της τροφής από το στομάχι στο έντερο. Το GLP-1
όμως έχει τόσο μικρό χρόνο δράσης που στην πράξη είναι αδύνατο να
χρησιμοποιηθεί σαν φάρμακο. Σύμφωνα με πρόσφατη έρευνα από την Δανία φαίνεται
πως στρεφόμαστε προς αυτή την κατεύθυνση. Οι ερευνητές μελέτησαν το ΝΝ2211, μια
ουσία που προέρχεται από το GLP-1. Όπως και το GLP-1 το ΝΝ2211 μειώνει την
αιχμή της γλυκόζης του αίματος, παραμένει όμως δραστικό στην κυκλοφορία για
μεγαλύτερο χρονικό διάστημα. Οι ερευνητές αναρωτιούνται αν μπορεί να
χρησιμοποιηθεί σαν φαρμακευτική αγωγή για τον διαβήτη τύπου ΙΙ, χορηγούμενο εφ’
άπαξ ημερησίως. Έντεκα άνδρες και γυναίκες με διαβήτη τύπου ΙΙ συμμετείχαν στην
μελέτη. Καθένας τους συμμετείχε σε ολονύκτια πειράματα κατά τα οποία
συγκρίνονταν η θεραπεία με ενέσιμη χορήγηση του NN2211 με την θεραπεία με
εικονικό φάρμακο. Τα άτομα τα οποία ελάμβαναν οποιαδήποτε άλλη φαρμακευτική
αγωγή για τη ρύθμιση του διαβήτη τους ζητήθηκε να τη διακόψουν δύο μέρες πριν
από κάθε πείραμα. Το βράδυ πριν από κάθε πείραμα οι συμμετέχοντες έτρωγαν δείπνο
στις 6.00 μμ. Δεν έτρωγαν και δεν έπιναν τίποτα μέχρι τις 10.00 μμ οπότε και
έρχονταν στο νοσοκομείο. Τα επίπεδα γλυκόζης πλάσματος ελέγχονταν εκείνη την
ώρα. Στις 11.00 μμ χορηγούνταν σε ενέσιμη μορφή είτε το ΝΝ2211 είτε το εικονικό
φάρμακο. Τα επίπεδα γλυκόζης και τα επίπεδα ινσουλίνης καταγράφονταν κατά την
διάρκεια της νύκτας. Μέτρηση γλυκόζης πλάσματος νηστείας γινόταν την άλλη μέρα
το πρωί. Στις 11.30 πμ, την επόμενη της ένεσης, οι ασθενείς έπαιρναν ένα γεύμα
που περιείχε ένα ειδικό συστατικό με το οποίο οι ερευνητές μπορούσαν να δουν
πόσο γρήγορα περνούσε η τροφή από το στομάχι. Δείγματα αίματος λαμβάνονταν κάθε
15-30 λεπτά για τις επόμενες 4 ώρες προκειμένου να προσδιοριστούν επίπεδα
γλυκόζης και ινσουλίνης αίματος και να καταγραφεί η κινητικότητα της τροφής. Τα
αποτελέσματα κατέδειξαν ότι χορήγηση μίας μόνο ένεσης GLP-1 πριν από την
κατάκλιση ήταν αρκετή για να διατηρήσει τα επίπεδα γλυκόζης χαμηλά για όλη την
ημέρα. Τα επίπεδα γλυκόζης των συμμετεχόντων ήταν κατά μέσο όρο 158,4 mg/l το
απόγευμα πριν την αγωγή. Μετά την χορήγηση τόσο του εικονικού φαρμάκου όσο και
του ΝΝ2211 τα επίπεδα γλυκόζης του αίματος έπεφταν, όμως η μείωσή τους ήταν
μεγαλύτερη με το ΝΝ2211. Επίσης, η έκκριση ινσουλίνης ήταν υψηλότερη κατά την
διάρκεια της νύκτας σε αυτούς που έπαιρναν το ΝΝ2211. Τα επίπεδα γλυκόζης ήταν
σημαντικά χαμηλότερα καθ όλη τη διάρκεια της επόμενης ημέρας μετά από την
χορήγηση του ΝΝ2211 απ’ ότι μετά από τη χορήγηση εικονικού φαρμάκου. Η μέση
τιμή της γλυκόζης αίματος νηστείας ήταν 124,2 mg/l γι αυτούς που έλαβαν το
ΝΝ2211 και 145,8 mg/l για αυτούς που έλαβαν εικονικό φάρμακο. Μετά το φαγητό η
γλυκόζη αίματος ήταν 23% χαμηλότερη σε αυτούς που πήραν το ΝΝ2211 σε σχέση με
αυτούς που έλαβαν εικονικό φάρμακο. Το ΝΝ2211 φάνηκε να δρα με όπως ανέμενε η ερευνητική
ομάδα. Η μελέτη έδειξε ότι η αγωγή με ΝΝ2211 είχε σαν αποτέλεσμα την
καθυστέρηση της διόδου της τροφής από το στομάχι. Επιπλέον, εκκρίνονταν
περισσότερη ινσουλίνη σαν απόκριση στο ερέθισμα της τροφής σε αυτούς που
χορηγήθηκε ΝΝ2211 αντί για εικονικό φάρμακο.[ρ]
Ανακάλυψη νέας ορμόνης σε
σχέση με το διαβήτη.
Μια νέα ορμόνη ανακαλύφθηκε από Αμερικανούς ερευνητές και η
οποία ονομάστηκε resistin που στα Ελληνικά θα μπορούσε να μεταφραστεί σαν
ανθεκτικίνη ή ακόμα αντιστασίνη. Η ορμόνη αυτή εκκρίνεται από τα λιποκύτταρα
και δημιουργεί αντίσταση στην ινσουλίνη.
Η δράση της, η οποία της δίνει και το όνομα της, είναι να
εμποδίζει την ινσουλίνη από το να διευκολύνει την είσοδο της γλυκόζης στα
κύτταρα με αποτέλεσμα τα επίπεδα γλυκόζης στο αίμα να αυξάνονται και να
δημιουργείται η σοβαρή ασθένεια του διαβήτη.
Στον διαβήτη τύπου 2 υπάρχει αντίσταση από τα κύτταρα του
οργανισμού στην δράση της ινσουλίνης. Οι ερευνητές στην πολύ σημαντική αυτή
ανακάλυψή τους απέδειξαν ότι τα λιποκύτταρα εκκρίνουν την resistin η οποία
είναι υπεύθυνη για την ανεπάρκεια της δράσης της ινσουλίνης.
Όταν χορήγησαν σε πειραματόζωα αντισώματα εναντίον της resistin
τα επίπεδα της μειώθηκαν στο αίμα με αποτέλεσμα τη μείωση των επιπέδων γλυκόζης
μέσα στο αίμα. Επίσης το αντί-διαβητικό φάρμακο rosiglitazone αποδείχτηκε ότι
μειώνει τα επίπεδα της resistin.
Επίσης η χορήγηση συνθετικής μορφής της ορμόνης αυτής σε
πειραματόζωα τους δημιουργεί διαβήτη.
Τα επίπεδα της resistin στο αίμα αυξάνονται από την παχυσαρκία
που δημιουργείται λόγω κακής διατροφής ή υπερφαγίας ή ακόμα στις περιπτώσεις
κληρονομικής παχυσαρκείας.
Τα αποτελέσματα αυτά δείχνουν ότι υπάρχει μια άμεση σχέση μεταξύ
διαβήτη και παχυσαρκίας που δημιουργείται μέσω της δράσης της νέας αυτής
ορμόνης. Η resistin συνθέτεται και εκκρίνεται από τα λιποκύτταρα.
Αναμφίβολα πρόκειται εδώ για πολύ σημαντική ανακάλυψη. Σίγουρα
θα ακολουθήσουν και άλλες μελέτες του ιδίου θέματος που προσπαθήσουν να
διαλευκάνουν περισσότερο την δράση της resistin και να απαντήσουν πολλά από τα
ερωτήματα που είναι αναπάντητα και αφορούν τη φυσιολογία της. Οι εξελίξεις
αυτές ίσως οδηγήσουν σε μια νέα μορφή θεραπείας εναντίον του διαβήτη,
περισσότερο επιλεκτική και πιο αποτελεσματική.[σ]
Τα βλαστικά κύτταρα μπορούν
να αντικαταστήσουν τα κύτταρα στο πάγκρεας που δεν παράγουν ινσουλίνη
Ανεξάρτητα από τα συναισθηματικά και θρησκευτικά ζητήματα που
περιβάλλουν τη θεραπεία βλαστικών κυττάρων, οι επιστήμονες είναι βέβαιοι ότι η
έρευνα των βλαστικών κυττάρων θα ανοίξει το δρόμο στην κατανόηση και τη
θεραπεία πολλών ανθρώπων που πάσχουν σήμερα από ασθένειες.
Μια ασθένεια που θα μπορούσε να ωφεληθεί από μια τέτοια έρευνα
είναι διαβήτης.
Οι ασθενείς με τον τύπο Ι είναι ανίκανοι να παραγάγουν την ινσουλίνη.
Οι ασθενείς τύπου Ι έχουν μια έλλειψη λειτουργίας βήτα κυττάρων. Αυτή η αυτοάνοση
ανεπάρκεια αφήνει το σώμα να επιτεθεί στα κύτταρα του πάγκρεας έτσι ώστε αυτό
να μην μπορεί πλέον να παραγάγει την ινσουλίνη από μόνο του.
Αν και η έρευνα βλαστικών κυττάρων απέχει ακόμα 15 έως 20 έτη από
την εύρεση μιας θεραπείας, ο διαβήτης είναι μια ασθένεια που αναμένεται να
ενισχυθεί από την έρευνα των βλαστικών κυττάρων. Ο στόχος είναι να αναπτυχθούν
τα βλαστικά κύτταρα που μπορούν να αντικαταστήσουν τα κύτταρα στο πάγκρεας που
δεν παράγουν την ινσουλίνη.[τ]
Νέες θεραπείες για διαβήτη:
Μεταμόσχευση αρχεγόνων κυττάρων
Οι θεραπείες που προσφέρονται σήμερα, παρά το γεγονός ότι
μπορούν να προσφέρουν τα μέγιστα περιορίζοντας στο ελάχιστο τον κίνδυνο
επιπλοκών, εντούτοις είναι δύσκολες και μπορούν να μειώνουν την ποιότητα ζωής
των ασθενών.
Το γεγονός αυτό είναι ακόμη πιο έντονο στους ασθενείς με διαβήτη
τύπου Ι. Για το λόγο αυτό συνεχίζονται με εντατικό ρυθμό οι έρευνες που στόχο
έχουν να βρουν νέους τρόπους αποτελεσματικής αντιμετώπισης με λιγότερες
δυσκολίες για τους ασθενείς.
Η μεταμόσχευση κυττάρων τύπου β, στο πάγκρεας είναι μια
ελκυστική ιδέα. Πράγματι η αντικατάσταση των απολεσθέντων κυττάρων που παράγουν
ινσουλίνη, με νέα κύτταρα μπορεί να λύσει ριζικά το πρόβλημα.
Οι πρώτες προσπάθειες που έγιναν, έκαναν χρήση κυττάρων τύπου β,
από δότες. Η μέθοδος αυτή έχει σοβαρά μειονεκτήματα. Το κυριότερο είναι ότι για
να αποφευχθεί η απόρριψη του μοσχεύματος, επιβάλλεται να παίρνει ο ασθενής
ανοσοκατασταλτικά φάρμακα.
Τα φάρμακα αυτά μειώνουν την άμυνα του οργανισμού και εμποδίζουν
την απόρριψη του μοσχεύματος από τον ξένο δότη. Παράλληλα όμως έχουν κινδύνους.
Μειώνοντας την άμυνα, αυξάνουν τον κίνδυνο μολύνσεων. Επιπρόσθετα η μείωση της
άμυνας του οργανισμού αυξάνει τον κίνδυνο εμφάνισης καρκίνου.
Η αλλογενής μεταμόσχευση (δηλαδή από δότη) έχει προβλήματα. Για
το λόγο αυτό, οι ερευνητές στράφηκαν προς άλλες πηγές κυττάρων τύπου β που
είναι ικανά να παράγουν ινσουλίνη.
Τα αρχέγονα κύτταρα του μυελού των οστών είναι ικανά να
διαφοροποιηθούν και να μετασχηματισθούν σε σχεδόν οποιαδήποτε άλλη λειτουργική
ομάδα κυττάρων του οργανισμού.
Η σημαντική αυτή ανακάλυψη
έγινε κατά τα τελευταία χρόνια. Ήταν αποτέλεσμα των σημαντικών επιτυχιών και
των ανακαλύψεων που επιτεύχθηκαν λόγω των μεταμοσχεύσεων μυελού των οστών σε
λευχαιμικούς και άλλους καρκινοπαθείς.
Σήμερα θεωρείται ότι πιθανόν στο σύντομο μέλλον, τα αρχέγονα
πολυδύναμα κύτταρα του μυελού των οστών, θα μπορούν να χρησιμοποιούνται για τη
θεραπεία και αντιμετώπιση πολλών ασθενειών που απειλούν τη ζωή ή που προκαλούν
βλάβες στον οργανισμό.
Ήδη άρχισαν να δημιουργούνται τράπεζες όπου συλλέγονται τέτοια
κύτταρα, είτε από έμβρυα είτε από ενήλικες.
Ποια είναι όμως η σημασία και
οι εφαρμογές των αρχεγόνων κυττάρων για την αντιμετώπιση του διαβήτη και
ιδιαίτερα για το διαβήτη τύπου Ι;
Πρόσφατες έρευνες έδειξαν ότι αρχέγονα κύτταρα από το μυελό των
οστών των διαβητικών ασθενών, μπορούν να διαφοροποιηθούν και να μετεξελιχθούν
σε κύτταρα τύπου β του παγκρέατος που παράγουν ινσουλίνη. Σε διάφορες
εργαστηριακές δοκιμές, οι επιστήμονες κατάφεραν να τροποποιήσουν τα αρχέγονα
κύτταρα από ασθενείς διαβητικούς και να τα ωθήσουν στο να γίνουν κύτταρα τύπου
β του παγκρέατος.
Η πρακτική σημασία της ανακάλυψης αυτής, είναι πολύ μεγάλη. Εάν
τα κύτταρα αυτά μπορούν να παραχθούν από ένα διαβητικό, να είναι πλήρως
λειτουργικά και στη συνέχεια να μεταμοσχευτούν στο πάγκρεας του ίδιου
διαβητικού, τότε θα έχουμε τουλάχιστον δύο πολύ θετικά αποτελέσματα.
Αρχικά για το διαβητικό τύπου Ι, θα έχουμε καινούργια παραγωγή
ινσουλίνης, γεγονός που θα ρυθμίσει την ασθένεια χωρίς πλέον να χρειάζονται
ενέσεις ινσουλίνης.
Επιπρόσθετα δεν χρειάζονται ανοσοκατασταλτικά φάρμακα. Επειδή τα
κύτταρα προέρχονται από τον ίδιο τον ασθενή, δεν θα υπάρχει ο κίνδυνος της
απόρριψης. Έτσι αποφεύγονται πλήρως, οι μεγάλοι κίνδυνοι των ανοσοκατασταλτικών
φαρμάκων.
Βλέπουμε λοιπόν ότι οι προεκτάσεις των θεραπειών με τα αυτόλογα
(δηλαδή από τον ίδιο ασθενή) αρχέγονα κύτταρα του μυελού των οστών είναι
τεράστιες. Φανταστείτε τα εξαιρετικά πλεονεκτήματα της μεθόδου αυτής για τα
τόσα πολλά μικρά παιδιά που πλήττονται καθημερινά από το διαβήτη τύπου Ι.
Οι προοπτικές είναι καλές. Όμως βρισκόμαστε στα πειραματικά
στάδια. Θα αναμένουμε τις πρώτες κλινικές δοκιμές σε ασθενείς για να δούμε
πλέον στην πράξη κατά πόσο επαληθεύονται οι επιστημονικές προβλέψεις.
Μέχρι τότε οι ασθενείς, με διαβήτη τύπου Ι ή τύπου ΙΙ, θα πρέπει
να εφαρμόζουν με μεγάλη προσοχή τις σύγχρονες θεραπείες που προσφέρονται, διότι
αποτελούν σήμερα τον καλύτερο τρόπο προστασίας τους.[υ,ω2]
Η θεραπεία με βλαστικά
κύτταρα καθορίζει το διαβητικό έλκος και αποτρέπει τον ακρωτηριασμό

68 χρονη διαβητικός, επιδίωκε επεξεργασία για την δυσάρεστη πληγή
του, αλλά κάθε αξιοσέβαστος ιατρός του είπε ότι το πόδι θα έπρεπε να ακρωτηριαστεί.
Και θα έπρεπε να συμβεί γρήγορα, για να μην διαδοθεί το έλκος περαιτέρω και
γίνει γάγκραινα.
Η Vamal επισκέφτηκε τον αγγειακό χειρούργο S.R. Subrammaniyan στο
Vijaya
Hospital, Chennai. Ο Subrammaniyan, που συνεργάζεται στενά με
μια ερευνητική δυνατότητα χρήσης βλαστικών-κυττάρων, κατέληξε στο συμπέρασμα
ότι μια πειραματική επεξεργασία που περιλαμβάνει τα βλαστικά κύτταρα που
συγκομίζονται από μυελό των οστών της Vamal θα μπορούσε να είναι αυτή η μόνη ελπίδα για τη διάσωση του
ποδιού. Ένα αγγειογράφημα παρουσίασε ότι δεν είχε σχεδόν καμία κυκλοφορία στο
άκρο.

Ο
αγγειακός χειρούργος Δρ S.R. Subrammaniyan δοκίμασε μια πειραματική επεξεργασία
χρησιμοποιώντας βλαστικά κύτταρα από τον μυελό των οστών του ασθενούς. Το πόδι
άρχισε σύντομα να θεραπεύεται.
Μετά από μια προετοιμασία της πληγής, ο Subrammaniyan ενέχυσε με
βλαστικά κύτταρα το πόδι της Vamal δύο φορές κατά τη διάρκεια της περασμένης
εβδομάδας και περιμένοντας αγωνιωδώς στοιχεία βελτίωσης. Επειδή η πληγή ήταν
τόσο μεγάλη, μεταμόσχευσε επίσης ένα κομμάτι του δέρματος από το μηρό της πέρα
από το έλκος. Τα αποτελέσματα δεν ήταν τίποτα λιγότερο από θαυμαστά. Μέσα σε 60
ημέρες, το έλκος είχε ορατά θεραπευθεί. Τα βλαστικά κύτταρα είχαν ανασχηματίσει
προφανώς σημαντικά τμήματα του ατροφημένου κυκλοφοριακού συστήματός της.
Βεβαίως μια απομονωμένη επιτυχημένη περίπτωση δεν δηλώνει
απαραιτήτως και μια επανάσταση στην επεξεργασία των ελκών. Αλλά οι πάσχοντες από
διαβήτη θα μπορούσαν να χρησιμοποιήσουν αυτόν τον τύπο ιατρικής σημαντικής
ανακάλυψης που προέκειψε από την αποκατάσταση της Vamal.

Ο αριθμός των διαβητικών βρίσκεται σε άνοδο σε όλο τον κόσμο,
και ο ακρωτηριασμός είναι συχνά η μόνη επιλογή που αφήνεται στους γιατρούς για
να θεραπεύουν τους ασθενείς με κρίσιμη ισχαιμία άκρων, ένας όρος που
αναπτύσσεται στους ανθρώπους με τη σοβαρά μειωμένη ροή αίματος στα χαμηλότερα
άκρα τους. Το πρόβλημα αυτό είναι μια ιδιαίτερα δραματική συνέπεια του διαβήτη.
Σύμφωνα με την αμερικανική ένωση διαβήτη, οι ασθενείς με το
διαβήτη υποβάλλονται σε 60 τοις εκατό των μη-τραύμα-προκληθέντων ακρωτηριασμών
στις Ηνωμένες Πολιτείες, που ανέρχονται συνολικά σε 82.000 απομακρυσμένα άκρα
το 2002, Προς το παρόν, οι καλύτερες επεξεργασίες για τους διαβητικούς με την
κρίσιμη ισχαιμία άκρων είναι η χειρουργική επέμβαση για να παρακάμψουν τις
ατροφημένες αρτηρίες και ορισμένες θεραπευτικές αγωγές με φάρμακα που δεν είναι
πάντα αποτελεσματικές. Για τον Subrammaniyan, τα βλαστικά κύτταρα θα είναι ένα
απαραίτητο κομμάτι του μέλλοντος.[φ]
Εμβόλιο για τον διαβήτη
Μια εντυπωσιακή επιστημονική ανακάλυψη, που ενδιαφέρει σημαντικό
τμήμα του πληθυσμού, ανακοινώθηκε. Πρόκειται για μια ανακάλυψη που δίνει νέες
ελπίδες για θεραπεία του διαβήτη με εμβόλιο. Η Βρετανίδα ερευνήτρια δρ. Σούζαν
Ουόγκ, η οποία εργάζεται στην Ιατρική Σχολή του Πανεπιστημίου Γέηλ, πιστεύει
ότι βρήκε τον τρόπο με τον οποίο τα κύτταρα από το ανοσοποιητικό σύστημα του
σώματος επιτίθενται και προκαλούν ζημιά στα κύτταρα που έχουν ως αποστολή να
παράγουν την ινσουλίνη. Η ερευνητική ομάδα της Σούζαν Ουόγκ ανακάλυψε ένα μόριο
που μπορεί να κινητοποιήσει την άμυνα του οργανισμού σε ενδεχόμενη επίθεση, και
ελπίζουν ότι θα γίνει δυνατό να χορηγηθεί το μόριο αυτό με τη μορφή θεραπείας,
η οποία θα το κάνει αποδεκτό από το ανοσοποιητικό σύστημα. Τότε το σώμα θα
αφήσει τα κύτταρα που είναι προορισμένα να παράγουν ινσουλίνη να κάνουν τη
δουλειά τους και δεν χρειάζονται πλέον οι ενέσεις για τη διατήρηση της
ισορροπίας. [χ]
Διαβήτης τύπου Ι και πρωτείνη
DiaPep277
Μια νέα πολλά υποσχόμενη νέα θεραπεία για το διαβήτη τύπου Ι,
μας παρουσιάζουν τώρα Ισραηλινοί γιατροί μέσα από μια εργασία τους που δημοσιεύεται
στο έγκυρο ιατρικό περιοδικό The Lancet σήμερα.
Ο διαβήτης τύπου Ι που συνήθως συμβαίνει σε άτομα νεαρής ηλικίας
οφείλεται σε ένα αυτοάνοσο μηχανισμό. Αυτό σημαίνει ότι ο ίδιος ο οργανισμός
παράγει αντισώματα εναντίον των δικών του κυττάρων τα οποία παράγουν την
ινσουλίνη.
Τα κύτταρα τύπου β του παγκρέατος που παράγουν την ινσουλίνη,
καταστρέφονται από το ανοσοποιητικό αμυντικό σύστημα του οργανισμού λόγω της
αυτοάνοσης διαταραχής. Η έλλειψη της ινσουλίνης δημιουργεί το διαβήτη.
Μέχρι σήμερα η μόνη θεραπεία που υπήρχε για τον διαβήτη τύπου Ι
ήταν η ινσουλίνη η οποία γίνεται με ενέσεις.
Υπενθυμίζουμε ότι ο διαβήτης τύπου ΙΙ, εκδηλώνεται κυρίως σε
μεγαλύτερης ηλικίας άτομα, είναι πολύ συχνότερος και συσχετίζεται με τη
παχυσαρκία. Δεν οφείλεται στην καταστροφή των κυττάρων που παράγουν την
ινσουλίνη με σημαντική μείωση της παραγωγής της αλλά περισσότερο σε μια
ανθεκτικότητα της δράσης της που δημιουργείται πάνω στα κύτταρα του οργανισμού.
Οι Ισραηλινοί γιατροί
δημοσιεύουν ότι έχουν αναπτύξει μια πρωτείνη, την οποία ονόμασαν DiaPep277, η
οποία έχει την ικανότητα να καταστέλλει την καταστροφική δραστηριότητα του
ανοσολογικού συστήματος του οργανισμού εναντίον των β κυττάρων του παγκρέατος
που παράγουν την ινσουλίνη.
Οι γιατροί δοκίμασαν την θεραπεία αυτή χορηγώντας την πρωτείνη
DiaPep277 σε 35 ασθενείς με διαβήτη τύπου 1 που μόλις είχε διαγνωστεί για
περίοδο 10 μηνών. Σύγκριναν τα αποτελέσματα της μεθόδου αυτής με τα
αποτελέσματα που προκύπτουν μετά από τη χορήγηση ενός εικονικού φαρμάκου.
Εκείνο που παρατήρησαν στους ασθενείς που ελάμβαναν τις ενέσεις
της πρωτείνης DiaPep277 ήταν ότι η παραγωγή της ινσουλίνης δεν μειωνόταν ενώ οι
ανάγκες τους σε ινσουλίνη χαμήλωναν. Σε αντίθεση στους ασθενείς που έπαιρναν το
εικονικό φάρμακο, η παραγωγή μειωνόταν και οι ανάγκες τους σε εξωγενή ινσουλίνη
αυξανόταν.
Το συμπέρασμα τους είναι ότι η πρωτείνη DiaPep277 έχει την
ιδιότητα να προστατεύει τα κύτταρα β του παγκρέατος που παράγουν την ινσουλίνη.
Πιστεύουν ότι το κάνει αυτό δια μέσου μιας διαφοροποιητικής
δράσης που εξασκεί πάνω στο ανοσοποιητικό σύστημα και ιδιαίτερα πάνω στα
λεμφοκύτταρα τύπου Τ.
Φαίνεται ότι σταματά την εξέλιξη της νόσου με αποτέλεσμα να
μειώνονται οι ανάγκες σε ινσουλίνη του ασθενούς. Η θεραπεία δεν θα φέρει πίσω
τα κύτταρα τα οποία έχουν ήδη καταστραφεί αλλά θα μπορέσει να διαφυλάξει αυτά
τα οποία ακόμη ήδη υπάρχουν.
Όπως αναφέρουν οι ερευνητές η θεραπεία αυτή αποτελεί μια
καινοτομική προσέγγιση του διαβήτη διότι δεν αντιμετωπίζονται μόνο τα
συμπτώματα της νόσου αλλά αντιμετωπίζεται αιτιολογικά ο μηχανισμός που
δημιουργεί την ασθένεια.
Με βάση τα δεδομένα αυτά δημιουργείται το ερώτημα εάν έχουμε
πράγματι μπροστά μας μια νέα σημαντική θεραπεία που να αλλάζει τα δεδομένα στον
τομέα του διαβήτη.
Νομίζουμε ότι ενώ πράγματι η
θεραπεία αυτή υπόσχεται πολλά και είναι εντυπωσιακή, εντούτοις ο αριθμός των
ασθενών στους οποίους έγινε η μελέτη είναι πολύ μικρός και χρειάζονται
πολυκεντρικές μεγάλες μελέτες για να φανεί και η αποτελεσματικότητα και οι
κίνδυνοι μιας τέτοιας θεραπείας.
Σύμφωνα με τους ερευνητές αναμένεται μέσα στο 2002 να αρχίσουν
οι πρώτες μεγάλες κλινικές έρευνες στις Ηνωμένες Πολιτείες και θα αναμένουμε με
ενδιαφέρον τα αποτελέσματα. [ω4]
Νέο φάρμακο για τη θεραπεία
του διαβήτη τύπου ΙΙ
Πρόσφατα κυκλοφόρησε στην Ελλάδα απ' την εταιρεία Novo Nordisk
το Novonorm® (ρεπαγλινίδη, Novo Nordisk), ένα νέο φάρμακο για τη θεραπεία του
διαβήτη τύπου ΙΙ. Το φάρμακο αυτό είναι παράγωγο του βενζοϊκού οξέος και ανήκει
σε μια νέα κατηγορία φαρμάκων που ονομάζονται μεγλιτινίδες. Ανήκει στην
κατηγορία των υπογλυκαιμικών φαρμάκων που αυξάνουν την έκκριση ινσουλίνης από
τα β-κύτταρα. Διαφέρει από τις σουλφονυλουρίες γιατί αυξάνει την έκκριση
ινσουλίνης μόνο εφόσον το σάκχαρο του αίματος είναι αυξημένο. Επιπλέον,
συνδέονται στα β-κύτταρα σε υποδοχείς που είναι διαφορετικοί από τους υποδοχείς
των σουλφονυλουριών και κλείνει τους διαύλους του καλίου που είναι ευαίσθητοι
στις ενδοκυττάριες συγκεντρώσεις του ΑΤΡ.
Απορροφάται γρήγορα, ανεξάρτητα από τη δόση, μετά τη χορήγηση
από του στόματος. Η μεγαλύτερη συγκέντρωση στο πλάσμα παρατηρείται στη μισή ώρα
και η διάρκεια δράσης 3-4 ώρες. Μεταβολίζεται γρήγορα στο ήπαρ σε αδρανείς
μεταβολίτες που αποβάλλονται κατά κύριο λόγο (90%) στα κόπρανα. Βελτιώνει την
πρώτη ή ταχεία φάση της ινσουλινοέκκρισης, η οποία είναι "οκνηρή" στο
διαβήτη τύπου ΙΙ. Τα φάρμακα αυτά δεν είναι δραστικά όταν δε λαμβάνονται
γεύματα και όταν παραλείπεται το γεύμα παραλείπεται και η λήψη του φαρμάκου. Το
φάρμακο είναι ιδιαίτερα αποτελεσματικό στη μείωση του σακχάρου του αίματος μετά
τα γεύματα. Η μεταγευματική αυτή μείωση του σακχάρου του αίματος σήμερα
θεωρείται ότι είναι πολύ ευεργετική στη μείωση των μακροαγγειοπαθητικών
επιπλοκών του διαβήτη. Η ρεπαγλινίδη κυκλοφορεί σε δισκία των 0,5mg, 1 mg και 2
mg. Τα δισκία λαμβάνονται 15 λεπτά ή αμέσως προ των γευμάτων.
Η μακροχρόνια χορήγηση της ρεπαγλινίδης ως μονοθεραπεία μειώνει
-κατά μέσο όρο- το σάκχαρο νηστείας κατά 70mg/dl και την HBA1c κατά 1,7%. Όταν
το φάρμακο χορηγείται μαζί με μετφορμίνη, με ινσουλίνη ενδιάμεσης δράσης ή με
θειαζολιδινεδιόνες παρατηρείται μεγαλύτερη μείωση του σακχάρου και της ΗΒΑ1c. Η
χορήγηση για ένα έτος της ρεπαγλινίδης έδειξε ότι η ρεπαγλινίδη έχει την ίδια
αποτελεσματικότητα με τη γλιβενκλαμίδη (Daonil) και τη γλικλαζίδη (Diamicron).
Η ρεπαγλινίδη έχει χορηγηθεί μαζί με δακτυλίτιδα, κουμαρινικά αντιπηκτικά,
σιμετιδίνη και θεοφυλλίνη και δεν έχει παρατηρηθεί αλληλεπίδραση με τα φάρμακα
αυτά.
Από απόψεως παρενεργειών το φάρμακο προκαλεί υπογλυκαιμίες, οι
οποίες όμως είναι λιγότερο συχνές-ιδιαίτερα οι βαριές υπογλυκαιμίες- σε σχέση με
τις σουλφονυλουρίες. Όσον αφορά στην αύξηση του σωματικού βάρους, πρόσφατα
βιβλιογραφικά στοιχεία δείχνουν ότι αυτή είναι πολύ μικρή.
Η ρεπαγλινίδη χορηγείται με προσοχή και πάντοτε αρχίζοντας από
τις μικρότερες δόσεις σε άτομα που έχουν μικρού βαθμού ηπατική βλάβη, ενώ η
χρήση της είναι ασφαλής και στα ηλικιωμένα άτομα με διαβήτη τύπου ΙΙ. Παρόλο
που το φάρμακο μεταβολίζεται στο ήπαρ, έχουν παρατηρηθεί αυξημένες
συγκεντρώσεις του φαρμάκου στο αίμα σε άτομα με νεφρική ανεπάρκεια. Γι' αυτό το
λόγο σ' αυτά τα άτομα το φάρμακο πρέπει να χορηγείται αρχίζοντας με μικρότερες
δόσεις. [ψ]
Το μονοκλωνικό αντίσωμα (anti-CD3) σταματά το διαβήτη τύπου
Ι
Μια πρόσφατη, πολύ σημαντική εξέλιξη στη θεραπεία του διαβήτη
τύπου 1, δίνει νέες ελπίδες για την αποτελεσματική καταπολέμηση με
σταθεροποίηση και ίσως ίαση, της σοβαρής αυτής ασθένειας.
Η νέα θεραπεία βασίζεται στο μονοκλωνικό αντίσωμα CD3
(anti-CD3), το οποίο καταστέλλει το μηχανισμό που καταστρέφει τα κύτταρα που
παράγουν την ινσουλίνη στο διαβήτη τύπου 1.
Ο διαβήτης τύπου Ι, που συνήθως εκδηλώνεται σε παιδιά και άτομα
νεαρής ηλικίας, είναι μια χρόνια αυτοάνοση ασθένεια.
Αυτό σημαίνει ότι ο ίδιος ο οργανισμός του ασθενούς, παράγει δια
μέσου του ανοσοποιητικού του συστήματος, αντισώματα τα οποία καταστρέφουν τα
κύτταρα τύπου β του παγκρέατος που παράγουν την ινσουλίνη.
Η αρχική, μερική έλλειψη της ινσουλίνης, εξελίσσεται σε πλήρη
ανεπάρκεια παραγωγής της, με αποτέλεσμα την εγκατάσταση του σακχαρώδη διαβήτη
τύπου Ι με αυξημένα επίπεδα γλυκόζης στο αίμα.
Ο μηχανισμός καταστροφής των κυττάρων τύπου β του παγκρέατος που
παράγουν την ινσουλίνη, βασίζεται κυρίως στην παθολογική δράση ορισμένων
λεμφοκυττάρων τύπου Τ που είναι μέρος του ανοσοποιητικού συστήματος.
Το νέο φάρμακο που χρησιμοποιήθηκε σε 12 ασθενείς, είναι ένα μονοκλωνικό
αντίσωμα, το anti-CD3, που εξουδετερώνει την παθολογική υποομάδα των
λεμφοκυττάρων τύπου Τ.
Η νέα θεραπεία χορηγείται μόνο για 2 εβδομάδες και φαίνεται ότι
έχει την ικανότητα να τροποποιεί το ανοσοποιητικό σύστημα σταματώντας τον
παθολογικό αυτοάνοσο μηχανισμό τουλάχιστο για ένα χρόνο.
Οι ερευνητές συμπεριέλαβαν στην κλινική τους δοκιμή συνολικά 24
ασθενείς, ηλικίας από 7 έως 27 ετών, με διαβήτη τύπου 1.
Οι 12 υποβλήθηκαν, 6 εβδομάδες μετά από τη διάγνωση, σε 14 μέρες
θεραπείας με το νέο φάρμακο anti-CD3, ενώ οι υπόλοιποι έτυχαν της συνήθους
αντιμετώπισης.
Τα αποτελέσματα έδειξαν ότι στους 9 από τους 12 ασθενείς της
ομάδας που πήρε το anti-CD3, η παραγωγή της ινσουλίνης δεν μειώθηκε αλλά
σταθεροποιήθηκε και σε ορισμένους βελτιώθηκε.
Οι ανάγκες των ασθενών σε ενέσεις ινσουλίνης μετά από τη
θεραπεία μειώθηκαν.
Τα ευεργετικά αποτελέσματα του νέου φαρμάκου διατηρήθηκαν για
τουλάχιστο 12 μήνες μετά από τη χορήγηση του.
Αντίθετα, στους υπόλοιπους 12 ασθενείς που δεν πήραν το
anti-CD3, μόνο 2 διατήρησαν την ίδια παραγωγή της ινσουλίνης ενώ στους άλλους
10, η παραγωγή ινσουλίνης μειώθηκε.
Το νέο φάρμακο δεν είχε σοβαρές παρενέργειες.
Οι συχνότερες επιπλοκές που παρατηρήθηκαν ήσαν πυρετός, αναιμία
και εξάνθημα. Παρατηρήθηκαν επίσης σε βιολογικό επίπεδο μια μείωση του αριθμού
των άλλων ομάδων των λεμφοκυττάρων τύπου Τ, CD4 και CD8.
Τα συμπεράσματα των ερευνητών είναι ότι το φάρμακο anti-CD3,
έχει την ιδιότητα να σταθεροποιεί την παραγωγή της ινσουλίνης. Αποτρέπει την
περαιτέρω επιδείνωση, είτε διότι επιδρά άμεσα εναντίον των παθολογικών
λεμφοκυττάρων που είναι υπεύθυνα για την καταστροφή των κυττάρων τύπου β είτε
διότι βοηθά στη δημιουργία ρυθμιστικών κυττάρων. Ίσως ακόμη να συνυπάρχουν και
οι δύο μηχανισμοί.
Επισημαίνεται ότι και παλαιότερα χρησιμοποιήθηκαν φάρμακα που
καταστέλλουν το ανοσοποιητικό σύστημα για αντιμετώπιση με βάση τις ίδιες αρχές,
του διαβήτη τύπου 1.
Όμως τα φάρμακα εκείνα δεν είχαν ένα ειδικό στόχο όπως το
anti-CD3, με αποτέλεσμα να γίνεται μια ευρεία καταστολή. Παράλληλα τα φάρμακα
έπρεπε να χορηγούνται πάνω σε χρόνια βάση.
Οι κίνδυνοι εκείνης της προσέγγισης, μαζί με τα προβλήματα της
αποτελεσματικότητας, είναι σημαντικοί. Ιδιαίτερα τονίζονται οι κίνδυνοι από
ευκαιριακές λοιμώξεις σε ανοσοκατασταλμένους και ο κίνδυνος εκδήλωσης καρκίνου.
Εκείνο που παραμένει άγνωστο ακόμη είναι το για πόσο χρονικό
διάστημα θα διατηρηθεί η προστασία που δίνει το anti-CD3 από τον παθολογικό
αυτοάνοσο μηχανισμό.
Να σημειωθεί ότι έχει ήδη αρχίσει μια νέα ευρύτερη κλινική
θεραπευτική δοκιμή, με μεγαλύτερο αριθμό ασθενών για να φανεί εάν
επιβεβαιώνονται τα πρώτα ενθαρρυντικά αποτελέσματα.
Η νέα αυτή θεραπεία πιθανόν να έχει μια δραματική επίδραση στην
αντιμετώπιση, εξέλιξη και ίαση των ασθενών με διαβήτη τύπου Ι.
Αναμφίβολα θα πρέπει αναμένουμε, με μεγάλο ενδιαφέρον, τα
αποτελέσματα των νέων θεραπευτικών δοκιμών με το anti-CD3, για να επιβεβαιωθούν
η αποτελεσματικότητα, η ασφάλεια και η διάρκεια προστασίας που παρέχει το νέο
φάρμακο. [ω1]
Αναίμακτη χορήγηση
ινσουλίνης
Αρκετές φαρμακευτικές εταιρείες σημειώνουν προόδους στην
προσπάθεια να προσφέρουν ινσουλίνη χωρίς ενέσεις στα άτομα με διαβήτη. Φαίνεται
όμως ότι μερικά χρόνια μας χωρίζουν από τη γραμμή τερματισμού. Ο πρόεδρος της
American Diabetes Association Christopher Saudek, καθηγητής στην Ιατρική Σχολή
του Πανεπιστημίου Johns Hopkins σχολίασε ότι "οι εταιρείες ευρίσκονται σε
διαφορετικά στάδια αναπτύξεως και καλό είναι τα άτομα με διαβήτη να
χρησιμοποιούν για τη ρύθμισή τους ότι καλύτερο είναι διαθέσιμο σήμερα".
Πρόσθεσε μάλιστα ότι από τα 17 εκατομμύρια άτομα με διαβήτη στις ΗΠΑ, περίπου
3.7 εκατομμύρια χρειάζονται καθημερινές ενέσεις ινσουλίνης για να ρυθμίζουν τα
επίπεδα της γλυκόζης στο αίμα τους και για να προλάβουν τις σοβαρές επιπλοκές
του διαβήτη. Μεταξύ των εξελίξεων αναφέρονται:
• Τα δισκία ινσουλίνης.
Οι εταιρείες Nobex Corp. και Emisphere Technologies έχουν αναπτύξει ελαφρώς
διαφορετικές προσεγγίσεις για την παρασκευή δισκίων ινσουλίνης, τα οποία θα
απορροφώνται από το πεπτικό σύστημα χωρίς να διασπώνται. Οι ερευνητές Stephen
Clement του Πανεπιστημίου Georgetown, που παρουσίασε τα αποτελέσματα του
φαρμάκου της εταιρείας Norbex δήλωσε "Είμαστε σε θέση να ρυθμίζουμε το
σάκχαρο αίματος, ίσως για πρώτη φορά, με ινσουλίνη χορηγούμενη από το στόμα. Το
φάρμακο είναι ακόμη στα πρώτα στάδια ανάπτυξης, αλλά φαίνεται να είναι
αποτελεσματικό".
• Αυτοκόλλητο ινσουλίνης.
Σύστημα δύο βαθμίδων, το οποίο χρησιμοποιεί ένα αυτοκόλλητο ινσουλίνης, που
λειτουργεί με μπαταρία, ανοίγει πόρους στο δέρμα και στη συνέχεια απελευθερώνει
την ινσουλίνη μέσω δεύτερου αυτοκόλλητου, αναπτύχθηκε από την εταιρεία Altea
Development Corporation. Σε μικρή μελέτη παρείχε σταθερή ποσότητα ινσουλίνης
για περισσότερο των 12 ωρών.
• Στοματικό spray
ινσουλίνης. Η συσκευή RapidMist της εταιρείας Generex Biotechnology Corp.
επιτρέπει την απορρόφηση της ινσουλίνης από τα κύτταρα της επιφανείας του
στόματος. Ο Pankaj Modi, ερευνητής της Generex, ανακοίνωσε ότι το spray
ινσουλίνης ήταν αποτελεσματικό, όσο και η ενιέμενη ταχείας δράσης ινσουλίνη.
• Εισπνεόμενη ινσουλίνη.
Στον αγώνα για την ανάπτυξη εισπνεόμενης ινσουλίνης μετέχουν πέντε εταιρείες.
Παρουσιάσθηκαν αποτελέσματα με την απορρόφηση ταχείας δράσης μορφής ινσουλίνης,
εισπνεόμενης, είτε σε υγρή, είτε σε μορφή σκόνης, αλλά παραμένει το ερώτημα της
ασφάλειας χορήγησής της μακροχρόνια.[ω6]
Νέες ελπίδες από
εισπνεόμενη ινσουλίνη
Νέα δεδομένα αναπτερώνουν τις ελπίδες των διαβητικών ασθενών για
μια καλύτερη ποιότητα ζωής χάρις στην εισπνεόμενη ινσουλίνη.
Ίσως να κοντεύει η ημέρα κατά την οποία θα μπορέσουν οι
διαβητικοί να απαλλαχθούν από τις ενέσεις ινσουλίνης που χρειάζονται να κάνουν
μία ή περισσότερες φορές καθημερινά. Ακόμη καλύτερα, η σημαντική αυτή πρόοδος
θα ευεργετήσει όχι μόνο τους διαβητικούς τύπου I άλλά και τους ασθενείς με διαβήτη
τύπου II.
Σε έρευνες που έγιναν προκαταρκτικά, οι οποίες διήρκεσαν 12
εβδομάδες, σε 70 ασθενείς με διαβήτη τύπου I και σε 51 ασθενείς με διαβήτη τύπου II, εξετάστηκε με τυχαιοποιημένο
προοδευτικό τρόπο, η αποτελεσματικότητα της θεραπείας και ο βαθμός αποδοχής της
από τους ασθενείς.
Οι έρευνες αυτές έγιναν σε κέντρο για διαβητικούς ασθενείς στο
Τέξας και έδειξαν ότι η εισπνεόμενη ινσουλίνη ήταν αποτελεσματική κατά το
χρονικό διάστημα της έρευνας. Η αποτελεσματικότητα της θεραπείας κρίθηκε από τα
επίπεδα της γλυκοζυλιωμένης αιμοσφαιρίνης (HbA1c). Παράλληλα φάνηκε ότι η
χορήγηση της εισπνεόμενης ινσουλίνης δεν προκαλούσε περισσότερα προβλήματα
στους ασθενείς, ήταν ανεκτή και αποδεκτή.
Συνεχίζοντας σε μια δεύτερη φάση την αρχική τους έρευνα, οι
γιατροί θέλησαν να δουν τι θα συνέβαινε όταν οι ίδιοι πρώτοι 121 ασθενείς, θα συνέχιζαν
την πρώτη θεραπευτική δοκιμή για ακόμη ένα χρόνο.
Στη δεύτερη φάση της έρευνας, δόθηκε η δυνατότητα από την αρχή
στους ασθενείς της κάθε ομάδας, να επιλέξουν κατά πόσο ήθελαν να συνεχίσουν τη
θεραπεία τους με την εισπνεόμενη ινσουλίνη ή εάν ήθελαν να συνεχίσουν με την
εναίσιμη ινσουλίνη.
Από τους 60 ασθενείς που αρχικά ελάμβαναν εισπνεόμενη ινσουλίνη,
οι 51 (85%) επέλεξαν να συνεχίσουν με τον ίδιο τρόπο τη θεραπεία τους. Από τους
61 που αρχικά ελάμβαναν την εναίσιμη ινσουλίνη, οι 46 (75,4%) επέλεξαν να
συνεχίσουν με την εισπνεόμενη ινσουλίνη. Οι υπόλοιποι ασθενείς στην κάθε ομάδα,
επέλεξαν να συνεχίσουν με την εναίσιμη ινσουλίνη.
Τα αποτελέσματα μετά από τη δεύτερη φάση της έρευνας διάρκειας
ενός έτους, έδειξαν ότι τα επίπεδα γλυκοζυλιωμένης αιμοσφαιρίνης (HbA1c) στο
αίμα, διατηρούσαν την ικανοποιητική μείωση που είχε παρατηρηθεί αρχικά.
Επιπρόσθετα φάνηκε ότι το
επίπεδο ικανοποίησης των ασθενών από τη χρήση της εισπνεόμενης ινσουλίνης,
παρέμενε ψηλό και οι περισσότεροι ασθενείς προτιμούσαν αυτό τον τρόπο χορήγησης
του φαρμάκου παρά την εναίσιμη μορφή.
Οι επιπλοκές της χορήγησης της ινσουλίνης και ιδιαίτερα ο
κίνδυνος υπογλυκαιμίας, δηλαδή μείωση σε πολύ χαμηλά επίπεδα της γλυκόζης
αίματος, δεν ήσαν περισσότερες στην ομάδα της εισπνεόμενης ινσουλίνης σε
σύγκριση με την άλλη.
Επίσης οι μελέτες της λειτουργίας των πνευμόνων στους ασθενείς
που έπαιρναν εισπνεόμενη ινσουλίνη, δεν έδειξαν διαφορές σε σύγκριση με την
κατάσταση στους ασθενείς που έπαιρναν εναίσιμη ινσουλίνη. Ο λόγος για τον οποίο
εξετάστηκε η λειτουργία των πνευμόνων είναι διότι υπήρχαν ανησυχίες κατά πόσο η
εισπνεόμενη ινσουλίνη θα μπορούσε να προκαλέσει βλάβες στους πνεύμονες.
Η κλινική αυτή έρευνα είναι η πρώτη που δείχνει την μακρόχρονη
αποτελεσματική δράση της εισπνεόμενης ινσουλίνης σε συνδυασμό με την
ικανοποίηση των ασθενών από τη νέα αυτή θεραπεία.
Η θεραπεία με την εισπνεόμενη ινσουλίνη, αποτελεί μια εξαιρετική
θετική εξέλιξη στον τομέα της θεραπείας του διαβήτη.
Η ευκολία χορήγησής και η αποτελεσματικότητα της, πρόκειται να
αλλάξουν αισθητά προς το καλύτερο την ποιότητα ζωής των ασθενών που πάσχουν από
διαβήτη και που χρειάζονται σήμερα να παίρνουν ενέσεις ινσουλίνης.[ω3]
Γονιδιακή θεραπεία του
σακχαρώδους διαβήτη
Ο σακχαρώδης διαβήτης οφείλεται σε µειωµένη έκκριση ινσουλίνης,
µε αποτέλεσµα την συσσώρευση µεγάλων ποσοτήτων γλυκόζης στο αίµα και τα ούρα.
Πρόκειται για µια αυτό-ανοσολογική ασθένεια, δηλαδή για µια ανωµαλία του
αµυντικού µηχανισµού του οργανισµού κατά την οποία παρουσιάζεται µια ανοσική
απόκριση ενάντια στους ίδιους του τους ιστούς. Εν προκειµένω, ο ίδιος ο
οργανισµός καταστρέφει στο πάγκρεας τα κύτταρα που παράγουν την ινσουλίνη.
Κορεάτες ερευνητές, σχεδίασαν ένα φορέα ο οποίος περιέχει τον
παρορµητή του γονιδίου K14 που εκφράζεται σε βλαστοκύτταρα της επιδερµίδας και
το γονίδιο της ινσουλίνης. Το σύµπλοκο παρορµητή-ινσουλίνης έχει τοποθετηθεί
ανάµεσα σε συγκεκριµένες αλληλουχίες που αναγνωρίζονται από το ένζυµο της
τρανσποζάσης των µεταθετών στοιχείων Ρ. Η ενσωµάτωση του συµπλόκου
παρορµητή-ινσουλίνη στα χρωµοσώµατα των βλαστοκυττάρων της επιδερµίδας
επιτυγχάνεται µε την βοηθητική παρουσία ενός δεύτερου φορέα όπου έχει
κλωνοποιηθεί το γονίδιο της τρανσποζάσης των µεταθετών στοιχείων Ρ. Επιδερµικές
ενέσεις µίγµατος των δύο φορέων σε διαβητικά ποντίκια είχε ως αποτέλεσµα την
αποκατάσταση των επίπεδων της γλυκόζης στο αίµα σε φυσιολογικά επίπεδα. Τον
Φεβρουάριο του 2001, κατατέθηκε αίτηση κατοχύρωσης της µεθόδου αυτής και κάθε
άλλης που συνδυάζει ανάλογο µίγµα φορέων για γονιδιακές θεραπείες και
κατοχύρωση προϊόντος σε ό,τι αφορά τους συγκεκριµένους φορείς για την θεραπεία
του σακχαρώδους διαβήτη.[ω8]
[α] Guyton and Hall, Φυσιολογία
του Ανθρώπου και Μηχανισμοί των νόσων, Επιστημονικές Εκδόσεις ΠΑΡΙΣΙΑΝΟΥ
Α.Ε., Αθήνα 2001, σελ. 734-741
[β] Karlson P., Gerok W., Groβ W., Κλινική Παθολογική Βιοχημεία, Ιατρικές
εκδόσεις Λίτσας, Αθήνα 1993, σελ. 213-214
[γ] http://web.indstate.edu/thcme/mwking/diabetes.html
[δ] http://kcampbell.bio.umb.edu/Oct01gifs/Insulin-.gif
[ε] http://www.gene-regulation.com/pub/databases/transpath/6.0/doc/doc/maps/insulin.html
[στ] http://www.betacell.org/content/articles/print.php?aid=1
[ζ] http://health.in.gr/diabetes/default.asp
[η] Thompson Μ. W.,McInnes R. R., Willard H. F., Ιατρική Γενετική, Πανεπιστημιακές
Εκδόσεις Κρήτης, Ηράκλειο 2001, σελ 415
[θ] http://el.wikipedia.org/wiki/%CE%94%CE%B9%CE%B1%CE%B2%CE%AE%CF%84%CE%B7%CF%82
[ι] Τσίµπος Στ. (Ενδοκρινολόγος), Σακχαρώδης∆ιαβήτης, Μετεκπαιδευτικά Μαθήµατα Ενδοκρινολογίας,
Ενδοκρινολογική Κλινική ΓΝΘ «Ιπποκράτειο» 2003, σελ.6-9
[κ] http://www.oda-edmonton.org/edmonton-protocol.htm
[λ] THE TIMES, Κωδικός άρθρου: 684586, ΠΟΛΙΤΗΣ - 04/01/2007,
Σελίδα: 10
[μ] www.mh-hannover.de/institute/clinbiochemistry/toneca/index.html
[ν] http://www.ethnos.gr/article.asp?catid=5520&subid=2&pubid=65936
[ο] http://www.cretetv.gr/news/newsf.php?ArtID=8043
[π] http://health.in.gr/news/article.asp?lngArticleID=48078
[ρ] http://www.sugarfree.gr/forum/archive/index.php/t-278.html
[σ] Nature 409,
307-312 (2001 ), 18.1.2001.
[υ] In vivo derivation of
glucose-competent pancreatic endocrine cells from bone marrow without evidence
of cell fusion, Journal of Clinical Investigation 2003;111:843-850, Μάρτιος 2003.
[φ] http://stemcell.taragana.net/archive/stem-cell-therapy-fixes-diabetic-ulcer-and-prevent-amputation/
[χ] http://3tee-Rodou.dod.sch.gr
[ω1] Anti-CD3 Monoclonal Antibody in New-Onset Type 1 Diabetes Mellitus,
The New England Journal of Medicine 2002;346:1692-1698, 30 Μαίου 2002.
[ω2] Insulinotropic Hormone Glucagon-Like Peptide-1 Differentiation of
Human Pancreatic Islet-Derived Progenitor Cells into Insulin-Producing Cells, Endocrinology
2002;143(8):3152-3161, Αύγουστος 2003.
[ω3] Patient Satisfaction and Glycemic Control After 1 Year With Inhaled
Insulin (Exubera) in Patients With Type 1 or Type 2 Diabetes, Diabetes Care 2004, 27:1318-1323, Ιούνιος 2004.
[ω4] "ß-cell function in
new-onset type 1 diabetes and immunomodulation with a heat-shock protein
peptide (DiaPep277): a randomised, double-blind, phase II trial", The Lancet 2001;358:1749-53, 24 Νοεμβρίου 2001.
[ω5] Σταμάτης N.
Αλαχιώτης, Το ΒΗΜΑ, 09/10/2005 , Σελ.: H06 Κωδικός άρθρου: B14586H061
ID: 272957
[ω6] http://www.jdrf.org.gr/aboutdiabetes_gr2.html
[ω7] MARTIN G. LOW, DEPT. PHYSIOLOGY, ENDOCRINE SYSTEM: FALL2003
[ω8] http://www.bioethics.gr/media/pdf/reports/patents_report_gr.pdf?![]()
11. Μέθοδοι προσδιορισμού νουκλεοτιδικών αλληλουχιών: Ιστορικά δεδομένα, αρχή μεθόδων, πειραματικά πρωτοκόλλα, διδακτικά σχήματα.
1859
Ο Κάρολος Δαρβίνος δημοσιεύει το βιβλίο Η Καταγωγή των Ειδών (The Origin of
Species)
1865
Ο Γκρέγκορ Μέντελ δημοσιεύει τις εργασίες του
1903
Αποδεικνύεται ότι τα χρωμοσώματα είναι φορείς του κληρονομικού
(γενετικού) υλικού
1905
Ο Γουίλλιαμ Μπέιτσον χρησιμοποιεί για πρώτη φορά τον όρο γενετική
1910
Ο Τόμας Μόργκαν (Thomas Hunt Morgan) δείχνει ότι
το γονίδια βρίσκονται στα χρωμοσώματα
1913
Ο Άλφρεντ Στούρτεβαντ (Alfred Sturtevant)
κατασκευάζει τον πρώτο γενετικό χάρτη ενός χρωμοσώματος
1918
Ο Ρόναλντ Φίσερ (Ronald Fisher) δημοσιεύει το άρθρο On the correlation between relatives on the supposition of Mendelian inheritance - η μοντέρνα σύνθεση ξεκινά
1927
Αποδίδεται ο όρος μεταλλάξεις στις αλλαγές που πραγματοποιούνται στην αλληλουχία
του DNA
1928
O Φρέντερικ Γκρίφιθ (Frederick Griffith)
πραγματοποιεί πειράματα που δείχνουν ότι στο βακτήριο πνευμονιόκοκκος υπάρχει ένα μόριο που μεταφέρει
γενετική πληροφορία
1931
Η Μπάρμπαρα Μακλίντοκ (Barbara McClintock)
αποδεικνύει ότι η μειωτική διαίρεση συνοδέυεται από ανταλλαγή
χρωματοσωμικού υλικού
1941
Οι Έντουαρντ Τάτουμ (Edward Lawrie Tatum) και Τζωρτζ Μπιντλ (George Wells Beadle) δείχνουν
ότι ο ρόλος των περισσοτέρων γονιδίων είναι να κατευθύνουν τη σύνθεση ενζύμων
1944
Οι Όσβαλντ Άβερι (Oswald Theodore Avery), Κόλιν Μακλέοντ (Colin McLeod) και Μακλίν Μακάρτι (Maclyn McCarty) επαναλαμβάνουν
το πείραμα του Γκρίφιθ in vitro και αποδεικνύουν ότι το DNA είναι το γενετικό
υλικό
1950
Ο Ίρβιν Τσάργκαφ (Erwin Chargaff) εντοπίζει την
ύπαρξη ορισμένω γενικών κανόνων που αφορούν τον αριθμό νουκλεοτίδιων σε κάθε
μόριο DNA (πχ. ότι ο αριθμός των νουκλεοτιδίων που έχουν ως βάση την αδενίνη είναι ίσος με τον αριθμό των νουκλεοτιδίων που έχουν
ως βάση τη θυμίνη.
1952
Οι Χέρσεϋ και Τσέις δείχνουν ότι το γενετικό υλικό του βακτηριοφάγου Τ2 είναι το DNA
1953
Οι Τζέιμς Γουάτσον (James D. Watson) και Φράνσις Κρικ (Francis Crick) προτείνουν το
μοντέλο της διπλής έλικας για τη δομή του DNA
1956
Οι Jo Hin Tjio και Άλμπερτ Λεβάν (Albert Levan) καθορίζουν τον
αριθμό 46 ως το πλήθος των χρωμοσωμάτων στον ανθρώπινο οργανισμό
1958
Οι Μέσελσον και Σταλ αποδεικνύουν ότι το DNA αντιγράφεται με ημισυντηρητικό τρόπο
1961
Οι Κρικ και Νίρενμπεργκ ανακαλύπτουν τη νουκλεοτιδική τριπλέτα και
αποκρυπτογραφούν εν μέρει το γενετικό κώδικα
1964
Ο Χάουαρντ Τέμιν (Howard Temin) δείχνει (μετά από
πειράματα με ιούς RNA) ότι η διατύπωση του Γουάτσον για το κεντρικό δόγμα της μοριακής βιολογίας
είναι ελλιπής
1970
Ανακαλύπτεται στους ρετροϊούς το ένζυμο αντίστροφη μεταγραφάση
1972
Δημιουργείται το πρώτο ανασυνδυασμένο μόριο DNA σε εργαστηριακές
συνθήκες
1974
Επιτυγχάνεται η κλωνοποίηση ευκαρυωτικών γονιδίων σε βακτηριακά
πλασμίδια
1977
Επιτυγχάνεται η ανάπτυξη τεχνικών προσδιορισμού της αλληλουχίας βάσεων του DNA,
από ερευνητές που δούλεψαν ανεξάρτητα, όπως οι Φρεντ Σάνγκερ (Fred Sanger), Γουόλτερ Γκίλμπερτ (Walter Gilbert) και Άλαν Μέιξαμ (Allan Maxam). Η ερευνητική ομάδα
του Σάνγκερ προσδιορίζει την αλληλουχία βάσεων του βακτηριοφάγου Φ-X174
1983
Ο Κέρι Μούλις (Kary Banks Mullis) ανακαλύπτει τη μέθοδο αλυσιδωτής αντίδρασης (PCR) που
διευκολύνει τον πολλαπλασιασμό συγκεκριμένων αλληλουχιών DNA
1985
O Άλεκ Τζέφρις (Alec Jeffreys) ανακαλύπτει τη μέθοδο αποτυπωμάτων DNA (DNA
fingerprinting)
1989
Για πρώτη φορά προσδιορίζεται η αλληλουχία βάσεων σε ανθρώπινο γονίδιο, από
τους Φράνσις Κόλινς (Francis Collins) και Λαπ-Τσι Τσούι (Lap-Chee Tsui). Πρόκειται για το
γονίδιο που κωδικοποιεί την πρωτεϊνη CFTR
1990
Ξεκινά το Πρόγραμμα για τη χαρτογράφηση του
Ανθρώπινου Γονιδιώματος
1996
Αποκρυπτογραφείται για πρώτη φορά το γονιδίωμα ενός ευκαρυωτικού οργανισμού, του Saccharomyces
cerevisiae
1998
Αποκρυπτογραφείται το γονιδίωμα του νηματοσκώληκα Caenorhabditis elegans
2003
(14 Απριλίου) Ολοκληρώνεται, ως προς το σκέλος
της χαρτογράφησης, το Πρόγραμμα για το Ανθρώπινο Γονιδίωμα.
Με ακρίβεια 99.99%, έχει αποκρυπτογραφηθεί το 99% του ανθρώπινου Γονιδιώματος
[1]
Για την εύρεση της DNA αλληλουχίας υπάρχουν κυρίως τρείς μέθοδοι:
η χημική (Maxam - Gilbert 1977), η ενζυμική (Sanger 1977).και η μέθοδος
του πυροφωσφορικού (Ronaghi
1998). Ο δεύτερος τρόπος που βασίζεται στην in vitro σύνθεση του DNA παρουσία
άλυσο-τερματικών τριφωσφορικών νουκλεοσιδίων έχει γίνει πλέον η βασική
διαδικασία ανάγνωσης της DNA αλληλουχίας. [2]
Ο πιο εύκολος και ακριβής τρόπος για τη μελέτη της πρωτοταγούς
δομής μίας πρωτεΐνης (αλληλουχία αμινοξέων) είναι η εύρεση της νουκλεοτιδικής
αλληλουχίας του γονιδίου της. Ένας cDNA (complementary DNA) κλώνος μπορεί να
παραχθεί από το αντίστοιχο mRNA.[2]
Προσδιορίζεται η νουκλεοτιδική αλληλουχία και μετά με τη χρήση
του γενετικού κώδικα ως λεξικό μπορούμε να μεταφράσουμε την νουκλεοτιδική
αλληλουχία σε αλληλουχία αμινοξέων. Κατά κανόνα υπάρχουν έξι πιθανά πλαίσια
ανάγνωσης (reading frames) το σωστό όμως αναγνωρίζεται σχετικά εύκολα επειδή
είναι το μόνο που δεν έχει συχνά κωδίκια τερματισμού.[2]
Η διαδικασία αρχίζει με ένα σετ από όμοια δίκλωνα DNA μόρια τα
οποία είναι επισημασμένα στο 5΄ άκρο τους. Στο πρώτο στάδιο οι αλυσίδες των
δίκλωνων DNA μορίων αποδιατάσσονται και υφίστανται ήπια χημική κατεργασία από
μία ένωση η οποία καταστρέφει μόνο τη μία από τις τέσσερις βάσεις στο DNA.
Επειδή η χημική επεξεργασία είναι ήπια, συνήθως μόνο ένα υπόλειμμα Α
καταστρέφεται σε κάθε αλυσίδα. Αυτό έχει ως αποτέλεσμα τη δημιουργία μιας
σειράς DNA θραυσμάτων διαφορετικού μεγέθους που αντιστοιχούν στις διαφορετικές
θέσεις στις οποίες βρίσκονται τα υπολείμματα Α στο DNA. Τα θραύσματα
διαχωρίζονται με ηλεκτροφόρηση και ανιχνεύονται με αυτοραδιογραφία, όπου
εμφανίζονται μόνο τα ραδιενεργά επισημασμένα θραύσματα. Το μέγεθος τους
αντιστοιχεί στην απόσταση από την οποία βρίσκεται το υπόλειμμα της Α από το
επισημασμένο άκρο.(Εικόνα 1 )[3]
Για την εύρεση της πλήρους νουκλεοτιδικής αλληλουχίας το ίδιο
πείραμα επαναλαμβάνεται τέσσερις φορές με τη χρήση διαφορετικών αντιδραστηρίων,
ένα για κάθε βάση. Τα θραύσματα που παράγονται διαχωρίζονται σύμφωνα με το
μέγεθος τους σε παράλληλες διαδρομές της πηκτής δίνοντας ένα μοτίβο από μία
σειρά ραδιενεργών DNA ζωνών βάση των οποίων διαβάζουμε τη νουκλεοτιδική
αλληλουχία του DNA. To νουκλεοτίδιο που βρίσκεται πιο κοντά στο 5΄ άκρο είναι
αυτό που θα καλύψει την μεγαλύτερη διαδρομή κατά την ηλεκτροφόρηση διότι είναι
το μικρότερο σε μέγεθος. Η ανάγνωση της νουκλεοτιδικής αλληλουχίας γίνεται από
το 5΄ προς το 3΄ άκρο διαβάζοντας από “κάτω” προς τα “πάνω”.[3]

Εικόνα 1
[2]
O προσδιορισμός της αλληλουχίας του DNA έχει υποστεί αλματώδη
πρόοδο με την εισαγωγή της Διδεοξύ μεθόδου του Sanger (1977) ή
μεθόδου του τερματισμού της αλυσίδας (chain-termination method).
Στην ενζυμική αυτή μέθοδο το DNA το οποίο θα αναλυθεί
χρησιμοποιείται ως εκμαγείο για την in vitro σύνθεση ενός σετ από αντίγραφα DNA
μόρια, τα οποία όλα αρχίζουν από την ίδια θέση, αλλά τελειώνουν σε διαφορετικές
θέσεις κατά μήκος του DNA εκμαγείου.[4]
Αυτό επιτυγχάνεται με τη χρήση τριφωσφορικών
διδεοξυριβονουκλειζιτών (ddNTPs) στους οποίους η 3΄-ΟΗ ομάδα που είναι παρών
στα φυσιολογικά νουκλεοτίδια λείπει. Όταν ένα τέτοιο νουκλεοτίδιο προστίθεται
στην αυξανόμενη DNA αλυσίδα τότε η σύνθεση σταματά.

5΄ -
διδεόξυ-αδενυλικό οξύ
Μαζί με τα φυσιολογικά dNTPs προστίθεται και μια μικρή ποσότητα
από ddATP έτσι ώστε η επιμήκυνση κάθε νεοσυντεθέμενης DNA αλυσίδας από την DNA
πολυμεράση θα σταματά σε τυχαίες θέσεις Α της DNA αλληλουχίας. Αυτό έχει ως
αποτέλεσμα τη δημιουργία μιας σκάλας από DNA θραύσματα διαφορετικού μεγέθους
που αντιστοιχούν σε διαφορετικές θέσεις στις οποίες βρίσκονται τα υπολείμματα Α
στο DNA.(Εικόνα 2 )[4]

Εικόνα 2 Η αντίδραση Sanger αλληλούχησης. Μονόκλωνο DNA ενισχύεται με την παρουσία φθοριζόντων ddNTPs που
χρησιμεύει για να ολοκληρώσει την αντίδραση και να σημαδέψει όλα τα τεμάχια του παραχθέντος DNA. Τα τεμάχια του DNA έπειτα χωρίζονται μέ ηλεκτροφόρηση πηκτώματος πολυακρυλαμιδίου και η ακολουθία διαβάζεται με χρήση
ακτίνων laser και κομπιούτερ. [5]
Όπως και στη χημική μέθοδο αυτά τα θραύσματα διαχωρίζονται με
ηλεκτροφόρηση και ανιχνεύονται με αυτοραδιογραφία, όπου εμφανίζονται μόνο τα
ραδιενεργά επισημασμένα θραύσματα. Η επισήμανση μπορεί να γίνει με τη χρήση
ραδιενεργά (ή χημικά) επισημασμένων DNA εκκινητήρων. Για την εύρεση της πλήρους
νουκλεοτιδικής αλληλουχίας το ίδιο πείραμα επαναλαμβάνεται τέσσερις φορές με τη
χρήση διαφορετικών ddNTP, ένα για κάθε σύνθεση. Τα θραύσματα που παράγονται
διαχωρίζονται σύμφωνα με το μέγεθος τους σε παράλληλες διαδρομές της πηκτής
πολυακρυλαμίδης (Εικόνα 3 ) δίνοντας ένα μοτίβο από μία σειρά ραδιενεργών DNA
ζωνών βάση των οποίων διαβάζουμε τη νουκλεοτιδική αλληλουχία του DNA με
κατεύθυνση 5΄ à
3΄ με άλλα λόγια με την κατεύθυνση της σύνθεσης.[4]
Κατά τον προσδιορισμό της αλληλουχίας του μονόκλωνου DNA που
γίνεται με την παραπάνω μέθοδο οι αντιδράσεις ετοιμάζονται με κιτ π.χ. της
Sequanase (version 2.0, U.S. Biochemicals) σε 7 μl DNA και την χρήση ενός
ραδιενεργά σημασμένου νουκλεοτιδίου [α-35S]-dATP ώστε οι σημασμένες αλυσίδες
διάφόρων μηκών να εντοπίζονται με αυτοραδιογραφία.[6]
Oι αλληλουχίες διαχωρίζονται σε μια υψηλής ανάλυσης
ηλεκτροφόρηση

Εικόνα 3
[7]
Η αλληλουχία DNA είναι μια από τις σημαντικότερες πλατφόρμες για
τη μελέτη των βιολογικών συστημάτων σήμερα. Ο προσδιορισμός ακολουθίας που συνηθέστερα
εκτελείται χρησιμοποιεί την τεχνολογία λήξης αλυσίδων dideoxy. Πρόσφατα, η pyrosequencing έχει προκύψει ως νέα μεθοδολογία αλληλούχισης. Αυτή η
τεχνική είναι μια ευρέως εφαρμόσιμη, εναλλακτική τεχνολογία για λεπτομερή χαρακτηρισμό
των νουκλεϊνικών οξέων. Η Pyrosequencing έχει τα πιθανά πλεονεκτήματα της ακρίβειας, ευελιξία, παράλληλη
επεξεργασία, και μπορεί να αυτοματοποιηθεί εύκολα. Επιπλέον, η τεχνική παρέχει με
την ανάγκη για σημασμένους εκκινητές, σημασμένα νουκλεοτίδια, και πήκτωμα - ηλεκτροφόρησης.
Θα εξετάσουμε τα κύρια χαρακτηριστικά σχετικά με τις διαφορετικές πτυχές της pyrosequencing τεχνολογίας, συμπεριλαμβάνοντας τις γενικές αρχές, ενζυμικές
ιδιότητες, τρόπους αλληλούχισης, ενοργάνωση, και πιθανές εφαρμογές. [8]
Pyrosequencing (πυροαλληλούχηση)
Η πυροαλληλούχιση είναι μία τεχνική DNA αλληλούχησης
που είναι βασισμένη στην ανίχνευση της απελευθέρωσης πυροφωσφορικού (PPi) κατά τη διάρκεια της
σύνθεσης DNA. Σε
μια σειρά από ενζυμικές αντιδράσεις, ορατό φως παράγεται που είναι ανάλογο προς
τον αριθμό από ενσωματωμένα νουκλεοτίδια (Εικόνα 4). Η έναρξη της σειράς
των αντιδράσεων γίνεται με μια αντίδραση πολυμερισμού νουκλεϊνικού οξέος στην οποία
ανόργανο PPi απελευθερώνεται σαν συνέπεια από την ενσωμάτωση
νουκλεοτιδίου από την πολυμεράση. Η απελευθερωμένη PPi μετατρέπεται
στη συνέχεια σε ATP από ATP σουρφορυλάση, που παρέχει την ενέργεια στη λουσιφεράση για
να οξειδώσει τη λουσιφερίνη και παράγετε το φως. Επειδή το προστιθέμενο νουκλεοτίδιο
είναι γνωστό, η ακολουθία του προτύπου μπορεί να καθοριστεί. Το μόριο
νουκλεϊνικού οξέος μπορεί να είναι είτε RNA είτε DNA. Εντούτοις, επειδή οι DNA πολυμεράσες
παρουσιάζουν υψηλότερη καταλυτική δραστηριότητα από τις RNA πολυμεράσες για
το νουκλεοτίδιο του άκρου, οι προσπάθειες έχουν στραφεί στη χρήση του αρχικού DNA πρότυπου
για την πυροαλληλούχιση. Πρότυπα χρησιμοποιείται πυροαλληλούχιση στον
τεμαχισμό Klenow της Escherichia coli DNA Pol I, η
οποία είναι σχετικά μιά αργή πολυμεράση. Η ATP sulfurylase που χρησιμοποιείται στην πυροαλληλούχιση
είναι μια ανασυνδυαζόμενη έκδοση από τη ζύμη Saccharomyces cerevisiae και η λουσιφεράση είναι από το αμερικανική πυγολαμπίδα Photinus pyralis. Η γενική αντίδραση
από τον πολυμερισμό στην ανίχνευση του φωτός πραγματοποιείται μέσα 3-4 sec στη
θερμοκρασία δωματίου. Ένα pmol DNA σε μιά αντίδραση πυροαλληλούχισης παραγει
6×1011 ATP μόρια που, στη συνέχεια, παράγει περισσότερα από 6×109 φωτόνια
σε ένα μήκος κύματος 560 νανόμετρα. Αυτό το ποσό φωτός ανιχνεύεται εύκολα από
μια φωτοδίοδο, έναν σωλήνα φωτοπολλαπλασιαστών, η μιά συσκευή συνδεμένη με κάμερα
CCD. Υπάρχουν δύο διαφορετικές
στρατηγικές πυροαλληλούχισης που είναι διαθέσιμες σήμερα: στερεάς - φάσης πυροαλληλούχισης
και υγρής - φάσης πυροαλληλούχισης. Στερεάς - φάσης πυροαλληλούχισης (Εικόνα 5)
χρησιμοποιεί ακινητοποιημένο DNA σε τρι-ενζυμικό σύστημα που περιγράφηκε προηγουμένως. Σε
αυτό το σύστημα μια πλύση βήμα εκτελείται για να αφαιρέσει το υπερβολικό
υπόστρωμα μετά από κάθε πρόσθεση νουκλεοτιδίου. Στην υγρής-φάσης πυροαλληλούχισης
(Εικόνα 6) μια απυράση, ένα ένζυμο αποικοδόμησης νουκλεοτιδίων από την πατάτα, εισάγεται
για να κάνει τέτρα - ενζυμικό σύστημα. Προσθήκη αυτού του ενζύμου έχει εξαλείψει
την ανάγκη για την στερεά υποστήριξη και ενδιάμεση πλύση με αυτόν τον τρόπο
διευκόλυνση της πυροαλληλούχισης αντίδρασης για να εκτελεσθεί σε έναν ενιαίο
σωλήνα. Αυτά τα σχήματα περιγράφονται λεπτομερώς. [8]

Εικόνα 4 Η
γενική αρχή πίσω από τα διαφορετικά συστήματα πυροαλληλούχισης αντιδράσεων. Μια
πολυμεράση καταλύει την ενσωμάτωση των νουκλεοτιδίων σε μια αλυσίδα
νουκλεϊνικού οξέος. Ως αποτέλεσμα της ενσωμάτωσης, ένα πυροφωσφορικό (PPi)
μόριο απελευθερώνεται και μετατρέπεται στη συνέχεια σε ATP, από την ATP σουλφουρυλάση.
Το φως παράγεται από την αντίδραση λουσιφεράση κατά τη διάρκεια της οποίας ένα
μόριο λουσιφερίνης οξειδώνεται. [8]

Εικόνα 5 Σχηματική
αναπαράσταση της προόδου της ενζυμικής αντίδρασης σε στερεάς φάσης πυροαλληλούχιση.
Τα τέσσερα διαφορετικά νουκλεοτίδια προστίθενται σταδιακά στο ακινητοποιημένο αρχικό
DNA πρότυπο
και η ενσωμάτωση ακολουθεί χρησιμοποιόντας τα ενζύμα ATP σουλφουρυλάση
και λουσιφεράση. Μετά από κάθε προσθήκη νουκλεοτδίου, εκτελείται ένα βήμα
πλύσης για να επιτρέψει την επαναληπτική προσθήκη. [8]

Εικόνα 6 Σχηματική
αναπαράσταση της προόδου της ενζυμικής αντίδρασης σε υγρής - φάσης πυροαλληλούχιση.
Το αρχικό DNA πρότυπο και τέσσερα ένζυμα σχετικά στην υγρή-φάση πυροαλληλούχισης
τοποθετείται σε ένα φρεάτιο από microtiter πιάτο. Τα τέσσερα διαφορετικά νουκλεοτίδια προστίθενται
σταδιακά και ακολουθεί ενσωμάτωση με χρησιμοποίηση των ένζυμων ATP σουλφουρυλάση
και λουσιφεράση. Τα νουκλεοτίδια συνεχώς αποικοδομούνται από το ένζυμο
αποικοδόμησης νουκλεοτιδίων, αφήνοντας την προσθήκη του επόμενου νουκλεοτιδίου dXTP που
δείχνει ένα από τα τέσσερα νουκλεοτίδια.[8]
DNA Sequencing και
Sequence παραλλαγές
Το πρόγραμμα του ανθρώπινου γονιδιώματος
Το πρόγραμμα του ανθρώπινου γονιδιώματος ολοκληρώθηκε μέσα στο 2003.
Μια από την αρχική περιοχή έρευνας ήταν η DNA sequencing.
Η HGP's έμφαση
ήταν στη λήψη μιάς πλήρους και ιδιαίτερα ακριβούς ακολουθίας αναφοράς (1 λάθος στις
10,000 βάσεις), κατά ένα μεγάλο μέρος συνεχής απέναντι σε κάθε ανθρώπινο
χρωμόσωμα. Οι επιστήμονες θεωρούν ότι η γνώση αυτής της ακολουθίας είναι
εξαιρετικά σημαντική για την κατανόηση της ανθρώπινη βιολογίας και για τις
εφαρμογές σε άλλους τομείς.[9]
Το" σχέδιο εργασίας " από την ακολουθία DNA του ανθρώπινου γονιδιώματος
ολοκληρώθηκε τον Ιούνιο του 2000, και δημοσιεύτηκε τον Φεβρουάριος του 2001. Το
σχέδιο εργασίας περιλαμβάνει shotgun ακολουθίας στοιχεία από τους ταξινομικούς κλώνους, με τα
χάσματα και ασάφειες εκκρεμότητες. Το σχέδιο της ακολουθία παρέχει μια θεμελίωση
για τη λήψη υψηλής ποιότητας τελικές ακολουθίες και είναι επίσης ένας πολύτιμο
εργαλείο για ερευνητές που κυνηγούν τα γονίδια των ασθενειών.[9]
Ανθρώπινο DNA Στόχοι ακολουθίας
·
Να πετύχει την κάλυψη τουλάχιστον του 90% του
γονιδιώματος σε ένα σχέδιο εργασίας με βάση τους ταξινομικούς κλώνους μέχρι το
τέλος του 2001.
·
Να τελειώσει το ένα τρίτο της ακολουθίας του
ανθρώπου DNA μέχρι το τέλος του 2001.
·
Να τελειώσει την πλήρη ακολουθία του ανθρώπινου
γονιδιώματος μέχρι το τέλος του 2003.
·
Να καταστήσει συνολικά την ακολουθία ελεύθερη
και προσιτή. [9]
Sequence Παραλλαγές
Ένας στόχος που στρέφεται επίσης στον προσδιορισμό των
μεμονωμένων παραλλαγών στο ανθρώπινο γονιδίωμα. Αν και περισσότερο από το 99% από
τις ανθρώπινες ακολουθίες του DNA είναι ίδιο σε ολόκληρο τον πληθυσμό, παραλλαγές στην
ακολουθία DNA μπορεί να ασκήσει σημαντική επίδραση στον τρόπο με τον οποίο οι
άνθρωποι αποκρίνονται στην ασθένεια από περιβαλλοντικές προσβολές όπως από τα
βακτηρίδια, τους ιούς, τις τοξίνες, και σε χημικές ουσίες σε φάρμακα και σε άλλες
θεραπείες.[9]
Οι μέθοδοι έχουν αναπτυχθεί για να ανιχνεύσουν διαφορετικοί τύποι
παραλλαγών, ιδιαίτερα ο πιό κοινός τύπος αποκαλούμενος απλού νουκλεοτιδίου πολυμορφισμοί
(SNPs), οι όποιοι
εμφανίζονται περίπου μιά φορά κάθε 100 έως 300 βάσεις. SNP χάρτες βοηθούν
τους επιστήμονες να προσδιορίσουν τα πολλαπλά γονίδια συνδεμένα με τέτοια
συμπλέγματα ασθενειών όπως ο καρκίνος, ο διαβήτης, αγγειακές ασθένειες, και
μερικές μορφές διανοητικής ασθένειας. Αυτές οι διασυνδέσεις είναι δύσκολο να εξακριβωθούν
με συμβατικές μεθόδους κυνηγιού γονιδίων, επειδή ένα απλό αλλαγμένος γονίδιο μπορεί
να κάνει μόνο μια μικρή συμβολή στον κίνδυνο για μια ασθένεια. [9]
Ανθρώπινου γονιδιώματος Ακολουθίες, Στόχοι παραλλαγών
·
Να αναπτυξει τις τεχνολογίες για γρήγορο,
μεγάλης κλίμακας προσδιορισμό και αποδοτικό του single-nucleotide polymorphisms (SNPs)
και άλλων DNA παραλλαγών ακολουθίας.
·
Να προσδιορίσει τις κοινές παραλλαγές στις
περιοχές κωδικοποίησης από την πλειοψηφία από τα προσδιορισμένα γονίδια κατά τη
διάρκεια αυτής της περιόδου 5 ετών.
·
Να δημιουργήσει έναν SNP χάρτη από τουλάχιστον
100.000 δείκτες.
·
Να αναπτύξει τα θεμέλια για τις μελέτες των
παραλλαγών της ακολουθίας.
·
Να δημιουργήσει τους δημόσιους πόρους από DNA δείγματα
και γραμμές κυττάρων. [9]
|
Περιοχή |
HGP Στόχος |
Πρότυπα πραγματοποίησης |
Ημερομηνία πραγματοποίησης |
|
DNA αλληλουχία |
95% των γονιδίων που περιέχουν μέρος των
ανθρώπινων αλληλουχιών ολοκληρωμένες με ακρίβεια 99.99% |
99% των γονιδίων που περιέχουν μέρος των
ανθρώπινων αλληλουχιών ολοκληρωμένες με ακρίβεια 99.99% |
Απρίλιος 2003 |
|
Ικανότητα και κόστος της ολοκληρωμένης
αλληλούχισης |
αλληλουχίες 500 Mb/έτος με < $0.25 για κάθε βάση |
αλληλουχίες >1,400 |
Νοέμβριος 2002 |
|
παραλλαγές αλληλουχίας στον άνθρωπο |
100,000 χαρτογράφηση SNPs ανθρώπου |
3.7 εκατομμύρια χαρτογράφηση SNPs ανθρώπου |
Φεβρουάριος 2003 |
[9]
(Basic Local Alignment Search Tool)
Ο αλγόριθμος BLAST
χρησιμοποιείται για τη σύγκριση μιας ακολουθίας με μια βάση δεδομένων, έχει
αρχικά αναπτυχθεί και διατηρείται από το NCBI (National Center for Biotechnology Information)
( http://www.ncbi.nlm.nih.gov/BLAST/)
(αλλά λόγω του ότι διατίθεται ελεύθερα υπάρχουν εκδόσεις του και σε άλλες
αντίστοιχες βάσεις. Είναι ένας ευριστικός (heuristic) αλγόριθμος σύγκρισης ακολουθιών βελτιστοποιημένης
ταχύτητας που χρησιμοποιείται για να ψάχνει σε βάσεις ακολουθιών την άριστη
τοπική στοίχιση με μια αναζήτηση. Η αρχική αναζήτηση γίνεται για μια λέξη
μήκους "W" (3
στο blastp) που δίνει
αποτελέσματα για τουλάχιστον "T", όταν συγκρίνεται με την ζητούμενη ακολουθία,
χρησιμοποιώντας έναν δεδομένο πίνακα υποκαταστάσεων (substitution matrix). Οι επιτυχείς λέξεις
που έχουν score T ή
μεγαλύτερο επεκτείνονται και προς τις δύο κατευθύνσεις σε μια απόπειρα να
παραχθούν στοιχίσεις που να υπερβαίνουν το προκαθορισμένο κατώφλι (threshold) "S". Οι περιοχές που
ικανοποιούν αυτή τη συνθήκη ονομάζονται HSP (High-scoring Segment Pair). Η παράμετρος "T" καθορίζει την
ταχύτητα και την ευαισθησία της αναζήτησης (Εικόνα 1). Ενώ το BLAST υπολογίζει τις παραμέτρους της EVD (Extreme Value Distribution), απο τις οποίες
θα υπολογίσει τη στατιστική σημαντικότητα από εξομοιώσεις που έχει
πραγματοποιήσει από πριν, το FASTA
τις υπολογίζει από όλες τις άλλες ακολουθίες της βάσης δεδομένων και για αυτό
το λόγο είναι και πιο αργό. [10]

Εικονα 7 : Ο αλγόριθμος του BLAST. Ο αλγόριθμος BLAST είναι μια
διαισθητική (ευριστική) μέθοδος αναζήτησης που αναζητάει λέξεις μήκους W
(προκαθορισμένο = 3 στο blastp) που σημειώνουν score μεγαλύτερο απο ένα
προκαθορισμένο όριο (Threshold-T) όταν στοιχίζονται με την δοθείσα ακολουθία
και με ένα δεδομένο πίνακα υποκατάστασης. Οι λέξεις στη βάση δεδομένων που
σημειώνουν score επεκτείνονται και προς τις δυο κατευθύνσεις σε μία προσπάθεια
να μεγιστοποιηθεί το score, σύμφωνα με κάποιο κριτήριο ευαισθησίας (επίσης
προκαθορισμένο απο πριν, συνήθως 10) του Ε-value. Στη συγκεκριμμένη περίπτωση η
τριπλέτα PQG έχει βρεθεί να στοιχίζεται στην PMG, και καθώς χρησιμοποιείται ο
πίνακας BLOSUM62, το score της στοίχισης είναι 13>Τ (P-P =7, G-G=6, Q-M=0).
Κατόπιν αυτή η τριπλέτα θα επεκταθεί και προς τις δυο κατευθύνσεις για να δώσει
τη μέγιστη τοπική στοίχιση. Τα HSPs που πληρούν αυτά τα κριτήρια θα αναφερθούν
από το BLAST, υπό τον όρο ότι δεν υπερβαίνουν τoν αριθμό των επιτρεπτών προς
εμφάνιση ακολουθιών. [10]
Η περιοχή αναζήτησης ('Search' box) του BLAST δέχεται
διαφορετικούς τύπους μορφοποιημένης εισόδου και αυτόματα καθορίζει τη μορφή. [10]

Εικόνα 8 [11]
Γρήγορες και χαμηλού κόστους DNA sequencing μέθοδοι θα
ανήγγελλαν μια πραγματική επανάσταση στην ιατρική. Ένα πρόσωπο θα είχε το
πλήρες γονιδίωμά του/της αλληλουχιμένο έτσι ώστε τα φάρμακα να μπορούν να
προσαρμοστούν σε συγκεκριμένη του/της ασθένεια; οι γιατροί θα ήξεραν εκ των
προτέρων για τους ασθενείς’ την πιθανότητα για να αναπτύξει μια δεδομένη
ασθένεια; θεραπείες σε σημαντικές ασθένειες θα μπορούσαν να βρεθούν γρηγορότερα.
Εντούτοις, αυτό το όνειρο της "εξατομικευμένης ιατρικής" παρεμποδίζεται
σήμερα από τις ακόμα υψηλού κόστους και αργές DNA sequencing μεθόδους.
Κοστίζει ακόμα τουλάχιστον 10 εκατομμύρια $ να αλληλουχίσεις 3 δισεκατομμύρια ζεύγη
ανθρώπινες βάσεις γονιδιώματος κατά τη διάρκεια μιας περιόδου
6 μηνών. [11]
Εξερευνάμε απολύτως μιά νέα προσέγγιση της sequencing που
υιοθετεί η δυνατότητα διακίνησης του ss-DNA στα nanopores από λίγα nanometers σε διάμετρο. Κατά τη διάρκεια
της DNA δυνατότητας διακίνησης στο nanopore, ηλεκτρικό ρεύμα θα εγχεόταν
στην εγκάρσια κατεύθυνση έτσι ώστε ένα μοναδικό σήμα να αναμένεται να
ανιχνευθεί για κάθε ένα νουκλεοτίδιο.[12]
Το ολόκληρο γονιδίωμα θα μπορούσε να μεταφερθεί στον πόρο σε λεπτά
με κόστος λίγων χιλιάδων δολαρίων, π.χ. μεγέθη γρηγορότερα και φτηνότερα από
τις παρούσες μεθόδους. Ενώ αυτή η προσέγγιση είναι μέχρι τώρα ακριβώς μια
θεωρητική πρόταση, και πειραματικές ομάδες εργάζεται για να το κάνει μια
πραγματικότητα. [12]
Υιοθετούμε μοριακής δυναμικής προσομοιώσεις που συνδέονται με κβαντικής-μηχανικής
υπολογισμούς του ηλεκτρικού ρεύματος για να ερευνήσει τη δυνατότητα
πραγματοποίησης αυτής της προσέγγισης σε πειραματικά εφικτά συστήματα. Οι αριθμοί
παρουσιάζουν μια περίπτωση στην οποία 15 βάσεις αδενίνης (ένα polynucleotide, αναπαρίσταται
σαν κίτρινο η κόκκινο) μεταφέρετε κατευθείαν σε στερεά κατάσταση σε b-Si3N4 νανοπόρους (μπλε). Τα γκρίζα σημεία αντιπροσωπεύουν τα άτομα από
δύο ζευγάρια από τα χρυσά ηλεκτρόδια (το τέταρτο χρυσό ηλεκτρόδιο δεν είναι
ορατό στην Εικόνα 8 ) τοποθετημένος στον πόρο έτσι ώστε ηλεκτρικό ρεύμα να μπορεί
να ρεύσει από ένα ηλεκτρόδιο στο αντίθετο. Δύο διαφορετικά ρεύματα (ένας μπλε και
ένα κόκκινο στην Εικόνα 8 ) από κάθε ζευγάρι αντίθετα - τοποθετημένο τα
ηλεκτρόδια υπολογίζονται σαν λειτουργία του χρόνου ενώ οι βάσεις αδενίνης
μεταφέρουν (τρία στιγμιότυπα της δυνατότητας διακίνησης παρουσιάζονται). Η ανάλυση
αυτών των ρευμάτων αποκαλύπτει τους προσανατολισμούς των βάσεων στον πόρο. Αυτές
οι προσομοιώσεις είναι ουσιαστικές στους εμπειριοκρατείς οδηγούς στην
πραγματοποίηση γρήγορων και χαμηλού κόστους DNA sequencing μεθόδων δεδομένου ότι παρέχουν
λεπτομερείς ηλεκτρονικές και ατομικές πληροφορίες σχετικά με τις φυσικές
διαδικασίες που λαμβάνουν χώρα κατά τη διάρκεια της μεταφοράς του DNA σε
στερεάς κατάστησης nanopores.
[11]
Shotgun sequencing
Shotgun sequencing είναι μια μέθοδος χρησιμοποιούμενη στη γενετική για να
αλληλουχίσει μεγάλα τμήματα DNA. Τη μέθοδο λήξης αλυσίδων
της DNA αλληλούχισης μπορούμε μόνο να τη χρησιμοποιήσουμε για αρκετά
μικρά τμήματα, και είναι απαραίτητο να τα κόψουμε σε περισσότερες ακολουθίες
και έπειτα να συγκεντρώσουμε τα αποτελέσματα για να δώσουμε τη γενική ακολουθία.
Περπατώντας στο χρωμόσωμα, αυτή η διχοτόμηση γίνεται προοδευτικά σε ολόκληρο τον
κλώνο, κομμάτι κομμάτι; Η shotgun sequencing χρησιμοποιεί γρηγορότερη, αλλά πιό σύνθετη, διαδικασία για
να συγκεντρωθούν τα τυχαία κομμάτια της αλληλουχίας.
Στην shotgun sequencing,
το DNA
χωρίζεται τυχαία στα πολυάριθμα μικρά τμήματα, που τοποθετούνται
διαδοχικά με χρήση της μεθόδου λήξης των αλυσίδων για να γίνει το διάβασμα. Η πολλαπλή
επικάλυψη που διαβάζει το στόχο του DNA λαμβάνεται με την εκτέλεση διάφορων κύκλων
τεμαχισμού και αλληλούχισης. Τα προγράμματα των υπολογιστών χρησιμοποιούν
έπειτα τις επικαλύπτοντας άκρες από διαφορετικά διαβάσματα για να τα
συγκεντρώσει σε μια παρακείμενη ακολουθία.
Παραδείγματος χάριν, εξετάζουμε τους ακόλουθους δύο κύκλους από shotgun διαβάσματα:
Αρχικός κλώνος : AGCATGCTGCAGTCATGCTTAGGCTA
Πρώτος κύκλος shotgun διαβάζει : AGCATGCTGCAG
TCATGCTTAGGCTA
Δεύτερος κύκλος shotgun διαβάζει: TTAGGCTA
AGCATGCTGCAGTCATGC
Σε αυτό το εξαιρετικά απλουστευμένο παράδειγμα, τα τέσσερα
διαβάσματα μπορούν να συγκεντρωθούν στην αρχική ακολουθία με χρήση της
επικάλυψης των ακρών τους για να τους ευθυγραμμίσει και να τους διατάξει. Στην
πραγματικότητα, αυτή η διαδικασία χρησιμοποιεί τεράστια ποσά από πληροφορίες
που είναι γεμάτο με ασάφειες και λάθη αλληλούχισης. Συγγέντρωση από σύνθετα γονιδιώματα
είναι επιπρόσθετα βεβαρημένα με μεγάλη αφθονία επαναλαμβανόμενων ακολουθιών, όπου
η σημασία παρόμοιων μικρών διαβασμάτων θα μπορούσε να προέλθει από εντελώς
διαφορετικά μέρη της ακολουθίας.
Για πολλά επικαλυπτόμενα διαβάσματα κάθε τμήματος του αρχικού DNA είναι
απαραίτητο να ξεπεραστούν αυτές οι δυσκολίες και να συγκεντρωθεί η ακριβής ακολουθία.
Παραδείγματος χάριν, για να ολοκληρωθεί το Human Genome Project, το μεγαλύτερο μέρος του ανθρώπινου γονιδιώματος
τοποθετήθηκε διαδοχικά σε 12X ή με μεγαλύτερη κάλυψη. δηλαδή κάθε βάση στην τελική
ακολουθία ήταν παρούσα, κατά μέσον όρο, σε 12 διαβάσματα. Ακόμα κι έτσι, τρέχουσες
μέθοδοι έχουν αποτύχει στο να απομονώσουν ή να συγκεντρώσουν μια αξιόπιστη
ακολουθία για περίπου 1% του (ευχρωματικού) ανθρώπινου γονιδιώματος.[13]
Ολόκληρου
του γονιδιώματος shotgun αλληλούχιση
Ολόκληρου του γονιδιώματος shotgun αλληλούχιση είναι μια εφαρμογή
για pairwise και αλληλούχιση, γνωστή κατά το κοινώς λεγόμενο σαν διπλή -
βαρελοειδή shotgun αλληλούχιση. Δεδομένου ότι τα προγράμματα αλληλούχισης άρχισαν
να γίνονται όλο και πιό περίπλοκα, πολλαπλές ομάδες άρχισαν να πραγματοποιούν εκείνες
τις χρήσιμες πληροφορίες που θα μπορούσαν να ληφθούν με την αλληλούχιση και των
δύο ακρών ενός τμήματος DNA.
Αν και τοποθετώντας διαδοχικά και τις δύο άκρες του ίδιου τμήματος και παρακολουθώντας
τα δεδομένα του ζευγαρώματος ήταν πιό δυσκίνητο από το να τοποθετούμε διαδοχικά
ένα απλό τέλος από δύο ευδιάκριτα τμήματα, η γνώση για τις δύο ακολουθίες που προσανατολίζονται
σε αντίθετες κατευθύνσεις και για το μήκος κάθε ενός τεμάχιου, ήταν πολύτιμη
στην αναδημιουργία της ακολουθίας του αρχικού τμήματος στόχων. Ο πρώτος που δημοσίευσε
την περιγραφή της χρήσης των ζευγαρωμένων άκρων ήταν ο Edwards και άλλοι
το 1990 ως τμήμα της αλληλούχισης της θέσης στον άνθρωπο της υποξανθίνης-γουανίνης
φωσφοριβοσυλτρανφεράσης, αν και η χρήση των ταξινομημένων κατά ζεύγος ακρών
περιορίστηκε στο κλείσιμο των χασμάτων μετά από την εφαρμογή μιάς παραδοσιακής shotgun αλληλούχισης
προσέγγιση. Η πρώτη θεωρητική περιγραφή μίας καθαρής pairwise και μιας
στρατηγικής αλληλούχισης, να υποθέσει τεμάχια σταθερού μήκους, ήλθε από τον Edwards και
τον Caskey το 1991. Συν το χρόνο, υπήρξε κοινή συναίνεση ότι το
βέλτιστο μήκος των τεμαχίων για pairwise και αλληλούχιση θα ήταν τρεις φορές το μήκος της διαβασμένης
ακολουθίας. Το 1995 ο Roach και άλλοι εισήγαγε την καινοτομία της χρησιμοποίησης των
τεμαχίων ποικίλων μεγεθών, και κατέδειξε ότι μια καθαρή pairwise και-αλληλούχισης
στρατηγική θα ήταν δυνατή σε μεγάλους στόχους. Η στρατηγική υιοθετήθηκε στη συνέχεια
από το Ίδρυμα για γενωμική έρευνα (TIGR) για να αλληλουχίσει το γονιδίωμα του βακτηριδίου Haemophilus influenzae το
1995, και έπειτα από το Celera Genomics για να αλληλουχίσει το γονιδίωμα
μυγών φρούτων το 2000, και στη συνέχεια το ανθρώπινο γονιδίωμα. [13]
Δύο νέες DNA Sequencing μέθοδοι αποκαλύπτονται
Δύο πρόσφατα αναπτυγμένες μέθοδοι DNA αναμένεται να είναι
ουσιαστικά γρηγορότερες και φτηνότερες από την υπάρχουσα μέθοδο.
Γράφοντας στο τρέχον θέμα της επιστήμης, ο Jay Shendure και
ο George Church από το Harvard Medical School (Εικόνα 9 )αναφέρουν την ανάπτυξη σε ένα σύστημα, ενώ ο Branford, Conn., company - 454 Life Sciences - πρόσφατα ανήγγειλε
μια παρόμοια ανάπτυξη.(Εικόνα 10 )

Εικόνα 9 [14]

Εικόνα 10 Προετοιμασία δειγμάτων για στερεάς φάσης sequencing (A) Τεμάχια ολόκληρου του γονιδιώματος επιδένεται
στους εξειδικευμένους προσαρμοστές (B) Τα τεμάχια συλλαμβάνονται επάνω σε Sepharose χάντρες.
Το DNA ενισχύεται με υδάτινα microreactors που αναστέλλονται στο πετρέλαιο. (C) Ενισχυμένα Clonally τεμάχια φορτώνεται στο
PicoTiter πιάτο (fiberoptic slide).
(D) Χάντρες με ακινητοποιημένα
sequencing και τα ένζυμα ανίχνευσης προστίθενται στα φρεάτια. (E) Τα πιάτα φορτώνονται στο Genome Sequencer 20. Όλα τα τεμάχια αλληλουχούνται
ταυτόχρονα.[15]
Η επιχείρηση είπε ότι η εφεύρεσή της είναι "100 φορές
γρηγορότερη και φτηνότερη από την ανταγωνιστική τεχνολογία."
Κάθε μια από τις δύο νέες μεθόδους DNA sequencing, εάν λειτουργούν
όπως υπόσχονται, θα έβαζε το αντίτιμο των 50 εκατομμυρίων $ στο genome-sequencing center στο
γραφείο του κάθε ερευνητή και παθολόγου.
Μια σημαντική διαφορά μεταξύ των δύο νέων μεθόδων είναι η τιμή. Η
454 Life Sciences DNA sequencing μηχανή πωλείται για $500,000, αν και η επιχείρηση λέει ότι κάνει
την εργασία των $50 million DNA sequencing center.
Η μηχανή του Χάρβαρντ χρησιμοποιεί τη "off-the-shelf ενοργάνωση και αντιδραστήρια," και είναι ακόμα
φτηνότερη σύμφωνα με τους ερευνητές.
Το πρώτο ανθρώπινο γονιδίωμα για να ολοκληρωθεί κοστίζει περίπου $800 million. Αλλά στο μέλλον, ο Church είπε στους Times, η διαδικασία να κοστίζει τόσο λίγο όσο τα $20,000. [16]
[1] http://el.wikipedia.org/wiki/Γενετική
[2] http://www-jcb.bio.auth.gr/mor_biol/nucleicacids/texts/nucleicacids79.htm
[3] http://www-jcb.bio.auth.gr/mor_biol/nucleicacids/frames/na48.htm
[4] http://www-jcb.bio.auth.gr/mor_biol/nucleicacids/frames/na49.htm
[5] Helmut Kae,
GENOME PROJECTS: UNCOVERING THE BLUEPRINTS OF BIOLOGY, The Science Creative
quarterly, 2003.
[6] ΣΩΦΡΟΝΙΔΗΣ Δ
ΚΟΣΜΑΣ, ΠΟΛΥΜΟΡΦΙΣΜΟΣ ΤΟΥ
ΜΤDNA THΣ ΤΣΙΠΟΥΡΑΣ (Sparus aurata) ΚΑΙ ΟΙ
ΦΥΛΟΓΕΝΕΤΙΚΕΣ ΣΧΕΣΕΙΣ ΤΗΣ
ΜΕ ΑΛΛΑ ΕΙΔΗ ΤΗΣ ΟΙΚΟΓΕΝΕΙΑΣ SPARIDAE, ΜΕΤΑΠΤΥΧΙΑΚΗ ΔΙΑΤΡΙΒΗ, ΗΡΑΚΛΕΙΟ 1993.
[7] Alberts, Bray, Johnson, Lewis, Raff, Roberts, Walter, Βασικές
Αρχές Κυτταρικής Βιολογίας, Εισαγωγή στην Μοριακή Βιολογία του Κυττάρου,
Ιατρικές Εκδόσεις Π.Χ. Πασχαλίδης, σελ.375.
[8] Mostafa
Ronaghi, REVIEW, Pyrosequencing Sheds Light on DNA Sequencing, Genome
Technology Center, Stanford University, Palo Alto, California 94304,USA, Vol.
11, Issue 1, 3-11, January 2001.
[9] F. Collins,
Ari Patrinos, et al., "New Goals for the
[10] Ζωή Λίτου, Παντελής Μπάγκος & Σταύρος Ι. Χαμόδρακας, BLAST-FASTA-CLUSTAL,
Εργαλεία αναζήτησης ομοιοτήτων και πολλαπλής στοίχισης ακολουθιών, ΕΡΓΑΣΤΗΡΙΑΚΗ
ΑΣΚΗΣΗ, Τομέας Βιολογίας Κυττάρου & Βιοφυσικής, Τμήμα Βιολογίας, Παν/μιο
Αθηνών, Φεβρουάριος 2002
[11]
Massimiliano Di Ventra, DNA Sequencing via Transverse Transport, Department of
Physics, UCSD January 12, 2006.
[12] M. Zwolak
and M. Di Ventra, “Electronic Signature of DNA Nucleotides via Transverse
Transport”, Nano Lett. 5, 421 (2005).
[13] http://en.wikipedia.org/wiki/Shotgun_sequencing
[14] http://www.esi-topics.com/fbp/2006/june06-GeorgeMChurch2.gif
[15] Kate
Marusina, Ph.D., GEN UPDATES in biotechnology: Next-Generation
Sequencing Novel Methodologies for Rapid, Low-Cost Sequencing, September 1,
2005
[16]